猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种急性、发热、高度接触性的严重传染病[1]。由于猪瘟流行爆发给养猪业、国际贸易和食品安全带来的严重危害,世界动物卫生组织(OIE,2002)将猪瘟列为法定必须上报的动物传染病之一,我国出台的《国家中长期动物疫病防治规划(2012-2020 年)》中也将其列为优先防治的五种一类动物疫病之一[2, 3]。目前国内贯彻预防为主的方针,免疫接种猪群猪瘟兔化弱毒疫苗(HCLV)应对全国各个地区猪瘟的不间断散发流行[4]。
猪睾丸细胞系(ST)与猪同源,是猪瘟病毒最为易感的细胞系之一,能稳定猪瘟疫苗生产工艺并有效提高病毒滴度,在猪瘟细胞源疫苗研究中被广泛使用[5, 6]。目前利用ST 细胞生产猪瘟疫苗大多采用传统的滚瓶贴壁培养工艺,操作过程繁琐,疫苗产量有限[7]。微载体悬浮培养体系具有比表面积大、易检测、易控制等优点,能为细胞生长及病毒增殖提供相对优良、恒定的培养环境,在细胞源疫苗生产中已得到广泛应用,如狂犬病疫苗、流感疫苗等[8, 9, 10, 11]。建立稳定高效的ST 细胞微载体培养体系,能克服滚瓶培养工艺的缺陷,是大规模生产细胞源猪瘟疫苗的重要基础。
许多研究表明,细胞的生长与细胞接种密度和微载体浓度密切相关[12, 13, 14, 15, 16, 17, 18, 19]。一般细胞接种密度越高,最高活细胞密度(Viable cell density,VCD)也越高,但易引起营养物的不足与代谢副产物累积造成难以维持高细胞密度,而较低的接种密度可能使初始细胞量与微载体的比例过低,影响初期细胞与微载体的接触及黏附,微载体空球现象增加;相应地,提高微载体浓度可以增加贴壁面积,但同时微载体之间碰撞的几率增加,造成细胞损伤机会也增多,细胞扩增倍数未能按理想状况成比例增加,此时,过高浓度的微载体会增加成本。因此,在ST 细胞大规模培养过程中,选择合适的微载体浓度与细胞接种密度提高微载体利用率,对细胞增殖、维持和后期接种病毒的扩增效率尤为重要。
本研究在本实验室前期自行设计开发的ST 细胞低血清贴壁培养基与DMEM+10%FBS 两种培养基基础上,考察微载体浓度及细胞接种密度对细胞生长代谢的影响,旨在提高微载体利用率,并在灌注培养体系初步实现ST 细胞的培养。
1 材料与方法 1.1 材料实验所用贴壁依赖型猪睾丸传代细胞系ST 细胞株(Swine testis cells)购自中国兽医药品监察所。贴壁型ST 细胞培养用培养基:DMEM(Gibco 公司)补加3.7 g/L 碳酸氢钠(Amresco 公司),添加10%胎牛血清FBS(Fatal Bovine Serum,南京Wisent公司)。
贴壁型ST 细胞培养用低血清培养基:本实验室自行设计开发,包括葡萄糖、氨基酸、维生素、无机盐和金属离子等成分,补加1%FBS。
1.2 方法 1.2.1 ST 细胞培养方法 1.2.1.1 ST 细胞方瓶培养待贴壁型ST 细胞生长至铺满方瓶(TPP 公司)底部约80%-90% 时,吸去培养基,PBS 漂洗2-3 次,加入0.25%(W/V)胰酶(Sigma公司)-0.05%(W/V)EDTA(Sigma 公司)消化液置于37℃、5%CO2 饱和湿度培养箱孵育,当细胞收缩变圆,轻摇方瓶至脱落时,稀释接种,接种密度为2×105-3×105 cells/mL。
1.2.1.2 ST 细胞搅拌瓶贴壁培养所用微载体为Cytodex 1(GE Healthcare)。称量所需微载体于125mL 搅拌瓶(Corning 公司),PBS 洗涤3 次至微载体水化、膨胀完全后去除多余PBS,121℃湿热灭菌30 min 待用。将消化后的细胞种子液接种至装有微载体的无菌搅拌瓶,培养液体积为100 mL,放置于37℃、5%CO2 饱和湿度培养箱中搅拌平台(INTEGRA)培养,搅拌转速为50 r/min,每24 h 取样进行细胞计数与代谢分析。
1.2.1.3 ST 细胞灌注培养采用自制灌注培养设备进行细胞灌注培养。如图 1 所示,该装置主要由灌注培养腔(120 mL)、培养基存贮瓶(120 mL)、灌注循环系统构成。使用3 g FibraCel disk 微载体(NBS 公司)。将消化后的细胞种子液转移到经高压灭菌的灌注培养装置中,接种密度2×105 cells/mL于37℃、5%CO2 饱和湿度培养箱中进行灌注培养,控制培养基流速为2.5 mL/min,每24 h 取样进行代谢分析,每3 d 进行存贮瓶全换液,培养15 d 后取出微载体进行细胞密度检测。

|
| 图 1 灌注培养体系装置与示意图 |
细胞生长代谢的影响 将5×105 cells/mL ST 细胞接种至125 mL 搅拌瓶,搅拌瓶中微载体用量分别为1、3、5 和7 g/L。
1.2.2.2 细胞接种密度对ST细胞生长代谢的影响 接种微载体用量为3 g/L 的125 mL 搅拌瓶,接种密度分别为1×105、3×105、5×105 和10×105cells/mL。
1.2.3 分析方法 1.2.3.1 细胞密度与增殖参数测定微载体上贴附生长的细胞以0.1% 低渗结晶(贝基生物科技有限公司)-0.1 mol/L 柠檬酸(Sigma 公司)染液染色,台式振荡器37℃ 振荡过夜,PBS 稀释至适当浓度后用血球计数板计数紫色细胞核。
1.2.3.2 DNA含量检测 取10 片disk 于EP 管中,PBS 漂洗后,经1 mL 0.5 g/L 木瓜蛋白酶(Sigma 公司)恒温水浴锅60℃孵育24 h,-20℃冻存待用。事先配制100 ng/mL Hoechst 33258(Invitrogen 公司)TNE 溶液,并提取2.68×106 cells/mL 细胞悬液所含DNA,按Hoechst 荧光定量法在350 nm 波长下使用核酸蛋白荧光分析仪(Bio-Rad)测量荧光强度并绘制DNA 标准曲线,取5 μL 样品DNA 进行含量测定并换算成细胞密度。
1.2.3.3 搅拌瓶中细胞培养的代谢物浓度测定葡萄糖浓度测定采用葡萄糖试剂盒(上海科欣生物试剂公司),操作按使用说明书进行。乳酸浓度测定采用乳酸测定试剂盒(南京建成生物工程公司),操作按使用说明书进行。氨浓度采用尿素氮试剂盒(上海申索试剂有限公司)测定,操作按使用说明书进行。
1.2.3.4 灌注装置中细胞培养代谢物浓度测定培养过程中葡萄糖、乳酸、氨的浓度和pH 值均采用全自动生化分析仪BioProfile 400 Analyzer 测定。
1.2.4 计算方法 1.2.4.1 细胞比生长速率的计算比生长速率μ 通过以下公式计算:
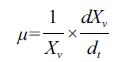
式中,XV :活细胞密度(106 cells/mL),t :培养时间(d)。
1.2.4.2 葡萄糖比消耗速率、乳酸比生产速率的计算葡萄糖的比消耗速率和乳酸的比生成速率计算方法相似,以葡萄糖比消耗速率为例,通过以下公式计算:
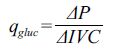
式中,qgluc :葡萄糖的比消耗速率(mmol/109 cells/day),代表细胞消耗葡萄糖的速率;P :葡萄糖的浓度(mmol/L);IVC :微载体上贴附生长的总细胞数目对时间的积分(109 cells·day)。
1.2.4.3 乳酸对葡萄糖的转化率的计算乳酸对葡萄糖转化率Ylac/gluc(mmol/mmol)通过下式计算。
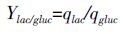
分别使用DMEM 和LSM 两种培养基在T150 方瓶中连续传代培养ST 细胞30 d,比较两者ST 细胞比生长速率。ST 细胞在DMEM 培养基中平均比生长速率为0.545 d-1(图 3-A);在LSM 培养基中,ST 细胞平均比生长速率为0.626 d-1(图 3-B)。相比DMEM 培养基,ST 细胞在LSM 中以更高的比生长速率连续稳定传代。
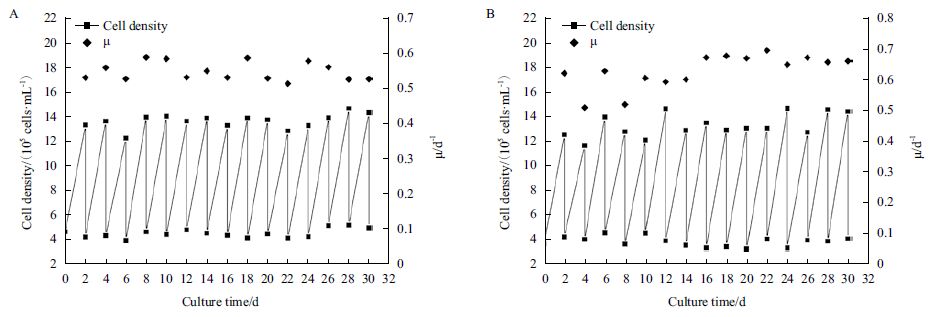
|
| 图 2 ST 细胞T150 方瓶连续传代曲线 |
|
| 图 3 不同微载体浓度条件下ST 细胞生长曲线与贴附情况(40×) |
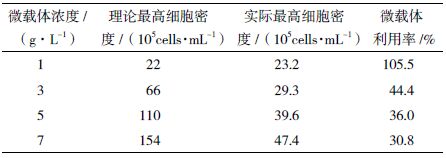
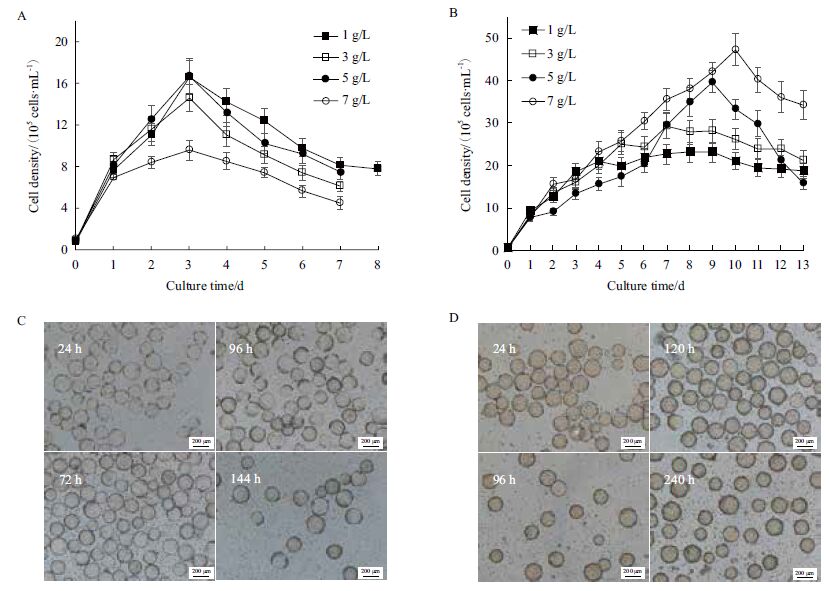
图 3-A 是使用DMEM 培养基搅拌瓶培养体系,不同微载体浓度条件下ST 细胞密度随时间的变化。固定细胞接种密度为5.0×105 cells/mL 时,4 个条件下的ST 细胞密度在接种后24 h 内细胞密度变化基本一致,且均在第3 天达到最大,分别为16.6×105、14.6×105、15.1×105 和9.5×105 cells/mL。随着微载体浓度的上升,最大细胞密度不升反降,在微载体浓度为7 g/L 条件下,细胞生长缓慢仅扩增0.9 倍。从ST 细胞增殖情况较好5 g/L 微载体浓度的倒置显微镜明场(图 3-C)可以看出,使用DMEM 培养基在培养过程中始终存在微载体未贴满的现象。
对比图 3-B 使用LSM 培养基搅拌瓶体系培养ST 细胞,4 组不同微载体浓度实验组ST 细胞密度分别在第4 天、第7 天、第9 天、第10 天时达到最大,为23.2×105、29.3×105、39.6×105 和47.4×105cells/mL,均显著高于相同条件下DMEM 培养基对应实验组的最大细胞密度。1 g/L 微载体用量的实验组在第4 天细胞密度达到最大后,存在一个维持了5 d 的平台期。并且从该条件下ST 细胞显微镜明场(图 3-D)也可以看出,培养过程中,微载体几乎始终处于满球的状态。
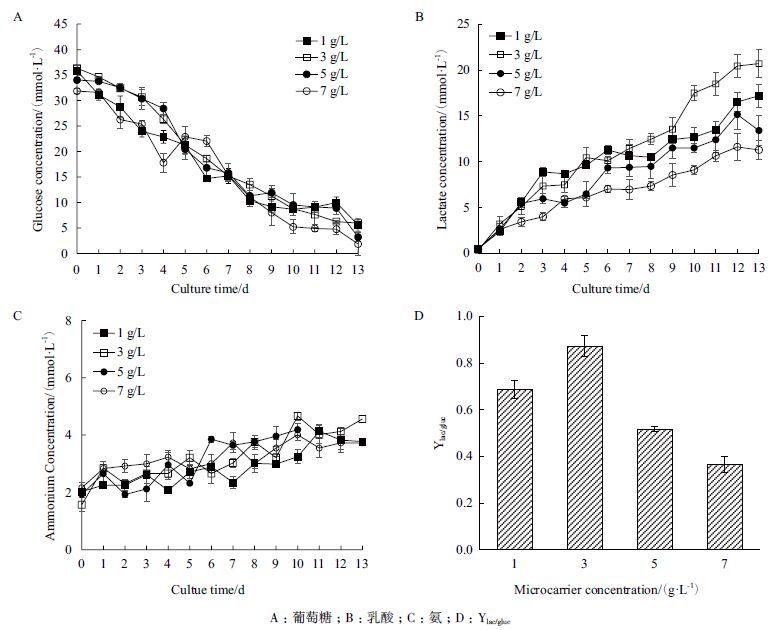
从细胞培养中葡萄糖、乳酸和氨的浓度变化来看,使用LSM 葡萄糖消耗情况并未有显著差别,4 个微载体浓度条件下第13 天葡萄糖浓度分别为5.60、5.99、3.23 和1.88 mmol/L( 图 4-A)。氨均未大量生成,培养结束时分别为3.77、4.56、3.81 和3.23 mmol/L(图 4-C)。而副产物乳酸在培养过程中呈现持续累积的情况,培养结束时分别为17.2、20.7、13.4 和11.3 mmol/L(图 4-B)。从图 4-D 可以看出,微载体浓度为7 g/L 的条件下乳酸对葡萄糖的得率最低,3 g/L 条件下该得率最高。
|
| 图 4 LSM 不同微载体浓度对ST 细胞代谢的影响 |
根据单个ST 细胞贴壁面积约为200 μm2,每克Cytodex 1 能提供的生长表面积为4 400 cm2。计算不同浓度微载体理论最高ST 细胞密度,并与实际值相比得到微载体的利用率进行比较(表 1)发现,3 g/L的微载体用量既能提供充足的贴壁面积,又能保持较高的微载体利用率,所以使用该浓度进一步研究细胞接种密度对细胞生长的影响。
图 5-A 是使用DMEM 培养基搅拌瓶培养体系,不同ST 细胞接种密度条件下细胞密度随时间的变化。固定微载体浓度为3 g/L 时,不同细胞接种密度条件下,4 个实验组分别在第2 天、第3 天、第5天和第6 天达到最大细胞密度,分别为17.4×105、16.2×105、15.9×105 和14.4×105 cells/mL,并没有显著差异。对比图 5-B,使用LSM 搅拌瓶培养体系考察细胞接种密度对细胞生长的影响,当微载体浓度为3 g/L,不同细胞接种密度分别出现在第5 天,第6 天、第7 天、第8 天达到最大细胞密度,为37.9×105、29.4×105、29.3×105 和27.1×105 cells/mL,与初始接种密度相比,分别增殖了2.88 倍、4.86倍、8.80 倍和26.10 倍。IVCC 分别为38.1×109、26.7×109、25.2×109 和20.5×109 cells.d/L。微载体利用率分别为57.4%、44.5%、44.4% 和41.0%。

|
| 图 5 不同细胞接种密度条件下ST 细胞贴壁生长曲线 |
从细胞培养过程中葡萄糖、乳酸和氨的浓度变化来看,使用LSM 葡萄糖消耗趋势并未有显著差别,四组细胞接种密度条件下,葡萄糖浓度在培养结束时分别为5.63、5.99、3.23 和1.88 mmol/L(图 6-A)。氨均未大量生成,培养结束时分别为2.99、4.02、3.67 和2.93 mmol/L(图 6-C)。而副产物乳酸在培养过程中持续累积,培养结束时分别为13.8、18.0、20.7 和20.9 mmol/L(图 6-B)。从图 6-D 可以看出,10×105 cells/mL 时,乳酸对葡萄糖的得率最低;而当细胞接种密度为3×105 cells/mL 时,乳酸对葡萄糖的得率最高。

|
| 图 6 LSM 不同ST 细胞接种密度条件下对细胞代谢的影响 |
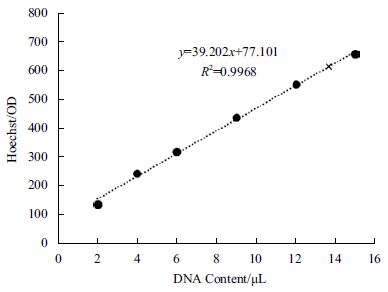
如图 7 所示,使用LSM 进行ST 细胞灌注体系培养,在第4 天(第一次换液)后,葡萄糖浓度在28.25-35.35 mmol/L 的范围内波动,培养结束时浓度为25.52 mmol/L,代谢副产物氨的浓度在2.56-3.72mmol/L 的范围内稳定波动,培养结束时浓度为3.02mmol/L。但代谢副产物乳酸的浓度呈现持续上升的现象,培养结束时乳酸浓度为25.00 mmol/L,对应的pH 值也呈现持续下降的现象,培养结束时pH值6.87。如图 8 所示,以2、4、6、9、12 和15 μL26.8×105 cells/mL 细胞悬液DNA 吸光值做标准曲线。灌注培养15 d ST 细胞终密度为36.6×105 cells/mL,扩增了13.6 倍,经过计算得到此时微载体利用率为24.4%。

|
| 图 7 LSM 灌注培养体系ST 细胞代谢 |
|
| 图 8 灌注系统DNA 含量Hoechst 检测 |
从上述研究中我们发现,在1-7 g/L 微载体用量范围内,使用DMEM 培养基在搅拌瓶培养体系中接种相同密度的ST 细胞,随着微载体浓度的上升,最大细胞密度不升反降。在初始24 h 内细胞密度变化基本一致,说明并不是细胞贴附阶段贴附率的差异导致高微载体浓度低细胞密度现象的发生,结合倒置显微镜下5 g/L 微载体浓度细胞贴附情况,可以得到即使在提供了充足的微载体贴壁面积条件下,ST细胞仍不能以较高效率利用提供的贴附面积。这很有可能是在平均每个微载体接种细胞数较少的情况下,DMEM 培养基不能较好地支持ST 细胞在微载体上良好的延伸和增殖导致的。此时,1 g/L 与5 g/L微载体浓度下能得到相对较高的细胞密度,相对1 g/L微载体75.5% 的利用率,5 g/L 微载体利用率仅为13.7%,过多微载体的使用并没有显著增加细胞密度反而大大增加了成本。何锡忠等[20]对PK-15 细胞搅拌瓶培养的研究同样发现,微载体浓度与PK-15细胞密度仅有一定程度的相关性,高浓度微载体的表面积并没有被充分利用。
使用LSM 培养基,搅拌瓶体系中最大细胞密度随着微载体浓度的上升而上升,且出现时间也随之推迟。1 g/L 微载体用量的实验组在达到最大细胞密度后存在为期5 d 的平台期,结合该条件下倒置显微镜可以看出是贴附面积有限导致的。此时,3 g/L是较为理想的浓度,既能提供充足的贴壁面积,又能保持44.4% 的微载体利用率,最大细胞密度可以达到29.3×105 cells/mL。在此基础上进一步考察优化细胞接种密度,提高细胞接种密度可以增加最大细胞密度,选择10×105 cells/mL 接种,最大细胞密度达到37.9×105 cells/mL,扩增了2.88 倍,微载体利用率达到57.4%,并且存在一个维持5 d 的平台期,代谢副产物积累对培养环境造成压力较小,这对于我们最终生产猪瘟病毒的目的是有利的。但需要注意的是,在DMEM 培养基中,高密度接种虽然减少了达到最大细胞密度的时间,但最大细胞密度并没有显著增加,并且也不能较好维持细胞密度,此时不能盲目增加接种密度。有很多研究得到细胞与微载体的最优接种比[16, 20],如PK-15 细胞以10-15 cells/MC 接种时生长状态最优。我们的结论进一步证明微载体的用量与接种密度仍需要根据细胞在不同培养基中增殖延伸能力的差异设置更为合理的范围。
最终,使用LSM 培养基在灌注培养体系中培养ST 细胞,细胞密度达到36.6×105 cells/mL,扩增了14.6 倍,FibraCel disk 微载体利用率为24.4%,与使用Cytodex 1 搅拌瓶培养体系有一定差距,为期3 d的换液间隔导致大量乳酸的累积可能是其原因。后续实验拟减少换液时间,提高细胞接种密度,保持培养过程中低浓度乳酸含量,以期在灌注培养体系得到高细胞密度并提高微载体利用率。
4 结论本研究使用DMEM 补加10%FBS 与LSM 两种培养基,通过考察微载体浓度与细胞接种密度对搅拌瓶培养体系中ST 细胞增殖维持能力的影响,提高了微载体利用率,优化了细胞生长。进一步在灌注培养体系中初步实现了ST 细胞片状微载体培养。
| [1] | Fernandez-Sainz IJ, Largo E, Gladue DP, et al. Effect of specific amino acid substitutions in the putative fusion peptide of structural glycoprotein E2 on classical swine fever virus replication[J]. Virology, 2014, 121(30):456-457. |
| [2] | 孙石静, 董彦鹏, 缪芬芳, 等. 我国当前猪瘟疫苗特点及科学免疫[J]. 畜禽业, 2014(3):4-6. |
| [3] | Kleiboeker SB. Swine fever :classical swine fever and African swine fever[J]. Vet Clin North Am Food Anim Pract, 2002, 18(3): 431-451. |
| [4] | Stegeman A, Elbers A, de Smit H, et al. The 1997-1998 epidemic of classical swine fever in the Netherlands[J]. Veterinary Microbiology, 2000, 73(2-3):183-196. |
| [5] | Grummer B, Fischer S, Depner K, et a1. Replication of classical swine fever virus strains and isolates in different porcine cell lines[J]. Dtsch Tierarztl Wochenschr, 2006, 113(4):138-142. |
| [6] | 平玲, 魏园园, 王家敏, 等. 猪瘟疫苗的研究进展及ST细胞苗的研究现状[J]. 当代畜禽养殖业, 2014(3):3-6. |
| [7] | Barrias CC, Ribeiro CC, Lamghari M, et al. Proliferation, activity, and osteogenic differentiation of bone marrow stromal cells cultured on calcium titanium phosphate microspheres[J]. Journal of Biomedical Materials Research Part a, 2004, 72(1):57-66. |
| [8] | Paillet C, Forno G, Kratje R, et al. Suspension-Vero cell cultures as a platform for viral vaccine production[J]. Vaccine, 2009, 27(46): 6464-6467. |
| [9] | Rourou S, van der Ark A, Majoul S, et al. A novel animal-componentfree medium for rabies virus production in vero cells grown on Cytodex 1 microcarriers in a stirred bioreactor[J]. Applied Microbiology and Biotechnology, 2009, 85(1):53-63. |
| [10] | Bock A, Schulze-Horse J, Schwarzer J, et al. High-density microcarrier cell cultures for influenza virus production[J]. Biotechnology Progress, 2011, 27(1):241-250. |
| [11] | Souza MC, Freire MS, Schulze EA, et al. Production of yellow fever virus in microcarrier-based Vero cell cultures[J]. Vaccine, 2009, 27(46):6420-6423. |
| [12] | 郭燕华, 郭勇, 罗立新. 微载体培养技术的研究进展[J]. 中国生物工程杂志, 2001, 21(5):56-58. |
| [13] | Bock A, Schulze-Horse J, Schwarzer J, et al. High-density microcarrier cell cultures for influenza virus production[J]. Biotechnology Progress, 2011, 27(1):241-250. |
| [14] | Hu WS, Meier J, Wang DIC. A mechanistic analysis of the inoculum requirement for the cultivation of mammalian cells on microcarriers[J]. Biotechnology & Bioengineering, 2006, 95(2): 306-316. |
| [15] | Forestell SP, Kalogerakis N, Behie LA, et al. Development of the optimal inoculation conditions for microcarrier cultures[J]. Biotechnology & Bioengineering, 1992, 39(3):305-313. |
| [16] | Bock A, Sann H, Schulze-Horsel J, et al. Growth behavior of number distributed adherent MDCK cells for optimization in microcarrier cultures[J]. Biotechnology Progress, 2009, 25(6): 1717-1731. |
| [17] | Gnzel Y, Olmer RM, Schafer B, et al. Wave microcarrier cultivation of MDCK cells for influenza virus production in serum containing and serum-free media[J]. Vaccine, 2006, 24(35-36):6074- 6087. |
| [18] | Concei??o MM, Tonso A, Freitas CB, et al. Viral antigen production in cell cultures on microcarriers[J]. Vaccine, 2007(45): 7785-7795. |
| [19] | Hu AY, Weng TC, Tseng YF, et al. Microcarrier-based MDCK cell culture system for the production of influenza H5N1 vaccines[J]. Vaccine, 2008, 26(45):5736-5740. |
| [20] | 何锡忠, 李春华, 倪建平, 等. 微载体培养PK-15细胞试验条件的优化[J]. 动物医学进展, 2010, 31(8):20-23. |