神经胶质细胞瘤(Gliomas),简称胶质瘤,是颅内最常见的恶性肿瘤,以高发病率、高复发率、低治愈率和高病死率等特点著称[1]。Westphal 等[2, 3]认为由于胶质瘤细胞组成复杂、弥散性分布以及具有高耐药性等,近30 年来对脑胶质瘤的治疗没有较大突破。目前限制胶质瘤或其它肿瘤的治疗效率的关键因素之一是常规方法缺乏肿瘤的特异性,所以,急需开发安全高效的靶向治疗脑胶质瘤新方法。
MSC 介导的基因治疗被认为是非常有潜力的治疗方法[4, 5, 6, 7]。MSCs 的肿瘤组织趋向性已经通过体外transwell 实验和在动物体内肿瘤模型实验证实。利用MSC 的肿瘤归巢性,让它携带特定抑癌基因可在肿瘤组织附近一直表达抗癌蛋白,从而达到靶向杀死肿瘤细胞目的。MSC 介导的基因治疗方法很多,其中以DNA 载体或病毒载体最为常见,但这些方法有都会存在引入基因重组或突变的问题。因此,不会引入基因突变又能安全应用于临床肿瘤治疗的MSC 介导的基因治疗方法将是肿瘤治疗的理想药物。体外合成稳定的mRNA 方法将有可能替代常用的DNA 载体方法(pDNA)[8],体外合成mRNA 的方法已广泛应用于多能干细胞或体细胞编程和诱导分化中[9, 10, 11, 12]。
PTEN 基因是1997 年首次发现、位于人体10号染色体(10q23.3)的一种抗癌基因[13, 14, 15]。几乎所有脑胶质瘤患者都伴有PTEN 活性低下,高达40%脑胶质瘤是由PTEN 基因突变所致[16]。PTEN 活性低下是众多肿瘤细胞的普遍现象,以增强PTEN 活性为手段的抗癌研究一直受到广泛的关注。
本研究拟采用体外合成的PTEN mRNA 来编辑MSC,然后利用间接共培养方法研究PTEN mRNA对脑胶质瘤U251 细胞的杀伤抑制作用,以此探讨体外合成的PTEN mRNA 是否能成为有效治疗脑胶质瘤病人候选药物之一。
1 材料与方法 1.1 细胞培养胰腺MSCs 的分离和培养如本实验室之前方法所述[17]。人脑胶质瘤U251 美国菌种典藏中心(ATCC,Manassas,VA,USA)。U251 和MSCs 细胞培养条件参照ATCC 培养条件[18]。为了实时动态观察U251 细胞生长情况,荧光素酶pGL4.51[luc2/CMV/Neo](Promega,USA)载体稳定转染到该细胞。
1.2 体外合成PTENmRNA和MSCs的转染体外构建转录模板和RNA 合成示意图如图 1 所示。寡核苷酸序列体外合成的反转录模板如表 1 所示。人5' UTR 的 Kozak 序列和3' UTR 序列由 DNA合成技术公司(Coralville,Iowa) 合成,克隆到pcDNA3.3 载体上,命名为pcDNA 3.3-TOPO TA 载体。如之前文章所述[9],用限制内切酶切割质粒,并作为tail PCRs 的模板。利用MEGAscript T7 试剂盒(Ambion)合成,将ARCA 帽子类似物(NewEngland Biolabs),三磷酸腺苷,GTP,5-甲基胞嘧啶和假尿嘧啶(TriLink Biotechnologies)等核糖核苷酸混合物37℃孵育5 h 后,用碱性磷酸酶37℃(NewEngland Biolabs)处理2 h 去除5'- 三磷酸。合成的RNA 用Ambion MEGAclear spin columns(Ambion)纯化并用Nanodrop(Thermo Scientific) 测定浓度。TransIT-mRNA(Mirus) 转染试剂进行RNA 的转染,Opti-MEM 基础培养基(Gibico)稀释RNA,然后依次加入Boost 溶液和TransIT-mRNA,混匀室温放置2 min,把RNA 和脂质体复合物加入到待转染的细胞培养基中。分别在转染12,24 和 36 h 利用Western blot 检测PTEN 蛋白表达情况。
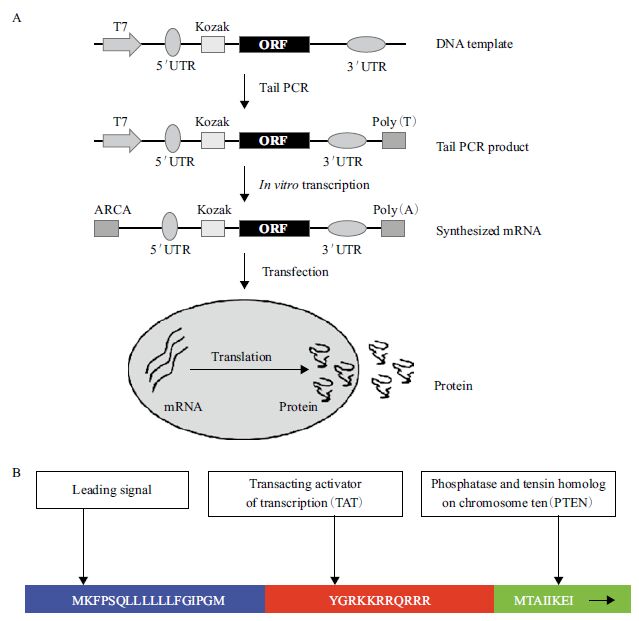
|
| 图 1 体外合成 PTEN mRNA(A)和 分泌性 PTEN(stPTEN)融合蛋白(B)流程图 |
利用间接共培养的方法分析PTEN 编辑的MSCs对胶质瘤细胞增殖毒性作用。在第0 天,将荧光素酶标记的U251(U251-Luc)细胞按5 000 个/ 孔密度加入100 μL MEM 培养基接种于96 孔,在第1 天将培养基换为从MSCs(CM)或转染PTEN RNA 的MSC(CMPTEN) 条件培养基,按0%,25%,50%,75%,100%(MSCPTEN/ CM from MSC control)5 个浓度梯度加入100 μL 培养基。在第0,3 和6 天,每孔加入 1 μL(0.15 mg/mL)D-荧光素(Caliper LifeSciences,Hopkinton,MA),培养10 min 后,利用小鼠活体成像仪(Caliper Life Sciences,Hopkinton,MA)检测荧光素酶发光强度。每间隔36 h 更换一次培养基,每组至少重复检测3 次以上。
1.4 Transwell 共培养系统检测MSCs的迁移能力细胞迁移能力检测参考Nakamizo 等[19]方法。将U251-Luc 细胞按1×105 个/ 孔密度接种到24 孔板,第2 天待细胞贴壁后,野生型MSCs 和 MSCPTEN按×104 个/ 孔密度接种到transwell(Corning,Inc.,Corning,NY)的微孔膜(8 μm)上,用无血清培养基37℃ 和 5% CO2 培养48 h,用PBS 清洗微孔膜,然后用棉签将膜上层细胞刮下。利用95% 乙醇固定transwell 的微孔膜,然后用0.1% 结晶紫染色30-60min。在显微镜视(100×)野下,每组随机选取5个不同视野计数细胞迁移数目。每组实验至少重复3 次以上。为了检测正常细胞对MSCs 细胞 迁移能力影响,用野生型的MSCs 细胞替代U251-Luc 细胞。
1.5 Western blotting分析用细胞刮刮下6 孔板中MSCs 细胞,PBS 洗2-3次后,加入100-200 μL 细胞裂解buffer(Beyotime)冰上裂解 30 min,用BCA 试剂盒(Beyotime)测定蛋白浓度。 按每个点样孔(50 μg/ 每孔),用12%SDS-PAGE 胶分离后转膜。室温封闭1 h 后,4℃一抗(PTEN,(R&D Systems,Minneapolis,USA))抚育过夜。TBST 洗3 遍,每次5 min,ECL 标记的二抗(1∶1 000)室温孵育1 h,显色,照相。检测分泌到培养基中的PTEN 表达情况时,收集条件培养基,用0.22 滤膜过滤后用冷冻干燥仪(cat # 42406 ;Millipore,Millerica,MA,USA)浓缩。
1.6 荧光显微镜分析利用LIVE/DEAD Viability/Cytotoxicity Assay Kit(Invitrogen)检测细胞活力,按说明书并适当修改操作。 具体步骤如下:按1×105 细胞密度将U251 接种到24 孔板并加入500 μL 的 MEM 培养基作为第0天。 在第1 天培养基换为50 或者100% 条件培养基(正常培养基加入一定比例转染PTEN mRNA MSC 培养24 h 上清)。在培养第4 天,细胞用PBS 洗2 遍后,加入新鲜配制的工作液(250 μL/孔,24 板,含1 μmol/L calcein AM 和2 μmol/L EthD-1)避光室温孵育10 min。荧光显微镜(IX71;Olympus)下观察照相,并利用软件(provided online by the National Instituteof Health of USA)分析相关比例。
1.7 统计学分析应用SPSS.10 统计学软件,组间差异采用两样本均数t 检验,率的比较采用χ2 检验,以P<0.05 表示差异有显著统计学意义。
2 结果 2.1 体外合成PTEN mRNA和在MSCs细胞中表达分析PTEN mRNA 合成流程如图 1-A 所示,为了使翻译的PTEN 蛋白产物具有跨膜分泌特性(stPTEN),在编码PTEN 蛋白的DNA 序列前加分泌肽DNA 序列(MKFPSQLLLLLLFGIPGM)和跨膜肽DNA 序列(TAT,YGRKKRRQRRR)( 图 1-B)。 以之前构建的pDsRed1-TAT-PTEN 载体[18]为模板克隆stPTEN DNA 序列(图 2A-a),然后把克隆得到的PCR 产物双酶切后连接到pcDNA 3.3-TOPO TA 载体。将菌落PCR 和酶切筛选得到的阳性克隆(图 2A-b,c),送上海生工测序,经比对完全正确的序列用限制性酶切后的产物作为tail PCR 的模板(图 2A-d)。如图 2-B 所示,向MSCs 转染PTEN mRNA 后PTEN 蛋白的表达显著增强。对照组中内源性的PTEN 蛋白与转染组PTEN 蛋白略微小些,转染24 h 后PTEN 蛋白表达最高,36 h 后逐渐降低。在培养上清也检测到PTEN 蛋白表达,说明合成的PTEN mRNA 表达的蛋白具有分泌特性。

|
| 图 2 体外合成PTEN mRNA 和转染到MSCs 表达检测 |
利用transwell 系统分析 MSC 迁移能力。将U251-LUC 和MSCs 或 MSCPTEN 细胞间接共培养 48后,大量的MSCs 或 MSCPTEN 对U251-LUC 细胞有趋向作用迁移穿过滤膜(图 3-A),然而几乎很少细胞对正常MSC 细胞有趋向作用迁移穿过滤膜(图 3-B)。而且,与对照MSC 细胞相比转染PTENmRNAs的MSC 细胞对 U251 细胞的趋向能力更强(图 3-C)。

|
| 图 3 体外检测MSCs 的迁移能力 |
利用活体成像仪器检测U251 细胞中LUC 发光强弱分析PTEN 编辑的MSCs 间接共培养对U251-LUC 细胞活力影响。如图 4-A 所示,随着条件培养基(CM)比例的提高U251 细胞的发光强度逐渐降低。每个浓度梯度统计分析结果如图 4-B 所示,在CM(25%)作用下,共培养6 天U251 细胞死亡率达47.7%,(P<0.05)。然而在共培养的第 3 天,在CM(100%)作用下已经开始有细胞死亡(P<0.05),而其他浓度的CM 作用下基本不会引起细胞死亡。

|
| 图 4 利用活体成像检测仪分析U251-Luc 细胞活力 |
为了进一步检测PTEN 编辑的MSCs 对U251-LUC 细胞致死作用,用50% 和100%CM 培养 U251-LUC 细胞4 d 后用LIVE/DAED Viability/CytotoxicityAssay Kit 分析,在荧光显微镜观察被染为红色(死细胞)和绿色(活细胞)细胞数量。如图 5 所示,U251-LUC 细胞死亡数量与CMPTEN 培养基比例成正比,剂量依赖的致死率表明转染PTEN mRNA 的MSCs 分泌到培养上清PTEN 蛋白可通过间接培养直接导致 U251-LUC 细胞死亡。而在正常MSC 细胞的条件培养基作用下没有发现明显的细胞死亡。
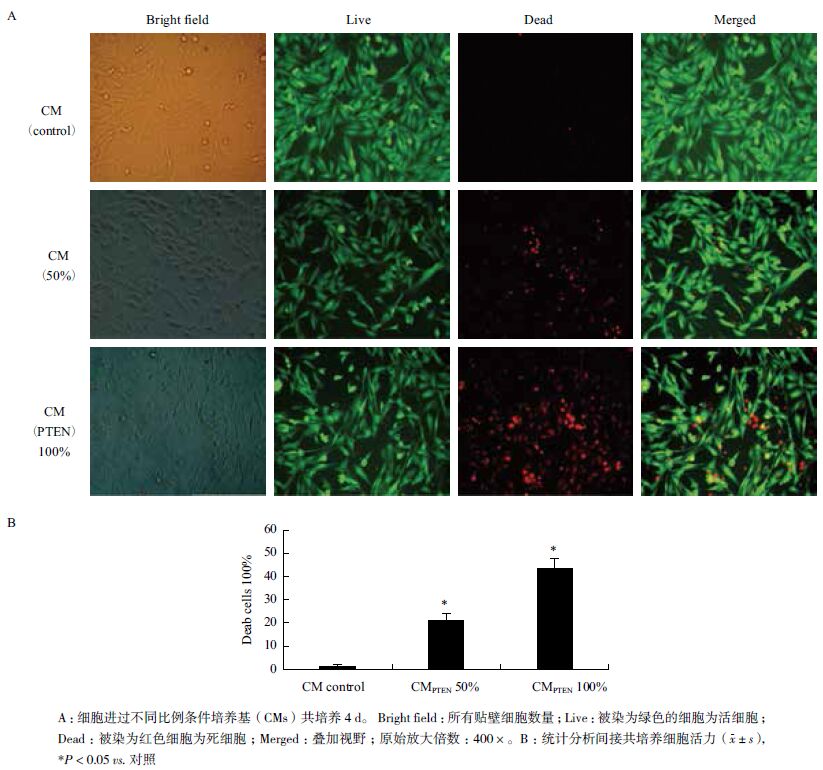
|
| 图 5 间接共培养分析U251-Luc cell 细胞活力 |
恶性胶质瘤是一种很难治愈的肿瘤,主要是由于它的生长位置和生物学特性决定,例如(i)渗透特性,(ii)凋亡耐受性,(iii)高复发性,(iv)高耐药性[3]。自从MSCs 的肿瘤趋向性被发现以来,利用特定抗癌基因编辑的MSCs 已逐渐成为最有潜力的靶向治疗胶质瘤方法[20, 21, 22]。然而,用病毒或质粒载体携带抗癌基因的MSCs 不能应用于临床治疗。
最新的体外合成mRNA 方法是一种安全高效的基因治疗方法[11],它可完全排除对宿主基因的修饰[23, 24],并已被证实可应用于临床研究[25]。 因此,利用体外合成特定抗癌基因mRNA 编辑MSCs 的方法具有临床应用价值。
PTEN 基因表达的缺失或低表达广泛存在于肿瘤细胞包括胶质瘤细胞,说明该基因的表达是影响肿瘤细胞的存活关键因素[26]。PTEN 功能的恢复将有可能抑制肿瘤生长和在特定情况下诱导其死亡。同时有研究发现细胞中表达的PTEN 蛋白可分泌到胞外再进入其他细胞影响细胞信号转导和存活[27]。鉴于此,我们体外合成能表达分泌PTEN 蛋白的mRNA,并用它编辑MSC 应用于治疗癌症研究,探讨它潜在的临床应用价值。如图 2-B 所示,转染合成的PTEN mRNA 24 h 后在MSCs 表达达到高峰。并且表达出PTEN 蛋白的分泌特性与我们之前在这个细胞模型用DNA 载体转染表达效果一致[19]。
我们前期研究发现利用DNA 载体携带的抗癌基因编辑的MSCs 可抑制胰腺癌细胞和脑胶质瘤细胞生长[19, 28]。为了保证临床应用的可行性,必须确定转染mRNA 后是否会影响MSCs 对肿瘤细胞的迁移性。如图 3 所示,转染 PTEN-mRNA 并不会抑制MSCs 的迁移性,而MSCs 对U251 细胞的迁移性反而还有一定程度增强,我们推测高表达的PTEN蛋白可能可以影响MSCs 细胞中控制肿瘤迁移特性蛋白表达或活性,关于这个潜在的机制还需要进一步深入研究。通过间接共培养方法,我们发现转染PTEN-mRNA 的培养上清能显著抑制U251-LUC 细胞生长并促进其凋亡,并且这种作用还有剂量依赖(图 4,图 5)。然而体外合成的PTEN-mRNA 表达的蛋白分泌到培养基后,是否是通过进入U251-LUC细胞或是其他方式来抑制其生长和促进其凋亡作用,在后续研究中将深入讨论。
4 结论本研究首次利用体外合成的PTEN mRNA 修饰MSC 作用于胶质瘤细胞,开发了一种安全可靠和高效基因治疗肿瘤新方法。利用MSC 介导的基因靶向治疗肿瘤具有两种优势,一方面是由于MSCs 本身具有肿瘤趋向性,另一方面是可携带特定抗癌药物。同时这种方法还具有潜在优势。
| [1] | Van Meir EG, Hadjipanayis CG, Norden AD, et al. Exciting new advances in neuro-Oncology the avenue to a cure for malignant glioma[J]. CA Cancer J Clin, 2010, 60(3):166-193. |
| [2] | Westphal M, Lamszus K. The neurobiology of gliomas :from cell biology to the development of therapeutic approaches[J]. Nat Rev Neurosci, 2011, 12(9):495-508. |
| [3] | Ferguson SD. Malignant gliomas :diagnosis and treatment[J]. Neuro Surgery, 2011, 57(11):558-569. |
| [4] | Loebinger MR, Janes SM. Stem cells as vectors for antitumour therapy[J]. Thorax, 2010, 65(4):362-369. |
| [5] | Dai LJ. Potential implications of mesenchymal stem cells in cancer therapy[J]. Cancer Lett, 2011, 305(5):8-20. |
| [6] | Buono R, Abrate A, Esposito A, et al. Mesenchymal stem cell mediated cancer therapy inhibits tumor growth in the transgenic adenocarcinoma of the mouse prostate(Tramp)model[J]. J Urology, 2013, 189(5):203-207. |
| [7] | Zhang X, Zhang L, Xu W, et al. Experimental therapy for lung cancer :umbilical cord-Derived mesenchymal stem cell-mediated interleukin-24 delivery[J]. Curr Cancer Drug Tar, 2013, 13(1):92-102. |
| [8] | Leonhardt C, Schwake G, St?gbauer TR, et al. Single-cell mRNA transfection studies :Delivery, kinetics and statistics by numbers[J]. Nanomed-Nanotechnol, 2014, 10(4):679-688. |
| [9] | Wang XL, Hu p, Guo XR, et al. Reprogramming human umbilical cord mesenchymal stromal cells to islet-like cells with the use of in vitro-synthesized pancreatic-duodenal homebox 1 messenger RNA[J]. Cytotherapy, 2014, 16(11):1519-1527. |
| [10] | Guo XR, Wang XL, Li MC, et al. PDX-1 mRNA-induced reprogramming of mouse pancreas-derived mesenchymal stem cells into insulin-producing cells in vitro[J]. Clin Exp Med, 2014, 10 (1):152-160. |
| [11] | Warren L, Manos PD, Ahfeldt T, et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA[J]. Cell Stem Cell, 2010, 7(5): 618-630. |
| [12] | Zangi L, Lui KO, von Gise A, et al. Modified mRNA directs the fate of heart progenitor cells and induces vascular regeneration after myocardial infarction[J]. Nat Biotechnol, 2013, 31(10):898- 907. |
| [13] | Liu W, Zhou Y, et al. PTEN mutation :many birds with one stone in tumorigenesis[J]. Anticancer Res, 2008, 28(6A):3613- 3619. |
| [14] | Ciuffreda L, Falcone I, Incani UC, et al. PTEN expression and function in adult cancer stem cells and prospects for therapeutic targeting[J]. Adv Biol Relat, 2014, 56 :66-80. |
| [15] | Muniyan S, Ingersoll MA, Batra SK, et al. Cellular prostatic acid phosphatase, a PTEN-functional homologue in prostate epithelia, functions as a prostate-specific tumor suppressor[J]. BBA, 2014, 1846(1):88-98. |
| [16] | Chalhoub N, Baker SJ. PTEN and the PI3-kinase pathway in cancer[J]. Annu Rev Pathol, 2009, 4(11):127-150. |
| [17] | Moniri MR, Sun XY, Rayat J, et al. TRAIL-engineered pancreasderived mesenchymal stem cells :characterization and cytotoxic effects on pancreatic cancer cells[J]. Cancer Gene Ther, 2012, 19(9):652-658. |
| [18] | Yang ZS, Tang XJ, Guo XR, et al. Cancer cell-oriented migration of mesenchymal stem cells engineered with an anticancer gene (PTEN):an imaging demonstration[J]. Oncotargets Ther, 2014, 7 :441-446. |
| [19] | Nakamizo A, Marini F, Amano T, et al. Human bone marrowderived mesenchymal stem cells in the treatment of gliomas[J]. Cancer Res, 2005, 65(12):3307-3318. |
| [20] | Menon LG, Kelly K, Yang HW, et al. Human bone marrow-derived mesenchymal stromal cells expressing S-TRAIL as a cellular delivery vehicle for human glioma therapy[J]. Stem Cells, 2009, 27(28):2320-2330. |
| [21] | Dwyer RM, Khan S, Barry FP, et al. Advances in mesenchymal stem cell-mediated gene therapy for cancer[J]. Stem Cell Res Ther, 2010, 22(6):2012-2018. |
| [22] | Knoop K, Kolokythas M, Klutz K, et al. Image-guided, tumor stroma-targeted I-131 therapy of hepatocellular cancer after systemic mesenchymal stem cell-mediated NIS gene delivery[J]. Mol Ther, 2011, 19 :1704-1713. |
| [23] | Li M, Sancho-Martinez I, Belmonte J C, et al. Cell fate conversion by mRNA[J]. Stem Cell Res Ther, 2011, 15(11):2-5. |
| [24] | Kormann MS, Hasenpusch G, Aneja MK, et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice[J]. Nat Biotechnol, 2011, 29(2):154-157. |
| [25] | Neyns B, Heirman C, Thielemans K, et al. Immunotherapy of cancer with dendritic cells loaded with tumor antigens and activated through mRNA electroporation[J]. Methods Mol Biol, 2010, 629 (3):405-452. |
| [26] | Leslie NR, Downes CP. PTEN function :how normal cells control it and tumour cells lose it[J]. Biochem J, 2004, 382(Pt 1):1-11. |
| [27] | Benjamin DH, Fine B, Steinbach N, et al. A secreted PTEN phosphatase that enters cells to alter signaling and survival[J]. Science, 2013, 341(6411):399-402. |
| [28] | Roshan MM, Young A, Reinheimer K, et al. Dynamic assessment of cell viability, proliferation and migration using real time cell analyzer system(RTCA)[J]. Cytotechnology, 2014, 67(2): 379-386. |





