多肽通常认为是所含氨基酸数量在50-100 的小分子蛋白,因为易于合成与优化组合,使其在药物研发中表现出特定的优势和临床价值[1]。结核杆菌的持留性和耐药性使抗结核病成为近年来中国所面临的重要问题之一[2],结核杆菌基因组测序完成后,针对结核杆菌的多肽抑制剂研究成为新的药物研发方向[3, 4]。
异柠檬酸裂解酶(ICL)是结核杆菌在人体内处于持续感染状态时乙醛酸支路代谢中的关键酶,是其潜伏状态下利用碳源所必需的[5]。本课题组前期工作即以结核杆菌ICL 作为靶点筛选可以抑制细菌生长的多肽,且利用噬菌体肽库筛选技术和分子对接技术,优化筛选出4 种异柠檬酸裂解酶肽类抑制剂[6]。本研究进一步检测这4 种多肽的细胞毒性和胞内抑菌作用,以期获得潜在的抗结核新型药物。
1 材料与方法 1.1 材料 1.1.1 细胞及菌种结核分枝杆菌人型无毒株H37Rv (利福平、异烟肼敏感菌种)由中国药品生物制品检定所馈赠。人白血病单核巨噬细胞THP-1 由吉林大学疫苗研究实验室馈赠。菌株和细胞均由本实验室培养传代保存。
1.1.2 肽类化合物及试剂4 种肽类化合物由本实验组合成(表 1)。
二甲基亚砜(DMSO);DMEM 培养基、RPMI- 1640 培养基(美国Gibco 公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Sigma 公司);胎牛血清(FBS 美国Gibco 公司);PI 染料(Sigma 公司);其余试剂均为国产分析纯,购自北京化学试剂厂。
1.2 方法1.2.1 多肽MIC 检测
将筛选出的4条多肽用DMSO 稀释,使其终浓度为100、200、500、800、 1 000 和1 500 μg/mL,分别加到含正常培养基的H37Rv 菌株培养液的24 孔板中,37℃培养2-3 周观察结果。同时以利福平(RMP,浓度为0.5 μg/mL) 和异烟肼(INH,浓度为0.2 μg/mL)作为阳性对照。 以正常H37Rv 培养液作为阴性对照。观察长菌情况, 并记录各种多肽的MIC。
1.2.2 流式细胞术测定2 号肽对THP-1 细胞的毒性收集THP-1 细胞,2 000 r/min 离心5 min,弃上清液后,加入新鲜RPMI1640 培养液,按4.0×105 个细胞每孔接种24 孔细胞培养板中,37℃,5% CO2 条件下培养24 h,加入2 号肽,药物浓度分别为0、 200、400、800、1 000 和1 200 μg/mL,各种用药浓度分别作用1、3、5 和7 d,并分别设置加 PBS、 1% DMSO、含400 μg/mL 的INH 为阳性对照。取出与药物作用后的细胞,2 000 r/min 离心5 min,弃上清,再用预先冰浴的PBS 缓冲溶液洗两次,每次1.0 mL。75% 冰乙醇固定过夜,离心收集细胞,用300 目筛过滤一次,加碘化丙锭PI 反应15 min。使用流式细胞仪检测细胞凋亡。
1.2.3 MTT 法测定2 号肽对细胞THP-1 的毒性
将稳定感染的细胞接种于96 孔板,每孔4×104 个细胞。向孔内加入RPMI1640 培养液(含10% 胎牛血清) 100 μL,其中分别含有2 号肽浓度为0、500、800、 1 000、1 200、1 500、1 800 和2 000 μg/mL 设为实验组,同时用不含药物的RPMI1640 培养液为空白对照,含400 μg/mL 的INH 为阳性对照。分别于0、 4 及7 d 向96 孔细胞培养板上每孔加入10 μL 浓度为 5 mg/mL 的 MTT,继续培养4 h,培养结束,取出细胞培养板,离心弃上清,每孔加100 μL DMSO, 混匀后室温放置20 min,于570 nm 检测吸光值。按下述公式计算巨噬细胞存活率。
细胞存活率(%)=(感染细菌孔A 均值- 培养液对照孔A 均值)/(未感染细菌孔A 均值- 培养液对照孔A 均值)×100%
1.2.4 多肽对巨噬细胞胞内H37Rv 株抑制作用检测细菌与巨噬细胞的比例为10∶1(H37Rv 浓度1×107/mL,THP-1 细胞密度1×106/mL)混合,在终浓度为100 mmol/L 的丙二醇甲醚醋酸酯(PMA) 中诱导细胞分化。96 孔板每孔加100 μL 菌悬液,感染4 h 后,每孔加含不同浓度目的肽100 μL 继续培养, 目的肽给药浓度为0、500、800、1 000、1 200、 1 500、1 800 和2 000 μg/mL。同时用RPMI-1640 完全培养液作空白对照,4 mg/mL 的INH 作阳性对照。 以此时作为细菌感染零时,分别于感染后0、4 及7 d 去除板上培养液,每孔加入50 μL 1% Triton X-100 裂解细胞。待其全部裂解后,每孔加50 μL RPMI- 1640 细胞培养液终止裂解。混匀后每孔分别作1∶10和1∶100 稀释,接种于正常培养基37℃培养18 d 后计CFU。
1.2.5 统计学处理 各组数据结果采用“  ±s”表示,
采用t 检验进行各组间均数比较,P < 0.05 为差异显著,P < 0.01 为差异极显著。
±s”表示,
采用t 检验进行各组间均数比较,P < 0.05 为差异显著,P < 0.01 为差异极显著。
2.1 多肽最小抑菌浓度(MIC)检测
根据前期实验结果,合成4 条多肽,检测其对H37Ra 菌株的MIC,同时设INH 和RIFD 对照组,实验结果如表 2 所示。1,3 和4 号合成多肽的MIC 均为500 μg/mL,而2 号多肽的MIC 为200 μg/mL。而对照组中,INH 组MIC 为0.2 μg/mL,RIF 组MIC 为0.5 μg/mL。
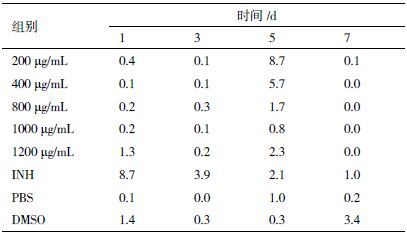
根据以上研究结果,进一步检测2 号多肽对THP-1 细胞凋亡的影响。以终浓度分别为200、400、 800、1 000 和1 200 μg/mL 五个梯度给药,流式细胞术检测细胞凋亡。同时设PBS 空白对照组,DMSO (1%)和INH 对照组。结果(表 3,图 1)表明,2 号肽给药组和INH 对细胞的毒性没有明显差别,但这两组细胞毒性均明显大于PBS、DMSO(1%)对照组,且各组细胞毒性呈现一定的时相性,总体趋势随时间和浓度增加而增大。
|
| 图 1 各种试剂对THP-1 细胞毒性测定结果 |
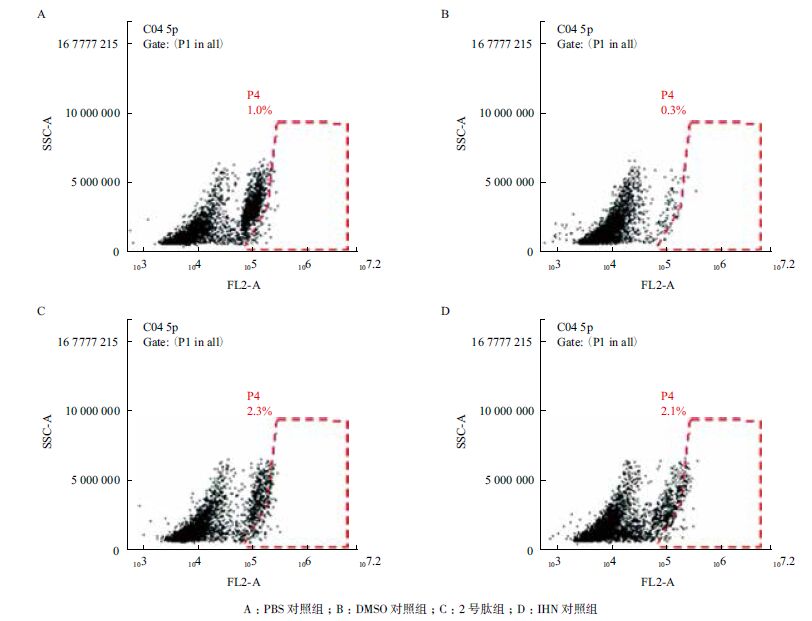
细胞给予500-2 000 μg/mL 不同剂量多肽,给药后第4 天和第7 天采用MTT 法检测细胞存活率。同时设空白对照组和INH(终浓度为400 μg/mL)对照组。检测结果(图 2)显示,给药后,2 号多肽给药组随着给药剂量的增加,细胞存活率呈剂量依赖性降低,而且第7 天细胞存活率明显低于第4 天细胞存活率。其中INH 组细胞存活率低于2 号肽给药组。
|
| 图 2 不同时间、药物浓度对细胞存活率统计 |
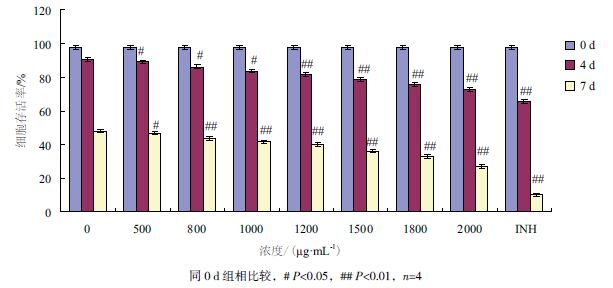
进一步检测多肽对细胞内H37Rv 菌的抑制作用。THP-1 细胞经100 nmol/L PMA 刺激48 h 后细胞由分散、悬浮转变为黏附、贴壁,显微镜下观察细胞的形态学变化(图 3),细胞体积变大并生成伪足, 表明细胞已经有效贴壁。
|
| 图 3 PMA 诱导不同时间细胞分化结果 |
以结核杆菌H37Rv 感染THP-1 细胞,吞噬对照菌落计数表明细菌已经被细胞有效吞噬。当2 号肽终浓度为2 000 μg/mL 时,与INH 对照相比,胞内细菌下降两个数量级,细菌的生长被明显抑制(图 4),这说明在较低的浓度下,2 号肽表现出对胞内细菌的抑制作用。通过t 检验分析,P <0.05,即各实验组对胞内菌均具有抑制作用,具有显著性差异。

|
| 图 4 不同时间、浓度H37Rv 菌落计数统计 |
目前多肽化学合成技术成熟,合成多肽容易与杂质或副产品分离,纯度高,部分多肽比小分子药物用量少,选择性更强,特异性更好,作用效果好同时副作用少,更加适合临床应用和市场开拓[7]。 但是多肽也存在很多问题,例如,由于多肽分子大小, 极性,亲水性和带电性等问题,使其缺乏细胞膜渗透力,影响细胞吸收[8, 9]。
本课题组利用噬菌体肽库筛选技术与计算机模拟分子对接技术优化异柠檬酸裂解酶肽类抑制剂的筛选[10]。首先通过噬菌体肽库筛选出与ICL 具有高亲和力的结合肽,然后利用Discovery Studio 2.1 模拟分子对接,将成功对接的多肽采用Fmoc 固相合成法,并对其生物活性进行检测。结果显示所合成多肽均对ICL 的活性有明显的抑制作用(抑制率均超过50%)[11]。本研究中进一步检测所合成多肽的细胞毒性和胞内抑菌效果。
首先检测多肽的最小抑菌浓度MIC。实验结果证实,其中3 条多肽的MIC 较高(500 μg/mL),而2 号多肽的MIC 为200 μg/mL。本课题组设计并合成的4 种肽类化合物作了多次实验,最终能达到的最好的纯化度(表 1),而且纯度没有明显差别(其中2 号和3 号纯度几乎一致,分别为98.8%,98.5%)。 但是最小的抑菌浓度相差较多,2 号肽的MIC 是200 μg/mL,而3 号MIC 为500 μg/mL。因此,下步实验选择2 号多肽作为研究目标。
选用人白血病单核巨噬细胞THP-1,检测合成多肽细胞毒作用。流式细胞术检测结果显示,2 号多肽对细胞凋亡的作用与INH 对照组没有显著的差异。而MTT 实验结果显示,2 号多肽组细胞存活率高于INH 对照组。两组实验结果均证实,2 号多肽的细胞毒性不高于INH,且细胞毒性有剂量和时间相关效应,细胞毒性随时间延长而增强,随给药剂量增大而增强。
进一步检测合成多肽的胞内抑菌作用。THP-1 细胞经100 nmol/L PMA 刺激48 h 后,显微镜下可观察到细胞明显的形态学变化。细胞由分散、悬浮转变为黏附、贴壁,细胞体积变大并生成伪足,表明细胞已经有效贴壁。以结核杆菌H37Rv 感染THP-1 细胞,计数吞噬对照菌落。实验结果表明,感染后细菌可在细胞内繁殖,并随着感染时间的延长数量增加。而给予药物后,当2 号肽终浓度为800-2 000 μg/mL 时,细菌的生长受到明显的抑制,且明显低于INH 对照组(P <0.01)。这说明2 号肽在较低的浓度下,就表现出对胞内细菌的抑制作用。INH 对静止期的结核分枝杆菌具有抑制作用,但是没有杀菌作用,而且长期使用可引起耐药性。本研究中2 号多肽对结核分枝杆菌的杀菌作用好于INH,是否是因为两种药物对静止期细菌的不同影响,其作用机制有待进一步探讨。
4 结论多肽类抑制剂具有很好的成药物理参数,并且能在低浓度下有效抑制细菌生长,具有成药潜力, 是理想的抗结核药物。
| [1] | 孙立春, CIY David H. 多肽药物研究进展[J]. 上海医药, 2014, 35(5):55-60. |
| [2] | Zhao Y, Xu S, Wang L, et al. National survey of drug-resistant tuberculosis in China[J]. N Engl J Med, 2012, 366(23):2161- 2170. |
| [3] | 娄智勇. 抗结核杆菌新药发现靶点蛋白的研究进展[J]. 生物物理学报, 2011, 27(10):828-838. |
| [4] | May EE, Leitao A, Tropsha A, et al. A systems chemical biology study of malate synthase and isocitratelyase inhibition in Mycobacterium tuberculosis during active and NRP growth[J]. Computational Biology and Chemistry, 2013(, 47):167- 180. |
| [5] | Sharma V, Sharma S, Hoener zu Bentrup K, et al. Structure of isocitrate lyase, a persistence factor of Mycobacterium tuberculosis[J]. Nat Struct Biol, 2000, 7(8):663-668. |
| [6] | 吴丛梅, 李玲玲, 殷玉和, 等. 肽类化合物对H37Ra 抑制的优化筛选[J]. 生物技术通报, 2014(8):196-201. |
| [7] | Craik DJ, Fairlie DP, Liras S, et al. The future of peptide-based drugs[J]. Chem Biol Drug Des, 2013, 81(1):136-147. |
| [8] | Reubi JC. Peptide receptors as molecular targets for cancer diagnosis and therapy[J]. Endocr Rev, 2003, 24(4):389-427. |
| [9] | Craik DJ, Fairlie DP, Liras S, et al. The future of peptidebased drugs[J]. Chem Biol Drug Des, 2013, 81(1):136-147. |
| [10] | Liu XT, Sun B, Yin YH, et al. Optimization of phage heptapeptide library screening process for developing inhibitors of the isocitrate lyase homologue from Mycobacterium tuberculosis[J]. Med Chen Res, 2014(23):2543-2553. |
| [11] | 吴丛梅, 赵韫慧, 殷玉和, 等. 异柠檬酸裂解酶肽类抑制剂的优化筛选[J]. 吉林大学学报:理学报, 2012, 50(3):581- 586. |