2. 成都医学院公共卫生系,成都 610500
3. 成都军区总医院肾内科,成都 610500
2. School of Public Health,Chengdu Medical College,Chengdu 610500
3. Department of Kidney Disease,General Hospital of Chengdu Military Region,Chengdu 610500
魏斯氏菌(Weissella)属于乳酸菌(Lactic acidbacteria),近年来,魏斯氏菌在微生物学、医药学及发酵、工业、食品加工等方面的应用开始受到研究者的关注。魏斯氏菌作为益生菌的一员,对胃肠道健康有一定的促进作用[1]。魏斯氏菌具有β-葡糖苷酶活性[2],较好的抗真菌性[3],能促进乳杆菌(Lactobacillus)的生长[4]。魏斯氏菌产生的乳酸和各种胞外多糖,对食品的风味感官有一定的影响[5]。同时,相关魏斯氏菌新种的发现,证实其在食品的防腐方面也有着较大的应用潜能[6]。魏斯氏菌益生性质的广泛应用有待于其分子与基因水平更深层次的研究。
寻找新的质粒,构建转化率高的表达载体是促进魏斯氏菌基因工程发展的方法之一,也是魏斯氏菌走向实践应用的有效途径。2007 年Park 等[7]首次从韩国泡菜分离的食窦魏斯氏菌(W. cibaria)中鉴定出3 个质粒,pKLCA、pKLCB 和pKLCC。国内学者在对发酵辣白菜的研究中,从食窦魏斯氏菌中分离出2 个质粒,其大小分别为3 000 bp 和8 000bp[8]。Kim 等[9]从韩国泡菜分离得到的食窦魏斯氏菌(W. cibaria KLC140)中发现6 种不同的质粒,其中最小的质粒长度为2 126 bp,命名为pKW2124,该质粒的复制方式为θ 复制。将pKW2124 与slpA和 gfp 的融合基因连接,导入载体pUC19,形成一个8.6 kb 的表面展示载体pKWCSLGFP。随后,相关学者把pKW2124 的复制起始点(ori)、核糖体结合位点(RBS)、复制蛋白(rep)基因插入克隆载体pUC19,形成载体pKUCm1。实验发现,pKUCm1 宿主范围广泛,包括魏斯氏菌属(Weissella),乳球菌属(Lactococcus),明串珠菌属(Leuconostoc),乳杆菌属(Lactobacillus),同时,含有启动子的β-半乳糖苷酶基因被成功插入载体pKUCm1,形成可应用于蓝白斑筛选的质粒pKUGal[7]。目前,已发现的魏斯氏菌质粒还非常有限,而以上已被发现质粒中除pKW2124 的复制方式被证实为θ 复制外,其余质粒复制方式都不明确。新质粒的发现对魏斯氏菌分子生物学及遗传学的研究具有重要意义。
本研究从融合魏斯氏菌QJ012 菌株中分离出一个隐蔽性质粒,并对该质粒进行测序和分析,旨在构建为良好的表达载体。
1 材料与方法 1.1 材料质粒pUC57 为广州艾基有限生物公司提供,T载体试剂盒、革兰阳性菌基因组提取试剂盒和PCR(Ex Taq)购自大连宝生物公司(TaKaRa)。质粒提取试剂盒购自北京索来宝科技有限公司,胶回收试剂盒购自Omega 公司(Bio-Tek USA),限制性内切酶购自Thermo 公司。培养条件:MRS 培养基[10]37℃静置培养18-48 h。
1.2 方法 1.2.1 魏斯氏菌的分离鉴定菌株QJ012 样本来自湖南泡菜。将泡菜样品在MRS 培养基上划线培养,挑取生长的单菌落进行革兰染色观察。魏斯氏菌应该为紫红色的短杆状细菌。培养筛选出的革兰阳性菌,用革兰阳性菌基因组提取试剂盒提取基因组。根据细菌16S rDNA 基因的高度保守,利用细菌16SrDNA 通用引物对( 正义:5'-AGAGTTTGATCCTGGCTCAG-3' ;反义:5'-AAGGAGGTGATCCAGCCGCA-3'),扩增QJ012 菌株的16S rDNA 基因。PCR 扩增片段通过胶回收纯化,然后进行A-T 克隆,最后送到成都擎科梓熙生物技术有限公司测序。
1.2.2 生化鉴定过氧化氢酶试验采用传统方法进行。葡萄糖、L-阿拉伯糖、纤维二糖、半乳糖、麦芽糖的发酵产酸试验使用细菌微量生化管进行,培养方式为37℃静置培养[11]。
1.2.3 质粒提取与测序离心收集融合魏斯氏菌QJ012 菌体,用质粒提取试剂盒提取质粒pQJ012,胶回收试剂盒分离纯化质粒条带。将分离纯化得到的质粒委托广州艾基生物有限公司进行测序,方法为物理破碎后导入载体pUC57,然后测序。
1.2.4 酶切鉴定测序后通过分析pQJ012 具有的酶切位点,使用Hind Ⅲ和Nhe Ⅰ 对质粒提取液进行双酶切,通过分析酶切前后条带大小,鉴定其能否被相应限制性内切酶切开。
1.2.5 质粒相似性鉴定及序列注释利用序列比对工具BLAST,在GenBank 数据库中比对融合魏斯氏菌质粒pQJ012 的测序结果,检索该质粒与已知魏斯氏菌质粒的同源性。利用NCBI 网站上的ORF Finder(Open reading frame finder)寻找该质粒可能存在的开放阅读框(ORF)。利用DNAMAN(V6)软件标注该质粒的重要酶切位点。
1.2.6 复制方式推定通过分析质粒pQJ012 的Rep以及dso 和sso 保守序列,推导pQJ012 复制方式所属家族及其可能的复制方式。
2 结果 2.1 魏斯氏菌的分离鉴定从样本中分离出一株魏斯氏菌,在MRS 平板培养基上,魏斯氏菌形成透明的小菌落,呈微隆起圆状轮廓;革兰氏染色后镜检发现该菌呈革兰氏阳性,短杆状,将其命名为QJ012。QJ012 菌株的16SrDNA 基因扩增片段长1 631 bp,序列比对结果表明,融合魏斯氏菌(W.confusa Inje LM S-338)的16SrDNA 序列(GenBank :DQ321751.1)是与扩增片段最相似的序列,相似性为99.9%,1 569 bp 中有2 个碱基不同;其次是魏斯氏菌(Weissella sp. MMZ50B,GenBank :EU157913.1),相似性为99.7%,1 546 bp中有5 个碱基不同。QJ012 菌株的16S rDNA 基因同与其最相似的融合魏斯氏菌的16S rDNA 基因差异仅为0.01 %,可判断QJ012 菌株为融合魏斯氏菌。
2.2 生化试验验证融合魏斯氏菌QJ012 的生化试验结果为不产生过氧化氢酶,不能利用L-阿拉伯糖,发酵葡萄糖、纤维二糖、半乳糖和麦芽糖均产酸,符合魏斯氏菌属和融合魏斯氏菌种的生化特征。生化试验结果符合分子鉴定的结论。
2.3 质粒提取与序列测定融合魏斯氏菌QJ012 质粒提取液电泳结果(图 1)显示该提取液有2 个条带,分别为1.5 kb 和14.5kb,提示QJ012 可能携带两个质粒。将较小的条带代表的质粒命名为pQJ012,分离纯化该质粒,委托广州艾基生物有限公司进行测序。测序后发现该质粒大小为1 489 bp,测序结果提交GenBank,登录号为:KR973434。
2.4 酶切鉴定通过DNAMAN 软件对pQJ012 序列的酶切位点分析显示其能被Hind Ⅲ和Nhe Ⅰ 切开。两个酶切位点相距347 个碱基,双酶切后,质粒将被切为347bp 和1 142 bp 两个线性片段。融合魏斯氏菌质粒提取液经双酶切后电泳结果(图 1)显示有0.3 kb、1.1kb、1.2 kb、2 kb 和13 kb 共5 条条带,其中0.3 kb与1.1 kb 条带应为pQJ012 被切开后产生的条带,1.2kb、2 kb 和13 kb 条带应为14.5 kb 条带所代表质粒被切开后产生的条带。

|
| 图 1 融合魏斯氏菌质粒pQJ012 酶切鉴定电泳图 |
质粒pQJ012 的G+C 含量为42.8%,BLAST 比对结果显示,该质粒的核苷酸序列与食窦魏斯氏菌中已被发现的质粒pJY33(2 365 bp)、pKLCA(1 490 bp)最为相似,与pJY33(GenBank number :KF879106.1)的相似性为93%,1 454 bp 中相似序列长度为1 354 bp ;与pKLCA(GenBank number :AY188776.1) 的相似性为92%,1 498 bp 中相似序列长度为1 364 bp。目前,pJY33 与pKLCA在PubMed 尚无文献可供查阅。通过ORF 搜索,pQJ012 有5 个ORF,ORF1 编码一个282 个氨基酸残基的蛋白,从593 bp 到1 441 bp,应为该质粒的复制蛋白(Rep)(图 2);其余ORF 在GenBank没有与之相匹配的蛋白。该Rep 的氨基酸序列与pJY33 和pKLCA 的Rep 氨基酸序列同源性分别为91% 和85%。 该质粒没有编码影响菌株表型的蛋白,应归为隐蔽质粒。
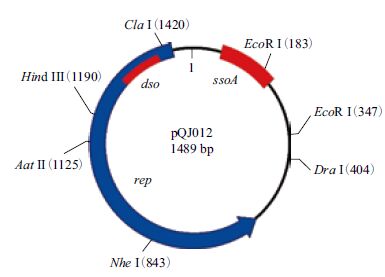
|
| 图 2 质粒pQJ012 的物理图谱 |
滚环复制的质粒必须携带dso 和sso 位点,并编码相关复制蛋白,根据dso 和复制蛋白的不同,滚环复制的质粒至少被分为7 大家族:pT181、pC194/pUB110、pE194/pLS1、pSN2、pGA1、pG13和pTX14[12]。pT181 家族的复制蛋白的保守结构域是pfam02486,dso 位点有三项特征:复制蛋白切开位点nic 区的保守序列为TAATAG[13];围绕nic 区有3 个反向重复序列[14];dso 位点位于复制蛋白编码区的N 端。pT181 家族的sso 位点为ssoA,其保守序列是TAGCGA/T[13]。经过序列分析,pQJ012 的复制蛋白具有保守结构域pfam02486 ;其dso 位点具有pT181 家族的三项特征(图 3-A,图 4)。pQJ012 的sso 位点吻合ssoA 的特征(图 3-B)。综上,我们推定pQJ012 的复制方式为滚环复制,属于pT181 家族。

|
| 图 3 质粒pQJ012 dso(A)和pQJ012 ssoA(B)序列比对图 |

|
| 图 4 质粒pQJ012 复制起始点示意图 |
魏斯氏菌属于益生菌,能产生β-葡糖苷酶、胞外多糖,具有食品防腐性能等优势,在医药与食品加工方面具有极大的开发潜力和商业价值。魏斯氏菌质粒的研究是在分子基因水平改造魏斯氏菌的基础,新质粒的发现,对于微生物的遗传学研究和构建具有自主知识产权的表达载体都具有重要意义。目前,魏斯氏菌质粒的研究还非常有限,魏斯氏菌中已被发现并对其序列进行了分析研究的质粒有pKLCA、pKLCB、pKLCC[7] 和pKW2124[9]。以上被发现的质粒中,只有pKW2124 的复制方式已被验证为θ 复制,同时pKW2124 已被成功构建为表达载体[9],而且以上已被分析的魏斯氏菌中的质粒均分离自食窦魏斯氏菌。本研究中pQJ012 为融合魏斯氏菌中首次被分离报道的质粒,pQJ012 同食窦魏斯氏菌中已发现的质粒pJY33(2 365 bp)和pKLCA(1 490 bp)最相似。这两个质粒在GenBank 中有供查询的序列,但在PubMed 尚无文献可供直接查阅。
分析pQJ012、pJY33 和pKLCA 的基本元件,即复制起点和复制蛋白,发现他们都属于滚环复制pT181 家族。pQJ012、pJY33 与pKLCA 的质粒复制双链启动位点dso 都符合滚环复制pT181 家族的特征,nic 区都含有保守序列TAATAG,围绕nic 区都有3 个反向重复序列。只是3 个质粒的反向重复序列的碱基序列虽然相同,但间距有所不同。3 个质粒的质粒复制单链启动位点sso 都是ssoA。3 个质粒的推定复制蛋白(Rep)的氨基酸序列同源性很高,都有滚环复制蛋白保守结构域pfam02486。
4 结论本研究首次从融合魏斯氏菌中发现一个隐蔽质粒pQJ012,其核苷酸序列同食窦魏斯氏菌中的pJY33 和pKLCA 的同源性分别为93% 和92%。ORF1 编码复制蛋白(Rep),该复制蛋白氨基酸序列与质粒pJY33 和pKLCA 的同源性分别为91% 和85%。推断pQJ012 的复制方式为滚环复制,属于滚环复制pT181 家族成员,质粒pQJ012 可能构建为良好的表达载体。
| [1] | Nam H, Ha M, Bae O, et al. effect of Weissella confusa strain pl9001 on the adherence and growth of helicobacter pylori[J]. Appl Environ Microbiol, 2002, 68(9):4642-4645. |
| [2] | Lee KW, Han NS, Kim JH. Purification and characterization of betaglucosidase from Weissella cibaria 37[J]. J Microbiol Biotechnol, 2012, 22(12):1705-1713. |
| [3] | Baek E, Kim H, Choi H, et al. Antifungal activity of Leuconostoc citreum and Weissella confusa in rice cakes[J]. J Microbiol, 2012, 50(5):842-848. |
| [4] | Tingirikari JM, Kothari D, Goyal A . Superior prebiotic and physicochemical properties of novel dextran from Weissella cibaria JAG8 for potential food applications[J]. Food Funct, 2014, 5(9): 2324-2330. |
| [5] | Galle S, Schwab C, Arendt E, et al. Exopolysaccharide-forming Weissella strains as starter cultures for sorghum and wheat sourdoughs[J]. J Agric Food Chem, 2010, 58(9):5834-5841. |
| [6] | Masuda Y, Zendo T, Sawa N, et al. Characterization and identification of weissellicin Y and weissellicin M, novel bacteriocins produced by Weissella hellenica QU 13[J]. J Appl Microbiol, 2012, 112 (1):99-108. |
| [7] | Ku HJ, Park MS, Lee JH. Characterization of a minimal pKW2124 replicon from Weissella cibaria KLC140 and its application for the construction of the Weissella expression vector pKUCm1[J]. Front Microbiol, 2015, 6 :35 |
| [8] | Jin HX, Yang XY, Cheng WY. Isolation and identification of Weissella containing endogenous plasmid from kimchi[J]. China Brewing, 2012, 1 :77-79. |
| [9] | Kim SY, Oh CG, Lee YJ, et al. Sequence analysis of a cryptic plasmid pKW2124 from Weissella cibaria KLC140 and construction of a surface display vector[J]. J Microbiol Biotechnol, 2013, 23(4): 545-554. |
| [10] | Pan Q, Cong YG, Hou R, et al. Purification and characterization of glyceraldehyde-3-phosphate dehydrogenase from Lactobacillus acidophilus[J]. J Immun, 2009, 25(4):461-464. |
| [11] | Zhan JL, Wang YF, Hu P. Identification and characterization of Lactobacillus curvatus LAB26 with antioxidant potential from sour meat of the dong minority[J]. Meat Research, 2014, 28(6):1-4. |
| [12] | Funnell BE, Phillips GJ. Plasmid Biology[M]. Washington : ASM Press, 2004 :60-61. |
| [13] | del Solar G, Giraldo R, Ruiz-Echevarria MJ, et al. Replication and control of circular bacterial plasmids[J]. Microbiol Mol Biol Rev, 1998, 62(2):434-464. |
| [14] | Balson DF, Shaw WV. Nucleotide sequence of the rep gene of staphylococcal plasmid pcw7[J]. Plasmid, 1990, 24(1):74- 80. |




