环己胺(cyclohexylamine,化学式C6H13N) 又称六氢苯胺,是一种重要的精细化工中间体,用于生产金属缓蚀剂、杀菌杀虫剂、橡胶硫化促进剂和防老剂等。在生产和使用过程中,环己胺被释放到环境中,可通过呼吸和皮肤进入人体,实验已证实该化合物有致癌性[1]。由于环己胺在工业生产上的广泛应用和对人体的明显危害性,研究对环己胺有降解作用的微生物并了解其分子机制,是消除环己胺对环境污染和残留的有效途径之一。
目前报道的以环己胺为碳氮源生长的纯培养物仅有两株,一株是Iwaki 等[2]分离筛选到的革兰氏阳性菌Brevibacterium oxydans IH-35A,另一株是由中国科学院武汉病毒研究所周宁一[3]研究组分离的革兰氏阴性菌Pseudomonas plecoglossicida NyZ12。
NyZ12 是一株能够利用环己胺作为唯一碳源、氮源生长的革兰氏阴性菌株,根据其16S rRNA 基因序列分析为假单胞菌属,鉴定为变形假单胞菌Pseudomonas plecoglossicida NyZ12。这与Iwaki 等分离筛选到能降解环己胺的革兰氏阳性短杆菌Brevibacteriumoxydans IH-35A 不同,也是目前为止国内第一次报道能降解环己胺的细菌。
本实验室对该菌株进行全基因组测序,获得全基因组信息[4]。通过对比分析,预测orf4637 基因可能与环己胺降解过程有关。研究基因功能的重要方法之一是构建基因的突变体来检测其表型的变化,以推测某个基因在生长过程中起到何种作用。其中最直接的方法是将目的基因敲除,这样可以保证被研究的基因完全失活[5]。因此,为了进一步研究基因orf4637 的功能,本研究采用无痕敲除技术构建Δ4637 基因敲除体系。通过overlapping PCR 技术[6]将目的基因上下游同源臂融合并克隆到自杀载体上,再将构建的敲除载体转移至受体菌,利用同源重组原理取代基因组上序列相同或非常相近的基因并使后者完全丧失功能[7]。旨在为后期对敲除突变体NyZ12Δ4637 进行表型研究,确定其在生长中是否起关键作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒假单胞菌NyZ12(AmpR);E.coliS17 pir 菌株(StrR);pGEM-T Easy 载体(AmpR);自杀质粒pEX18km(KanR),所用抗生素浓度为氨苄青霉素Amp(100 g/mL),链霉素Str(10 g/L),卡那霉素Kan(50 g/L)。
1.1.2 主要试剂5×TransStart FastPfu buffer、TransStartFastPfu DNA Polymerase、2.5 mmol/L dNTPs、限制性内切酶EcoR I 和Sal I,T4 DNA Ligase 均购自TaKaRa 公司;质粒快速提取试剂盒、PCR 产物凝胶回收试剂盒(离心柱型)、基因组提取试剂盒均购自上海捷瑞生物工程有限公司。
CCMB80 溶液:KAc(1 mol/L pH8.0)1 mL,0.891 g NaCl,Glycerol 10 mL,MnCl2·4H2O(1 mol/L)1 mL,MgCl2·6H2O(1 mol/L)1 mL,定容至100mL,过滤除菌,冰上储存备用。
LB 培养基:NaCl 1 g,Tryptone 1 g,Yeast Extract0.5 g,加水定容至100 mL,121℃下高温灭菌20 min。
环己胺无机盐培养基:KH2PO4 1.5 g,Na2HPO4·12H2O 3.8 g,定容至1 L,121℃高温灭菌;再依次加入高温灭菌的10 mL 1 g/L CaCl2·2H2O ;10 mL 过滤除菌的5 g/L MgSO4·7H2O、0.2 g/L MnSO4·4H2O及0.5 g/L FeSO4·7H2O 的混合体系,10 mL 过滤除菌1 mol/L 的环己胺盐酸盐溶液(pH7)。
RGMC :1% Tryptone ;0.1% Yeast extract ;0.8%NaCl ;0.1% glucose ;5 mmol/L MgCl2 ;5 mmol/LCaCl2 。其他生化试剂均从国药集团化学试剂有限公司购买的分析纯试剂。
1.2 方法 1.2.1 同源臂扩增设计两对引物分别扩增orf4637基因上游约700 bp 及下游约900 bp 大小同源臂,引物序列见表 1。以环己胺降解菌NyZ12 基因组DNA作为模板,引物对分别为P1/P2 和P3/P4 进行PCR反应,PCR 体系如下:模板0.3 μL,FastPfu 酶1μL,5×FastPfu buffer 10 μL,上下游引物各1 μL,加无菌去离子水至50 μL。扩增程序为:98℃ 2 min,98℃ 20 s,60℃ 20 s,72℃ 20 s,30 个循环;72℃ 5min。凝胶电泳回收PCR 产物。
纯化后的同源臂片段1∶1混合,将混合DNA 片段作为模板进行融合PCR,引物对为P1/P4。PCR 体系和扩增程序同上,延伸时间延长至1 min,将纯化PCR 产物加“A”后克隆到pGEM-T Easy 载体上,酶切鉴定连接正确大小片段的克隆并测序。
1.2.3 缺失突变载体的构建分别以EcoR I 和Sal I对pEX18km 质粒和连有目的片段的pGEM-T Easy 载体进行双酶切并经过凝胶电泳回收。将酶切后的质粒和目的片段按适当的比例混合,加入T4 连接酶在16℃连接过夜,再将连接产物转化到E.coli S17 pir感受态细胞中,转化产物在37℃,180 r/min 的LB培养基中活化1 h 后,取100 μL 涂布于LB 平板上(StrR,KanR),37℃培养至出现单菌落。通过酶切鉴定筛选出含有融合片段的重组质粒。
1.2.4 结合转移[8]和单交换将含重组质粒的E.coilS17 pir 接种在LB 培养基中,环己胺降解菌NyZ12接种在无机盐培养基中。分别在37℃和28℃,170r/min 培养至OD600=0.5-0.8。随后以供体菌(含有重组质粒E.coil S17 pir) 与受体菌(NyZ12)1∶2 和1∶5 的比例混合菌液,6 000 r/min 离心30 s 收集菌体,用100 μL RGMC 将菌体洗涤两遍,最后50 μL重新悬浮并滴加在滤膜上。待菌液被滤膜充分吸收后,将其案贴在RGMC 平板上,28℃培养8-12 h。之后用100 μL 无菌水洗涤滤膜,洗下的菌液涂布在含有氨苄青霉素和卡那霉素的双抗LB 平板上,28℃培养至长出单克隆菌落。根据抗性筛选和PCR 鉴定,找到发生单交换菌株。
1.2.5 双交换挑单交换菌株接种于LB 培养基中(AmpR),28℃,170 r/min 多次传代培养。传至第4代将菌液稀释100 倍后取100 μL 涂布于10%蔗糖的LB 平板上,28℃培养至出现单菌落。挑取单克隆接种于含有Amp 的LB 培养基中培养,再将过夜培养的菌液取4 μL 分别接种于含有Amp 或者含有Kan 和Amp 双抗LB 培养基中,28℃培养。挑选能在Amp 培养基中生长但不能在双抗培养基中生长的单克隆进行PCR 鉴定,鉴定引物P1/P4 和E1/E2。
将本实验中突变载体的构建和交换过程分别总结为图 1、图 2。

|
| 图 1 Δ4637 突变载体构建步骤流程图 |
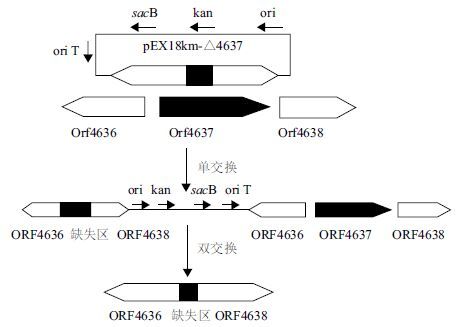
|
| 图 2 单交换和双交换过程 |
煮沸法[9]提取敲除菌的基因组,并以敲除菌基因组DNA 作为模板,引物对分别为P1/E2 进行PCR 反应,PCR 体系如下:模板4 μL,FastPfu 酶1 μL,5×FastPfu buffer 10 μL,引物各1μL,加无菌去离子水至50 μL。扩增程序为:98℃ 2min ;98℃ 20 s,58℃ 20 s,72℃ 30 s,30 个循环;72℃ 5 min。凝胶电泳回收PCR 产物并送至生工测序部测序。
1.2.7 生长实验将敲除菌与野生菌按0.5% 的接种量接种于装有50 mL 无机盐培养基的三角瓶(250mL)中,从12 h 开始取样,然后每隔1 h 测定菌液OD 值,绘制敲除菌与野生菌的生长曲线,比较生长状况。
2 结果 2.1 同源臂与融合PCR扩增引物对P1/P2 扩增orf4637 上游同源臂(约663 bp),引物对P3/P4 扩增orf4637 下游同源臂(约863 bp),成功融合的片段大小为1 526 bp。1%琼脂糖电泳结果(图 3、图 4)显示,PCR 产物大小与预期相符,通过凝胶电泳回收得到高纯度的目的片段。
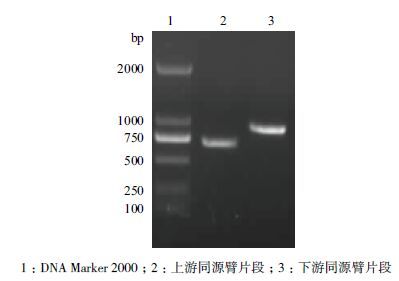
|
| 图 3 PCR 扩增同源臂 |
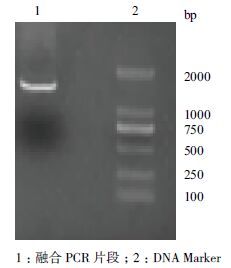
|
| 图 4 PCR 扩增融合片段产物 |
将融合片段加A 后连接到pGEM-T Easy 载体上,抽取质粒并酶切鉴定,确定目的片段连接T 载体上的阳性克隆测序。提取质粒pEX18km 并用EcoR Ⅰ和Sal Ⅰ 进行酶切,酶切后的DNA 片段进行琼指糖电泳,结果(图 5)显示,大小约为 6 100 bp,与标准序列大小相符。再用EcoR Ⅰ 和Sal Ⅰ 对连接目的片段的T 载体片段进行双酶切,将两个片段分别回收后连接构建重组质粒pEx18km-△4637,转化至E.coli S17 pir 菌株中,抽取质粒酶切鉴定,鉴定结果见图 6。
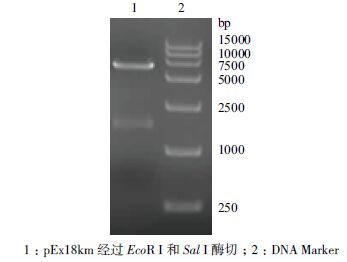
|
| 图 5 pEx18km 酶切后电泳图 |

|
| 图 6 重组质粒pEx18km-△4637 酶切鉴定图 |
E.coli S17 pir 与环己胺降解菌通过微孔滤膜进行结合转移的效率比较高,重复性好。一般能在卡那霉素和氨苄青霉素抗性平板上生长的单克隆都是发生了单交换的阳性重组克隆。再挑取单菌落进一步鉴定,分别用扩目的基因orf4637 的引物对E1/E2和基因敲除引物对P1/P4 进行PCR 鉴定。用引物E1/E2 扩增有1 600 bp 和120 bp 左右两条DNA 片段(图 7,1、2 泳道),以P1/P4 扩增有3 000 bp 和1 600 bp 左右两条片段(图 8,2、3 泳道)的克隆就是发生单交换的突变株。
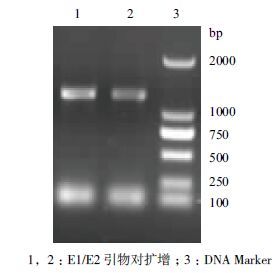
|
| 图 7 E1/E2 引物对鉴定单交换 |

|
| 图 8 P1/P4 引物对鉴定单交换 |
单交换菌株在LB 培养基中传4 代,稀释后涂布于含有Amp 和10%蔗糖的LB 平板上。由于自杀质粒pEx18km 上sacB 基因突变率高,在平板上长出的单克隆也可能是单交换菌。但是双交换菌不具备Kan 抗性,单交换菌具有Kan 抗性,所以利用抗性筛选,找到可能的双交换突变体。再以该菌基因组为模板,分别用扩目的基因orf4637 的引物对E1/E2和基因敲除引物对P1/P4 进行PCR 鉴定,鉴定结果如图 9 和图 10 所示。以引物E1/E2 扩增只有120 bp大小片段(图 9,1 泳道),而外侧引物对P1/P4 扩增只有1 600 bp 左右片段的克隆即为发生双交换的阳性克隆,相对于单交换,无3 000 bp 左右的扩增产物(图 10,1 泳道),其扩增产物比以野生株为模板的扩增产物小了约1 400 bp,即缺失了基因编码区。
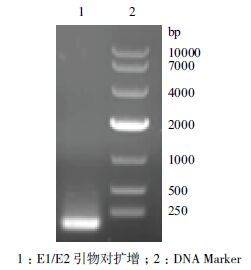
|
| 图 9 E1/E2 引物对鉴定双交换 |

|
| 图 10 P1/P4 引物对鉴定双交换 |
煮沸法提取敲除菌株基因组并利用引物P1/E2扩增缺失区得到约750 bp 大小片段,如图 11 所示。

|
| 图 11 P1/E2 引物扩敲除片段 |
将目的片段凝胶电泳回收并送至生工测序部测序,结果如图 12 所示。
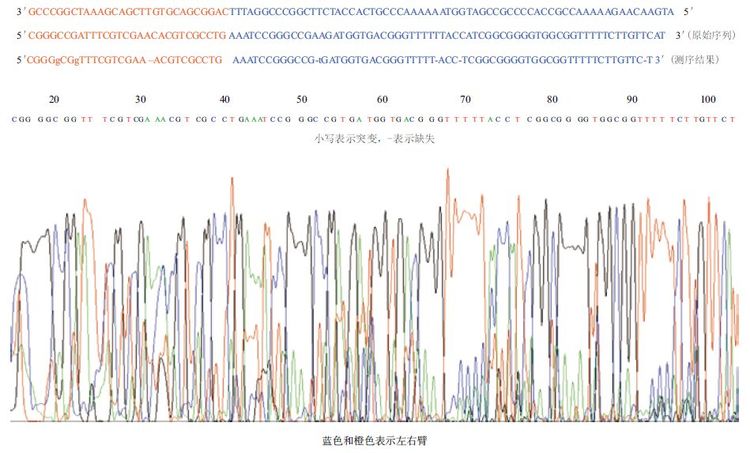
|
| 图 12 测序鉴定双交换突变体 |
由于这段序列靠近测序3' 端,有几个碱基突变和缺失,可能是测序误差。这段序列已经跨过敲除区域,可以从两段序列的对比发现orf4637 基因中间缺失,说明的确发生了双交换,orf4637 成功敲除。
2.6 敲除菌生长实验通过对敲除菌的生长实验的研究,绘制了敲除菌与野生菌的生长曲线(图 13),比较发现敲除orf4637 突变体相对野生型在环己胺的无机盐培养基中的生长变慢,但不是很明显。
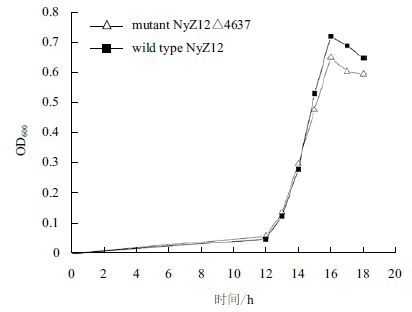
|
| 图 13 敲除菌的生长曲线 |
目前国际上对环己胺的微生物降解研究并不多,微生物代谢环己胺的分子机理尚未揭示,因此以环己胺降解菌NyZ12 为实验对象,构建一种可行的无痕敲除体系,成功敲除野生菌中的目的基因,对后续研究该菌的环己胺降解分子机制至关重要。利用同源重组技术敲除目的基因是目前研究基因功能最常用的定点突变手段,无痕敲除的主要优势是不需要在同源序列中插入抗性标记基因,这样不仅简化了敲除载体的构建,而且减少了插入抗生素基因产生极性效应对菌株生长产生的不良影响。同时构建敲除载体时,SacB 基因的引入使得无痕敲除效率大大提高。SacB 基因来源于枯草芽孢杆菌,编码分泌性的蔗糖-6-果糖基转移酶,该酶催化蔗糖的水解和果聚糖的合成。在革兰氏阴性菌中,在有蔗糖存在的情况下,基因的表达对细菌来说是致死性的[10]。
自杀载体pEx18km[11] 不仅有反向筛选基因sacB 还有Kan 标记抗性,因此发生第一次交换后,将突变株涂布于含有氨苄青霉素和卡那霉素抗性的LB 平板,因为野生菌本身具有Amp 抗性而E.coli S17 不含Amp 抗性,因此能在平板上生长的单克隆,应该是整合了pEx18km 的环己胺降解菌,也就是发生了单交换,再利用PCR 方法确定,可以找到发生单交换的阳性克隆。此方法大大加快了构建缺失株的步伐,成为整个构建无痕突变株过程的关键步骤。再将多次传代的单交换菌株,涂布于高蔗糖浓度的LB 平板。利用蔗糖的选择性压力和细菌染色体复制过程中发生的自由重组去除载体序列,产生无标记突变株[12, 13]。在整合了pEx18km 的环己胺降解菌中只有发生第二次交换的突变株才能在含有蔗糖的培养基中生长。抗生素抗性和sacB 基因表达可作为正和负选择标记,但是自发的抗生素抗性、高异常重组率和基因突变可能会导致较高的假阳性,所以最后应对大量突变株进行鉴定[14]。
我们完成了环己胺降解菌NyZ12 的基因组测序,预测基因组有5 个胺氧化酶基因,最直接验证基因功能的方法是克隆表达基因,测定是否有酶活力。初步实验结果表明orf4637 对底物环己胺有酶活力。通过基因敲除,观察突变体的生长情况,从另一个角度回答orf4637 是否参与环己胺的代谢。对NyZ12Δ4637 敲除菌株进行了生长实验,与野生菌对比,发现基本生长情况变化不明显,所以推断环己胺代谢途径中催化其第一步的环己胺氧化酶可能有多个,orf4637 不是主效基因。这为后续逐一敲除其他胺氧化酶基因,研究突变体的表型奠定了基础。
4 结论本研究选择可能与环己胺降解有关的orf4637 作为目的基因,选用自杀质粒pEx18km 作为载体,建立了成熟的环己胺降解菌NyZ12 基因无痕敲除方法,成功构建了假单胞菌NyZ12Δ4637 基因突变株。
| [1] | Bopp BA, Sonders RC, Kesterson JW. Toxicological aspects of cyclamate and cyclohexylamine[J]. Crit Rev Toxicol, 1986, 16 : 213-306. |
| [2] | Iwaki H, Shimizu M, Tokuyama T, et al. Biodegradation of cyclohexylamine by Brevibacterium oxydans IH-35A[J]. Appl Environ Microb, 1999, 65 :2232-2234. |
| [3] | Shen Y, Yan DZ, Chi XQ, et al. Degradation of cyclohexylamine by a new isolate of Pseudomonas plecoglossicida[J]. World J Microbiol Biotechnol, 2008, 24 :1623-1625. |
| [4] | Li X, Li CZ, Mao LQ, et al. Complete genome sequence of the cyclohexylamine-degrading Pseudomonas plecoglossicida NyZ12[J]. Journal of Biotechnol, 2015, 199 :29-30. |
| [5] | 于慧敏, 马玉超. 工业微生物代谢途径调控的基因敲除策略[J]. 微生物代谢工程, 2010, 26(9):1199-1208. |
| [6] | Lee J, Shin MK, Ryu DK, et al. Insertion and deletion mutagenesis by overlap extension PCR[J]. Methods in Molecular Biology, 2010, 634 :137-146. |
| [7] | 黄勇. 细菌基因突变的策略及应用术[J]. 微生物学通报, 2007, 34(1):169-172. |
| [8] | Simon RU, Priefer U, Puhler A. A broad host range mobilization system for in vivo genetic engineering :transposon mutagenesis in Gram-negative bacteria[J]. Nat Biotech, 1983, 1 :784-791. |
| [9] | 张志鸿, 甘蓓, 谭强来, 等. 基于不同靶基因的荧光定量PCR 快速检测蜡样芽孢杆菌的研究[J]. 食品工业科技, 2013, 23 (34):160-163. |
| [10] | Hu F, Jiang X, Zhang JJ, et al. Construction of an engineered strain capable of degrading two isomeric nitrophenols via a sacB - and gfp -based markerless integration system[J]. Appl Microbiol Biotechnol, 2014, 98(10):4749-4756. |
| [11] | Hoang TT, Karkhoff-Schweizer RR, Kutchma AJ, et al. A broadhost- range Flp-FRT recombination system for site-specific excision of chromosomally-located DNA sequences :application for isolation of unmarked Pseudomonas aeruginosa mutants[J]. Gene, 1998, 212(1):77-86. |
| [12] | Heng C, Chen ZJ, et al. Expression and secretion of an acid-stable α -amylase gene in Bacillus Subtilis by SacB promoter and signal peptide[J]. Biotechnol Lett, 2005, 27(21):1731-1737. |
| [13] | Sun XY, Yang DD, Wang YY, et al. Development of a markerless gene deletion system for Streptococcus zooepidemicus :functional characterization of hyaluronan synthase gene[J]. Appl Microbiol Biotechnol, 2013, 97 :8629-8636. |
| [14] | Zhou QM, Fan DJ, Xie JB, et al. A method for generating precise gene deletions and insertions in Escherichia coli[J]. World J Microbiol Biotechnol, 2010, 26 :1323-1329. |





