葡萄营养丰富,味道鲜美,是世界产量最大的水果之一[1, 2]。新疆是我国葡萄的主产区,在地区水果种植业中占有重要地位[3]。近年来,红提葡萄作为新疆鲜食葡萄优良品种之一,栽培面积迅速增加,发展前景广阔[4]。然而,红提葡萄在采后贮藏运输期间,灰霉病病害发生普遍而且严重,给生产造成巨大损失,成为产业发展的一个重要障碍[5]。长久以来一直使用化学杀菌剂来抑制葡萄灰霉病,但此类传统保鲜法易造成农药残留、环境污染、危害人体健康以及病原菌产生抗药性等一系列问题,也制约了产业的发展[6, 7],而生物保鲜法为解决上述问题提供了新的契机。
植物内生菌是指存活在健康植物组织内部,而又不引发宿主植物表现出明显感染症状的微生物类群[8, 9]。它们在长期的协同进化过程中,与植物形成互惠互利的共生关系[10]。植物内生细菌能产生活性物质,如抗菌肽、生物碱和几丁质酶等[11, 12],对生物防治和稳定生态环境有一定作用。目前,内生细菌抑制病原菌的研究受到越来越多的关注,已有从骏枣[13]、辣椒[14]、小麦[15]等多种植物内分离筛选出具有抗病作用的内生细菌的报道,但内生细菌应用于果蔬采后病害防治的研究相对较少,因此分离并利用植物自身的内生细菌来控制果蔬采后病害对生态农业的发展具有重要意义。本研究采用组织分离法,从健康红提葡萄的果梗、果皮、果肉、果籽中分离出内生细菌,探索其对葡萄灰霉菌的拮抗作用,筛选具有抑菌活性的内生细菌,从而为葡萄灰霉病的生物防治提供借鉴和参考。
1 材料与方法 1.1 材料 1.1.1 植物材料红提葡萄(Red Grape)采自新疆省石河子143 团葡萄园,封存于封口袋中,带回实验室进行内生细菌的分离。
1.1.2 病原菌葡萄灰霉菌(Botrytis cinerea)由北京市农林科学院提供。
1.1.3 培养基NA 培养基[16]的分离纯化培养:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,蒸馏水1 000 mL,pH7.0-7.2 ;PDA 培养基[17]:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,自然pH 值。
1.2 方法 1.2.1 红提葡萄内生细菌的分离纯化取新鲜、完整、无病害的红提葡萄,用自来水将表面冲洗干净。常规无菌操作下,用75% 的乙醇溶液浸泡3 min,并用无菌水冲洗4 次,再用10% 的次氯酸钠溶液浸泡15-30 s,无菌水冲洗4 次,之后用无菌滤纸擦干[18]。取最后一遍冲洗的无菌水做空白对照实验,涂布NA 于29℃下静置培养7 d,若培养皿中无菌落出现,则证明消毒彻底。
将表面消毒后的红提葡萄果实用无菌刀片切开,用镊子撕取果皮、果肉并将果蒂、果籽切开紧贴NA平板进行培养,29℃培养3-5 d。待组织块周围长出菌落后,根据菌落形态、颜色、边缘状态、干湿度等挑取性状不同的菌落反复划线纯化,直至得到单菌落,斜面4℃保存备用[19]。
1.2.2 内生细菌的分类鉴定 1.2.2.1 形态特征根据菌落特性及菌体形态大小特征,革兰氏染色等对内生细菌进行初步鉴定[20]。
1.2.2.2 16S rDNA 序列测定及同源性比对内生细菌DNA 的提取采用常规CTAB 法[21]。采用细菌通用引物 27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGHTACCTTGTTACGACTT-3') 扩增16S rDNA 基因序列。PCR 反应体系为:模板10×PCR buffer 5 μL、dNTP(2.5 mmol/L)4 μL、模板2 μL、Taq DNA 聚合酶1 μL、引物各1 μL,补充去离子水至50 μL。反应条件为:95℃ 5 min ;95℃30 s,48℃ 30 s,72℃ 1 min,40 个循环;72℃ 10min。PCR 产物用1% 凝胶电泳进行分析后送北京市理化分析测试中心进行测序。
获得各菌株序列后,与GenBank 数据库中的已知序列进行BLAST 比对分析,寻找具有较高同源性的16S rDNA 序列。并利用MEGA 4.0 软件进行系统发育分析,构建系统发育树。
1.2.3 内生细菌对葡萄灰霉菌拮抗作用的测定 1.2.3.1 初筛采用平板对峙法[22]进行初筛,将分离得到的内生细菌菌株在NA 平板上活化1 d 后,用接种环挑取一环在PDA 平板中央划线,并将供试葡萄灰霉菌菌饼(直径6 mm)分别接种在平板两侧,接种点具平板中心3 cm。同时以单独接种灰霉菌菌饼的平板为对照,每处理做3 次重复,置于25℃培养7 d,观察菌落直径,从中筛选出抑菌活性强的拮抗菌进行复筛。
1.2.3.2 复筛采用滤纸片法[23]进行复筛。将初筛出的拮抗菌活化并扩大培养制成106 CFU/mL 的菌悬液待用。将葡萄灰霉菌菌饼(直径6 mm)放于PDA平板中央,然后在平板上接入4 个沾有内生菌发酵原液的圆滤纸片,并以沾有无菌水的滤纸片为对照。接种点具平板中心3 cm,每种处理均做3 次重复。置于25℃培养7 d 后,测量菌落直径。
病原菌抑菌效果用抑菌率衡量,抑菌率(%)=[1-(处理菌落直径/ 对照菌落直径)]×100%。
2 结果 2.1 内生细菌的分离纯化结果经7 d 观察,最后一次清洗水涂布的NA 平板中并未有任何菌体生长,证明表面消毒彻底,NA 平板中分离得到微生物为红提葡萄内生细菌。
通过组织分离法,从红提葡萄中共分离得到18株内生细菌,不同组织部分分离获得的内生细菌种类不同,且分离频率不同。其中果梗中分离出6 株(33%),果肉中分离出6 株(33%),果皮中分离出5 株(28%),果籽中分离出1 株(6%)(表 1)。虽然分离数量有限,但在一定程度上反映了红提葡萄中内生菌的多样性。
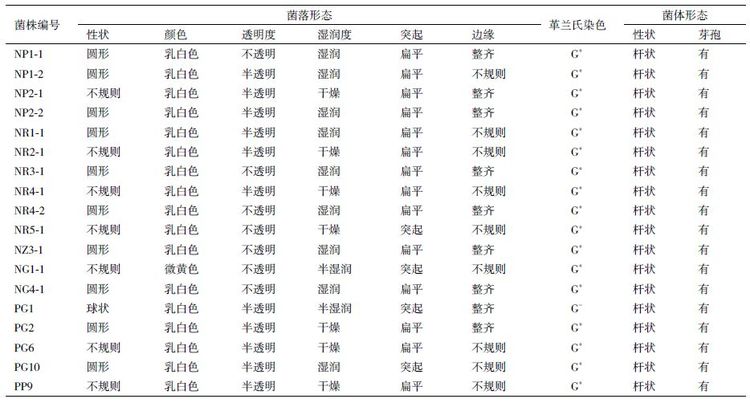
将分离得到的18 株内生细菌在NA 固体平板上29℃培养1 d,根据性状、颜色、透明度等菌落形态进行观察,并进行革兰氏染色,在显微镜下观察菌体形态。菌株的形态学鉴定结果(表 2)显示,筛选出的18 株内生细菌经革兰氏染色后,除PG1 外均呈革兰氏阳性,菌株均为杆状、产芽孢。
用细菌基因组DNA 提取试剂盒提取红提内生细菌基因组DNA,以菌株基因组DNA 为模板进行PCR 扩增,其中大部分PCR 产物条带清晰且单一,大小均约为1.5 kb,与预期目标大小一致(图 1)。

|
| 图 1 部分菌株的16S rDNA 基因扩增产物电泳图谱 |
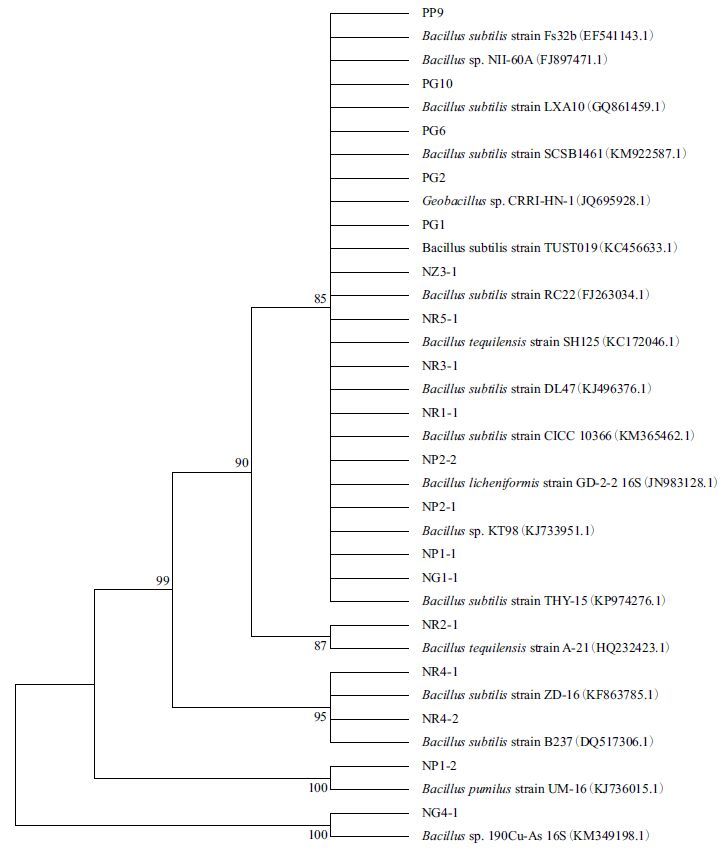
将所测得的16S rRNA 基因序列提交到GenBank数据库中,用BLAST 进行相关序列的比对,结果(表 3)表明菌株16S rDNA 序列与已知序列的同源性均达到98% 以上。同时从数据库获得相关属、相关种的16S rRNA 基因序列,构建系统发育树(图 2)。
|
| 图 2 基于16S rDNA 序列构建的红提内生细菌系统发育树 |
通过16S rDNA 序列比对分析结果和构建的系统发育树表明,分离得到的18 株内生细菌均为芽孢杆菌属。其中枯草芽孢杆菌10 株(NP2-2、NG1-1、NZ3-1、NR1-1、NR4-1、NR4-2、NR5-1、PP9、PG2 和PG6),高温芽孢杆菌3 株(NP1-1、NG4-1和PG10),特基拉芽孢杆菌2 株(NR2-1 和NR3-1),短小芽孢杆菌1 株(NP1-2),地衣芽孢杆菌1 株(NP2-1),嗜热溶胞土芽孢杆菌1 株(PG1)。枯草芽孢杆菌类为优势类群,占总数的55.6%。
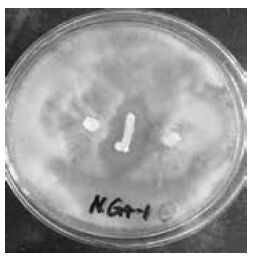
2.3 内生拮抗菌的筛选结果 2.3.1 初筛结果采用平板对峙法对分离得到的18株内生细菌进行拮抗筛选,初筛得到8 株内生细菌对葡萄灰霉菌有不同程度的拮抗作用(图 3),分别为NR3-1、NR4-1、NR5-1、NP1-1、NP2-2、NG4-1、PG1 和PP9,占所分离菌株的44.4%。将初筛得到的8 株菌进行复筛实验。
|
| 图 3 部分内生细菌对葡萄灰霉病病原菌的拮抗效果 |
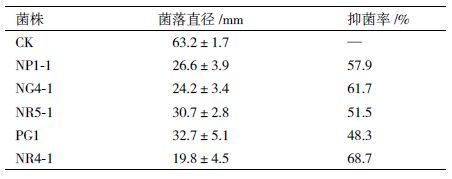
采用滤纸片法对初筛得到的8 株内生细菌进行复筛实验,其中5 株内生细菌对葡萄灰霉菌有较好的拮抗作用(表 4),占所分离菌株的27.8%。其中,2 株分离自葡萄果梗,2 株分离自葡萄果肉,1 株分离自葡萄果皮。NR4-1 对葡萄灰霉菌抑菌效果最强,抑菌率可达68.7%。
葡萄灰霉病是由葡萄灰霉菌引起的一种世界性病害,其病菌具有繁殖快、遗传变异大和适合度高的特点,多发生于葡萄贮藏运输期间,引起果实腐烂,损失严重。目前对葡萄灰霉病的防治仍以化学防治为主,包括多菌灵、速克灵、扑海因等化学药剂的使用仍是抑制病害的主要手段,但由于药剂的连续使用,病菌的抗药性产生迅速,使防效不断下降,同时易造成农产品和环境的严重污染,危害人体健康[21]。为了减少化学杀菌剂的使用,确保果实的安全性,生物防治日益成为灰霉病控制中一条重要而有效的途径。作为重要生防微生物之一的内生细菌,可以通过提高植物抗病性、与病原菌竞争生态位或产生拮抗物质等发挥防病功效,且内生细菌存在于植物体内不易受到外界环境条件的影响,可以较长时间发挥生物学作用,因此具有防治果蔬采后病害的优势[22]。目前用于防治灰霉菌的生防内生菌种类很多,芽孢杆菌产生的芽孢耐热抗逆,具有突出的优势,在灰霉菌的防治中使用次数较多。其中主要有枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)等。本实验从红提葡萄中分离出18 株内生细菌,均为芽孢杆菌,并将其用于葡萄灰霉病的生物防治中,其中5 株内生细菌对病菌具有较好的拮抗效果,抑菌率最高可达68.7%。本研究所分离筛选的内生细菌是在体外条件下对病原菌进行的拮抗实验,但其在活体上对病原菌的抑制能力是否和体外一致,能否对试验以外的病原菌有抑菌作用,能否增加葡萄的抗病性,还需进一步研究验证。
4 结论本研究采用组织分离法从健康的红提葡萄中分离得到18 株内生细菌,经形态鉴定和分子生物学鉴定,均为芽孢杆菌属。其中5 株对葡萄灰霉菌具有较好的拮抗作用,分别为枯草芽孢杆菌、高温芽孢杆菌和嗜热溶胞土芽孢杆菌。NR4-1 对葡萄灰霉菌的生长抑制作用尤其明显,抑菌率达68.7%,具有潜在开发价值。
| [1] | 秦丹, 石雪晖, 林青录, 等. 葡萄采后病害生防制剂用拮抗酵母的筛选[J]. 食品科学, 2008, 29(7):303-305. |
| [2] | Stéphane C, Birgit M, Juan C, et al. Endophytes of grapevine flowers, berries, and seeds :identification of cultivable bacteria, comparison with other plant parts, and visualization of niches of colonization[J]. Micob Ecol, 2011(62):188-197. |
| [3] | 蒲胜海, 张计峰, 丁峰, 等. 新疆葡萄产业发展现状及研究现状[J]. 北方园艺, 2013(13):200-203. |
| [4] | 巩洁. 红提葡萄白腐病拮抗微生物的选育及其生物防治的应用[D]. 西安:西北大学, 2010. |
| [5] | 宋开艳. 葡萄采后病害病原菌致病特点及拮抗菌的筛选[D]. 阿拉尔:塔里木大学, 2011. |
| [6] | 陈玲, 王小艳. 葡萄采后生理生化特征及贮藏保鲜技术的研究进展[J]. 食品安全导刊, 2014(20):70-72. |
| [7] | 李明娟, 游向荣, 文仁德. 葡萄果实采后生理及贮藏保鲜方法研究进展[J]. 北方园艺, 2013(30):173-178. |
| [8] | 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2):349-363. |
| [9] | 王志伟, 陈永敢, 王庆璨. 中国植物内生微生物研究的发展和展望[J]. 微生物学通报, 2014(22):452-453. |
| [10] | 张祺玲, 杨宇红, 谭周进, 等. 植物内生菌的功能研究进展[J]. 生物技术通报, 2010(7):28-34. |
| [11] | 王宇婷, 易有金, 杨建奎, 等. 植物内生菌抗菌活性物质的研究进展[J]. 农产品加工·学刊, 2013(2):1-5. |
| [12] | 王丽衡. 植物内生菌的研究进展[J]. 化学与生物工程, 2011, 28(3):5-8. |
| [13] | 李燕津. 骏枣内生细菌的分离?鉴定与拮抗菌的筛选[D]. 太原:山西医科大学, 2012. |
| [14] | 蔡文韬. 辣椒内生拮抗菌采后生物防控及应用效果研究[D]. 长沙:湖南农业大学, 2012. |
| [15] | 温辉芹, 裴自友, 张立生, 等. 小麦内生细菌鉴定及其对小麦赤霉病菌的拮抗作用[J]. 山西农业科学, 2012, 40(7): 765-767. |
| [16] | 赵龙飞. 拮抗性山药内生菌的分离和筛选[J]. 湖北农业科学, 2014, 53(10):2318-2321. |
| [17] | 李娟, 夏延斌, 蔡文韬. 辣椒内生菌的分离及拮抗菌的筛选与鉴定[J]. 农产品加工·学刊, 2013(1):1-3. |
| [18] | 王志勇, 刘志娟, 易曲. 植物内生菌分离时表面消毒条件的比较[J]. 江苏农业科学, 2014, 42(8):366-367. |
| [19] | 王志勇, 刘志娟. 植物内生菌分离方法的研究现状[J]. 贵州农业科学, 2014, 42(1):152-155. |
| [20] | 黄秀梨. 微生物学实验指导[M]. 北京:高等教育出版社, 1999. |
| [21] | 申煌煊, 李刚. 分子生物学实验方法与技巧[M]. 广州:中山大学出版社, 2010 :134-135. |
| [22] | 李燕津, 邱服斌, 陈美娟, 等. 骏枣内生生防细菌的分离?筛选与鉴定[J]. 微生物学通报, 2011, 38(7):1031-1035. |
| [23] | 徐亚军, 赵龙飞. 野生艾蒿浸提物对大肠杆菌的抑制作用[J]. 江苏农业科学, 2012, 40(4):306-308. |
| [24] | 陈林凤, 范咏梅, 郝敬喆, 等. 三种生防细菌对新疆灰霉病菌的拮抗作用[J]. 新疆农业科学, 2009, 46(6):1252-1257. |
| [25] | 赵旭, 常思静, 景春娥, 等. 我国植物内生菌研究进展[J]. 中国沙漠, 2010, 30(1):87-91. |