海带(Saccharina japonica)是一种大型经济海藻,在医药、食品、化工等方面都有广泛应用。在我国海水养殖业中占有重要地位。目前我国海带栽培面积37 282 hm2,产量1 017 737 t,多年来一直位居世界首位[1]。
海带的生活史由二倍体的孢子体和单倍体的配子体组成,孢子体和配子体交替出现,是典型的异型世代交替。方宗熙等[2]最早提出,通过分离雌、 雄单个配子体细胞,在连续光照条件下,可只进行营养生长长成丝状体,即无性繁殖系(也称配子体克隆系),这为海带配子体保种技术和配子体克隆育苗技术的发展奠定了基础。海带孢子体是人工栽培的对象,个体大,占生活史时间长。海带的配子体为微小的丝状体,是种质保存和人工培育苗种的对象[3]。20 世纪50 年代末以来,先后有20 余个优良品种(系)应用于生产,丰富了我国海带栽培产业对品种的要求,同时也带动了相关产业的发展。利用配子体克隆杂交进行海带新品种的培育可获得具有杂种优势杂交海带,也可作为自交纯化和定向选择的基础材料,“远杂10 号”、“901”海带[4, 5]、“荣福”海带[6]、“东方2 号”[7]、“东方3 号”[8]和“东方6 号”[9]海带都是利用配子体克隆杂交技术进行直接杂交或杂交后定向选育得到的海带品种。杂交海带培育是目前效率较高的一种海带遗传改良方法。
海带配子体克隆是海带种质资源的保存形式, 也是海带杂交育种育苗的材料。分离雌雄配子体进行海带的种质保存可以长期保持其优良性状和纯度。 对保存的配子体种质资源进行遗传多样性分析,了解不同品种(品系)间的亲缘关系和遗传关系,为海带杂种优势利用奠定基础,也为杂交育种选材提供参考。近年来,SSR、AFLP、RAPD 和ISSR 等分子标记技术均已用于海带的遗传多样性分析[10]。其中Li 等[11]利用微卫星标记进行了配子体克隆亲本遗传相似性与子代性状优势表现之间的关系分析, 建立了海带杂交优势预测体系,并在新品种培育中进行了应用。Zhang 等[12]利用RAD 技术对海带配子体克隆群体进行测序,并利用得到的4 994 个SNP 标记构建了海带的高密度遗传图谱,将海带配子体性别性状和SNP 基因型一起做连锁分析,将配子体性别性状定位在第二连锁群上。石媛嫄等[13]利用微卫星标记对海带和长海带配子体克隆遗传资源在进行杂交后的亲缘关系展开了分析和评价。Gu 等[14] 利用ISSR 技术对荣福和901 两个海带品种的配子体材料进行了遗传变异分析,并开发了一个性别鉴定标记。Wang 等[15]利用RAPD 技术建立了33 个海带配子体的指纹图谱。Wang 等[16]利用ISSR 技术对20 个海带配子体进行了遗传多样性分析。Shi 等[17] 利用ITS 序列和RAPD 技术对16 个海带配子体进行了遗传关系研究。Bi 等[18]利用RAPD 技术对采自北方海区(大连、烟台、威海和青岛)的不同海带孢子体群体进行了遗传变异性分析。
本研究利用RAPD 分子标记,对种质库中保存的我国海带栽培品种(品系)中选育出的海带种质进行遗传多样性分析,以期为海带种质评价奠定基础,并为海带配子体克隆新品种培育时亲本的选择提供指导,加快海带品种改良进程。
1 材料与方法 1.1 材料选取的36 个海带配子体材料分属于19 个海带品种(品系),同一品种的雌雄配子体分别以f、m 表示,这些配子体均从其品种(品系)培育完成时性状整齐、优势明显的当代孢子体中采集,保存在国家海藻与海参工程技术研究中心海藻种质库,亲本形态等信息详见表 1。
选取生长状态良好的海带配子体克隆,取0.1 g 湿重的材料,采用改进的CTAB 法提取配子体基因组DNA[19],用紫外分光光度计和琼脂糖凝胶电泳检测所提DNA 的浓度和纯度。不同样品的DNA 浓度统一稀释为40 ng/μL。-20℃保存备用。
1.2.2 RAPD 引物的选择和PCR 反应参数从候选的100 条引物中筛选出16 条能够获得清晰条带、重复性好的引物,筛选出的引物见表 2。
RAPD-PCR 反应总体积为该体系(20 μL)为: 1×PCR buffer,1.0 mmol/L Mg2+,0.2 mmol/L dNTPs,2.0 μmol/L 引物,40 ng 模板DNA,0.25 U Taq DNA 聚合酶(Promega)。
扩增PCR 程序为:95℃预变性5 min ;95℃变性30 s,37℃退火1 min,72℃延伸2 min,共40 个循环;最后72℃延伸10 min。取5 μL 扩增产物在1.5% 琼脂糖凝胶电泳检测。Tanon 2500 凝胶成像仪拍照记录电泳结果。
1.2.3 数据分析电泳图谱的每一条带为一个标记, 代表一个引物的结合位点。根据各个分子标记的迁移率及其有无来统计数据,若有条带出现记作1, 若无条带出现记作0。应用excel 建立各引物的0、1 数据库。各引物的条带多态性比例计算方法:多态位点比例P=(多态位点数/ 位点总数)×100%。用NTSYS2.10 软件计算遗传相似性系数,采用UPGMA 方法进行聚类分析。
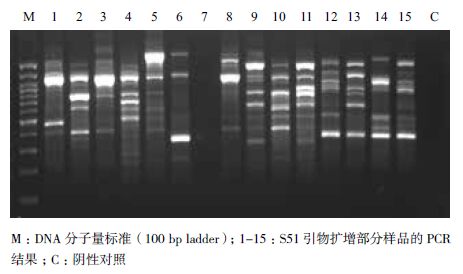
2 结果 2.1 DNA提取结果提取的海带配子体DNA 紫外分光光度计测定的A260/A280 比值在1.9 左右,浓度约为50-100 ng/μL, 琼脂糖电泳检测条带整齐,无降解和杂质污染(图 1),可满足实验需要。

|
| 图 1 部分样品的DNA 电泳图 |
|
| 图 2 琼脂糖凝胶电泳检测RAPD 标记 |
16 个RAPD 引物对36 个海带种质材料进行分析,共扩增得到362 条清晰、重复性高的条带,扩增片段大小都在200-3 700 bp 之间,其中360 条为多态条带,总的多态条带比率为99.4%,每条引物平均多态位点数为22.5(表 2)。
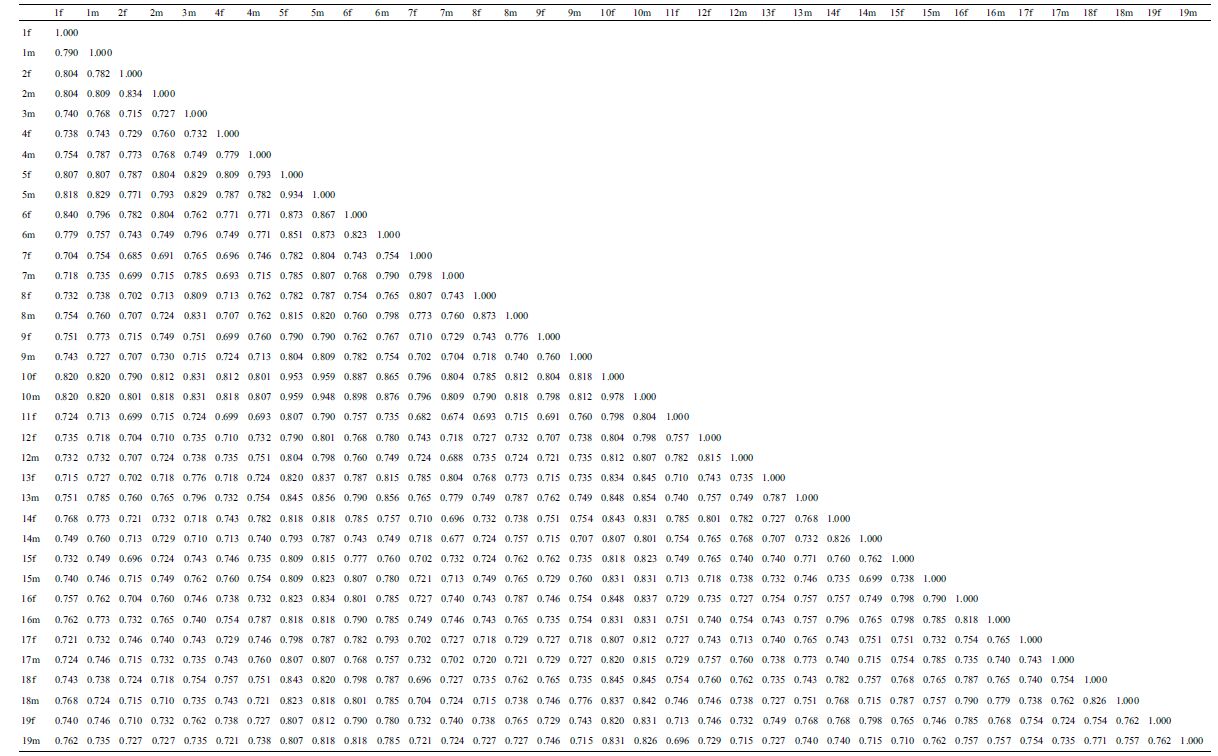
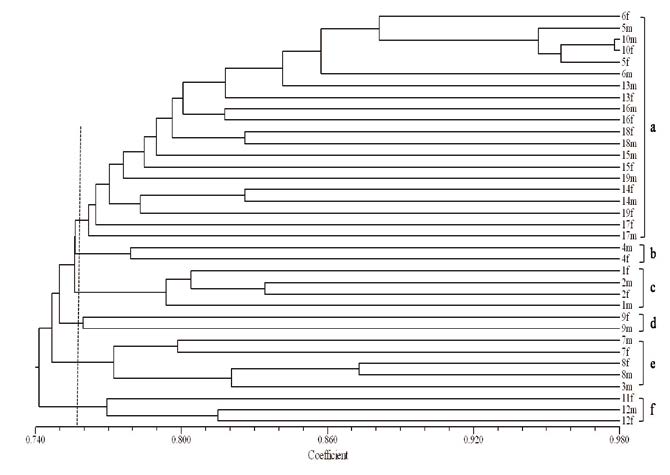
2.3 遗传多样性分析根据16 条RAPD 引物扩增所得结果计算海带种质间的遗传相似性系数,个体间的遗传相似性系数变化范围在0.682-0.978 之间,个体之间的亲缘关系较近,但也存在一定的差异,总体来看遗传多样性较高(表 3)。根据RAPD 标记数据计算材料间的遗传相似系数矩阵,采用UPGMA 法构建遗传关系聚类图(图 3),36 个种质资源被聚为若干个类群,其中每个类群又包括若干亚类。整体上分析,同一品种(品系)的雌雄配子体基本上都聚在较近位置, 在相似系数为0.756 时,主要分为6 个(a-f)类型, 其中a 类型包括的种质数目最多,有20 个,表明这20 个种质资源与其他16 个之间的亲缘关系差异较大。其中11f 与12m、12f 聚在f 分支上;同聚在e 分枝的3m 与8m、8f 亲缘关系最近;虽然9m 与9f 同聚在d 分枝上,但两者的遗传相似度仅为0.760。
|
| 图 3 36 个海带配子体的UPGMA 聚类图 |
聚类结果与种质采集的地理分布、长期人工栽培环境等因素具有一定的相关性,由于长期的人工栽培和环境的适应以及人为的干扰,引起某些自身遗传性状的改变,使得栽培品种的遗传差异逐渐变小;所以在育种过程中,若想进行优良品系的选育,要适当选择遗传差异较大的种质材料作为育种的亲本,将会获得较好的效果。
3 讨论RAPD、SSR、AFLP 和ISSR 等分子标记技术被广泛用于海藻种质资源评价、连锁图谱构建及遗传多样性分析等领域[20, 21, 22]。新型的分子标记SNP 虽然有数量上的优势,但目前若要大批量检测应用还存在技术和经费的限制;AFLP 标记对DNA 质量要求很高,且需要进行限制性内切酶切和检测体系都比较繁琐;SSR 分子标记检测体系稳定,而本实验在选择标记时也曾用过SSR 标记,但在所选品系间的多态性较低,不能较好地反映品系间的遗传多样性。而RAPD 标记具有很大的随机性,可以覆盖整个基因组,包括编码区和非编码区,可以反映整个基因组的变化,多态性高且操作步骤简便快速,只需要PCR 后用琼脂糖胶检测即可反映出结果。虽然RAPD 标记也存在不足之处,如稳定性和重复性较弱,对PCR 反应条件敏感等。但在本研究预实验时, 对RAPD 的反应条件进行了优化,且每个扩增反应均进行了3 次重复,在进行条件统计时选取清晰且具有重现性的条带,在较大程度上保证了结果的准确性。
近年来,RAPD 标记技术在陆地植物和藻类学研究中应用都较为广泛,常被用来进行种群的遗传变异分析和多样性评价。Desai 等[23]利用RAPD 技术对13 个不同基因型的竹子品系进行了遗传多样性分析;Ma 等[24]用RAPD 分子标记对黑麦属的18 个品种(系)进行了遗传关系分析;夏鹏等[25] 以“901”海带为材料进行了RAPD 体系的优化;周志刚等[26]应用同功酶和RAPD 技术对中国海区不同栽培品系及长海带的配子体进行了遗传多样性分析;He 等[27]利用RAPD 对海带资源进行了种质评价。诸多研究中虽然选用的实验材料不尽相同,但结果均显示海带资源具有较高的遗传多样性,可见RAPD 技术稳定性较好,可用于海带种质资源评价。
实验室种质库选取性状表现稳定的优良品系进行种质的采集和保存,将雌雄配子体分别保存,可长期保持其优良性状和纯度。本研究选取的这19 个海带品种(品系),有两个是野生海带品系(7m, 7f),1 个荣远缘-1(3m)和1 个利尻海带(11f), 因种质保存时间较长,部分种质材料因自身或外界环境原因导致荣远缘-1 和利尻的配子体只有单雌或单雄配子体。其余的15 个品系均为曾经或现在的主要海带栽培品系,选取的配子体均采自品种或品系育成时,性状表现整齐、稳定的株系。王秀良等[20] 用RAPD 的方法对海带配子体进行分析时发现大多数来源于同一品系的雌雄配子体均不能聚在一起, 其分析原因可能是不同品系之间尽管存在表型性状的差异,但仍属于同一种,遗传关系近,所以不同品系的雌雄配子体会聚在一起,另外,来源于同一品系,雌雄配子体是由游孢子萌发而来,在减数分裂的过程中有可能发生基因重组,导致同一品系的雌雄配子体不能聚在一起。但本实验中这种现象并不明显,分析结果时发现这19 个品系的遗传多样性较高,而且同一品系的雌雄配子体大多数都能聚在一起,只有少数几个品系的雌雄配子体不能完全聚在一起,但亲缘关系也比较近,如6f 和6m、1f 和1m,说明采集配子体的品系个体纯度较高,而且在保存的过程中配子体变异率很低。Wang 等[16]用ISSR 技术对10 对海带配子体进行遗传多样性分析, 发现同一品系的雌雄配子体基本聚在一支上,与本研究结果一致。
海带配子体作为种质资源的保存形式,也是杂交海带育种育苗的重要材料,分离雌雄配子体分别保存可以长期保持其优良性状和纯度,同时也在很大程度上避免了大田孢子体逐代选种和混采混育所导致的种质退化和混杂问题。本研究对种质库中保存的部分配子体进行遗传多样性分析,了解其不同品种(品系)间的亲缘关系,为海带配子体克隆新品种培育时亲本的选择提供指导,加快海带品种改良进程。
4 结论利用RAPD 分子标记技术对19 个海带品种(系)的36 个海带配子体进行了遗传多样性分析。 结果表明,可将36 个种质材料分为6 个大类,同一品系的雌雄配子体大部分能聚在一起,品系间遗传多样性较高。
| [1] | 农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京:中国农业出版社, 2014. |
| [2] | 曾呈奎, 王素娟, 刘思俭, 等. 海藻栽培学[M]. 上海:上海科学技术出版社, 1985 :55-121. |
| [3] | 方宗熙, 欧毓麟, 崔竞进, 等. 海带配子体无性繁殖系培育成功[J]. 科学通报, 1978, 2 :115-116. |
| [4] | 张全胜, 刘升平, 曲善村, 等“. 901”海带新品种培育的研究[J]. 海洋湖沼通报, 2001(2):46-53. |
| [5] | Zhang QS, Tang XX, Cong YZ, et al. Breeding of an elite Laminaria variety 90-1 through inter-specific gametophyte crossing[J]. Journal of Applied Phycology, 2007, 19 :303-311. |
| [6] | Zhang J, Liu Y, Yu D, et al. Study on high-temperature-resistant and high-yield Laminaria variety“ Rongfu”[J]. Journal of Applied Phycology, 2011, 23 :165-171. |
| [7] | Li XJ, Cong YZ, Yang GP, et al. Trait evaluation and trial cultivation of Dongfang No. 2, the hybrid of a male gametophyte clone of |
| [8] | Li XJ, Liu JL, Cong YZ, et al. Breeding and trial cultivatipn of Dongfang No. 3, a hybrid of Laminaria gametophyte clones with a more than intraspecific less than interspecific relationship[J]. |
| [9] | Li XJ, Zhang ZZ, Qu SC, et al. Breeding of an intraspecific kelp hybrid Dongfang no. 6(Saccharina japonica, Phaeophyceae, Laminariales)for suitable processing products and evaluation of its culture performance[J]. Journal of Applied Phycology, 2016, 28 (1):439-447. |
| [10] | 刘福利, 王飞久, 孙修涛, 等. 分子育种及其在海带育种中的研究进展[J]. 海洋科学, 2012, 36(9):128-134. |
| [11] | Li XJ, Yang GP, Shi YY, et al. Prediction of the heterosis of Laminaria hybrids with the genetic distance between their parental gametophyte clones[J]. Journal of Applied Phycology, 2008, 20 (6):1097-1102. |
| [12] | Zhang N, Zhang LN, Tao Y, et al. Construction of a high density SNP linkage map of kelp(Saccharina japonica)by sequencing Taq I site associated DNA and mapping of a sex determining locus[J]. BMC Genomics, 2015, 16 :189. |
| [13] | 石媛嫄, 杨官品, 廖梅杰, 等. 海带和长海带配子体无性繁殖系微卫星DNA 多态性比较分析[J]. 中国海洋大学学报, 2008, 38(1):303-308. |
| [14] | Gu JG, Sun YP, Liu Y. Sex identification and genetic variation of Saccharina(phaeophyta)gametophytes as revealed by intersimple sequence repeat(ISSR)markers[J]. Journal of Applied Phycology, 2014, 26(1):635-646. |
| [15] | Wang XL, Yang YX, Cong YZ, et al. DNA fingerprinting of selected Laminaria(Phaeophyta)gametophytes by RAPD markers[J]. Aquaculture, 2004, 238 :143-153. |
| [16] | Wang XL, Liu CL, Li XJ, et al. Assessment of genetic diversities of selected Laminaria(Laminariales, Phaeophyta)gametophytes by inter-simple sequence repeat analysis[J]. Journal of Integrative Plant Biology, 2005, 47(6):753-758. |
| [17] | Shi CJ, Hu ZM, He YJ, et al. Identification and assessing the cultivars of Laminaria Lamx.( Phaeophyceae)with molecular markers[J]. Journal of Integrative Plant Biology, 2005, 47(3): 283-291. |
| [18] | Bi YH, Hu YJ, Zhou ZG. Genetic variation of Laminaria japonica (Phaeophyta)populations in China as revealed by RAPD markers[J]. Acta Oceanologica Sinica, 2011, 30(2):103- 112. |
| [19] | 李言, 崔翠菊, 罗世菊, 等. 海带属配子体DNA 提取及ISSRPCR 体系优化[J]. 农学学报, 2014, 4(11):80-84. |
| [20] | 王秀良. RAPD 和ISSR 标记在海带种质及其遗传多样性研究中的应用[D]. 青岛:中国科学院海洋研究所, 2005. |
| [21] | 石媛嫄. 海带连锁图谱构建及东方2 号杂交海带亲缘关系分析[D]. 青岛:中国海洋大学, 2008. |
| [22] | 张全胜, 石媛嫄, 丛义周, 等. 我国引种海带和栽培品种(系)来源配子体克隆的AFLP 分析[J]. 中国海洋大学学报, 2008, 38(3):429-435. |
| [23] | Desai P, Gajera B, Mankad M, et al. Comparative assessment of genetic diversity among Indian bamboo genotypes using RAPD and ISSR markers[J]. Molecular Biology Reports, 2015, 42(8): 1265-1273. |
| [24] | Ma X, Gu XY, Chen TT, et al. Genetic relationships between Lolium (Poaceae)species revealed by RAPD markers[J]. Genetics and Molecular Research, 2013, 12(3):3246-3255. |
| [25] | 夏鹏, 杨迎霞, 刘升平, 等. 海带“901”配子体DNA 随机扩增反应条件的优化[J]. 海洋科学, 2003, 27(5):22-26. |
| [26] | 周志刚, 史西志, 胡远皆, 等. 中国海区不同养殖品系海带与长海带之间的遗传关系[J]. 中国水产科学, 2003, 10(6): 474-480. |
| [27] | He YJ, Zou YP, Wang XD, et al. Assessing the germplasm of Laminaria(Phaeophyceae)with random amplified polymorphic DNA(RAPD)method[J]. Chinese Journal of Oceanology and Limnology, 2003, 21(2):141-148. |