金属硫蛋白(Metallothioneins,MTs)是一类相对分子质量较低(约6-7 kD)、富含半胱氨酸残基、能与金属离子结合的胞质蛋白,在几乎所有真核生物以及一些原核生物中都有表达[1, 2]。从NCBI 中可以检索到1 013 个植物MTs 序列和类MTs 序列,它们在所有主要类群的维管植物中都存在,包括种子植物、裸子植物、蕨类植物和拟蕨类植物[3]。尽管它们的进化起源还未完全清楚[4],但它们的序列具有相同的特征。植物MTs 根据半胱氨酸残基位置和排列顺序的不同可以分为3 类,即Ⅰ 类、Ⅱ 类和Ⅲ类(Class Ⅰ,Ⅱ,Ⅲ)。Ⅰ 类MTs 含有两个小的富含半胱氨酸残基的结构域,中间被一个不含有半胱氨酸残基的间隔序列(大约30-40 个氨基酸)隔开,其中的Cys 按C-X-C、C-X-X-C 和C-C(X 为除半胱氨酸的其他氨基酸)的方式排列,根据蛋白序列中半胱氨酸残基位置与排列顺序的不同又可以分为4个亚型(Type 1-4)[5]。大部分植物MTs 都是Ⅰ 类MT。Type 2 型植物金属硫蛋白通常含有14 个半胱氨酸残基,主要在叶中表达[6]。
金属硫蛋白在清除自由基、金属离子的代谢与解毒等生命进程中发挥着重要作用[2, 7]。一些植物金属硫蛋白的表达可以被过氧化物、盐、干旱、冷、重金属等非生物胁迫所诱导表达[1, 8, 9, 10]。螯合金属离子是金属硫蛋白中巯基簇的主要功能[6],金属硫蛋白可以结合Zn2+、Cd2+、Hg2+、Cu2+、Pb2+ 等离子,并可参与维持金属离子的稳态[11]。有研究发现每种金属硫蛋白对某一种离子有较高的亲和性而对其他离子只有较低的亲和性[12]。在大肠杆菌、酵母以及其他植物中过表达Type 2 型金属硫蛋白可以增强其对金属离子的耐受性以及富集更多相应的金属离子。例如,在大肠杆菌中表达海茄苳(Avicenniamarina) 金属硫蛋白AmMT2 可以增强其对Zn2+、Cu2+、Pb2+ 和 Cd2+ 的耐受性,且对Cd2+ 有较高的亲和力[13]。木榄(Bruguiera gymnorrhiza)金属硫蛋白BgMT2 同样可以结合Zn2+、Cu2+、Pb2+ 和 Cd2+[14]。过表达芥菜(Brassica juncea)金属硫蛋白BjMT2 的大肠杆菌中显示出较强的拮抗Cu2+ 和 Cd2+ 胁迫的能力,而转BjMT2 的拟南芥若不外源添加Cu2+ 其根的生长将受到抑制[15]。同样,过表达天蓝遏蓝菜(Thlaspi caerulescens)金属硫蛋白TcMT2a 和TcMT3的拟南芥根的生长受到影响[16],这可能与金属硫蛋白参与必需金属元素的代谢相关。而转盐穗木(Arabidopsk thaliana)金属硫蛋白AtMT2b 烟草可以提高其对亚砷酸盐的敏感性以及根至芽中的迁移[17]。这些结果表明金属硫蛋白可能是以结合金属离子的形式参与植物体内金属离子的稳态以及运输。而且,不同植物中不同的金属硫蛋白对各种金属离子有不同的亲和力[18, 19]。每一种金属硫蛋白都能与多种金属离子结合,而每一亚型的金属硫蛋白的作用机理还不明确,因此研究每一个植物金属硫蛋白的功能对于更好地理解它们在植物中的作用有重要的意义。
本研究从盐穗木(Halostachys caspica)中分离鉴定一个Type 2 型金属硫蛋白基因(HcMT)并亚克隆至pGEX-6p-2 表达载体,原核表达并纯化融合蛋白GST-HcMT,以期检测其与金属离子的结合能力。
1 材料与方法 1.1 材料 1.1.1 质粒、菌株原核表达载体pGEX-6p-2 为新疆生物资源基因工程重点实验室保存,pMD18-T 载体购自TaKaRa 公司,菌株DH5α 和BL21(DE3)购自北京全式金生物技术有限公司。
1.1.2 主要试剂各种限制性内切酶、T4 DNA 连接酶、异丙基-β-D-硫代半乳糖苷(IPTG)以及DNA标准品购于TaKaRa 公司。Taq DNA 聚合酶、胶回收试剂盒和质粒提取试剂盒均购自天根生化科技有限公司。GST Bind Resin 和填料柱购自Novagen 公司。PVDF 膜购自Millipore 公司,显色试剂购自碧云天生物技术公司。引物合成及序列测定由上海生工生物工程股份有限公司完成。其他常用试剂均为分析纯。
1.2 方法 1.2.1 原核表达载体的构建根据盐穗木金属硫蛋白(HcMT)cDNA 基因(GenBank 登录号:HS586-469.1)序列设计了2 条引物:上游引物Pl :5'-CCGGAATTCCCATGTCTTGCTGTGGTGG-3',下游引物P2:5'-CCGCTCGAGTCATTTGCAGGTGCAAGGG-3',并分别在上、下游引物中插入EcoR Ⅰ 和Xho Ⅰ 酶切位点(下划线部分)。通过PCR 扩增、胶回收后连接到pMD18-T 载体上构成重组质粒pMD18-T-HcMT。质粒pMD18-T-HcMT 与pGEX-6p-2 分别用EcoR Ⅰ 和Xho Ⅰ 双酶切,将双酶切后的pGEX-6p-2 和HcMT 片段经T4 DNA 连接酶4℃连接过夜,连接产物转化大肠杆菌DH5α 感受态细胞,抗生素筛选,挑取阳性克隆进行菌液PCR 鉴定、测序鉴定。
1.2.2 SDS-PAGE 检测HcMT 的表达将测序正确的pGEX-6p-2-HcMT 质粒转化BL21(DE3)感受态细胞。阳性单克隆接种于5 mL 含50 mg/L Amp 的LB 培养基,37℃、220 r/min 过夜培养,按体积比1∶100 转接入50 mL LB(含Amp)新鲜培养基,相同条件下继续培养,当OD600 达到0.4-0.6 时,加IPTG 至终浓度为1 mmol/L,诱导表达4 h,收集2 mL 菌液离心,沉淀用100 μL 1×SDS 上样缓冲液彻底悬浮,煮沸15 min,15% SDS-PAGE 电泳分析表达结果。
1.2.3 融合蛋白的纯化及浓度测定12 000 r/min,10 min 离心收集大量诱导表达后的菌体,用4%(体积分数) 的冰冷1×GST 洗涤缓冲液(4.3 mmol/LNa2HPO4,1.47 mmol/L KH2PO4,0.137 mmol/L NaCl,2.7mmol/L KCl,pH7.3)重悬,超声破碎,离心收集上清液。取GST Bind Resin 填料装柱,使其自然沉降,用5 倍柱床体积的冰冷1×GST 洗涤缓冲液平衡,将收集的上清液逐滴加到柱子上,控制流速每小时10 倍柱床体积左右,然后用10 倍柱床体积的1×GST洗涤缓冲液洗涤柱子,5 倍柱体积的GST 洗脱缓冲液(50 mmol/L Tris-HCI,10 mmol/L Glutathione,pH8.0)洗脱目的蛋白,分别收集各阶段的流出液。15% SDS-PAGE 电泳分析,Brandford 法测定洗脱蛋白溶液的浓度。同时纯化原核表达的谷胱甘肽转移酶(GST)标签蛋白作为对照。
1.2.4 Western blot 鉴定将纯化的GST-HcMT 融合蛋白、GST 标签蛋白以及诱导表达后的重组菌裂解上清液和转空载体的BL21 裂解上清液进行SDSPAGE电泳,转膜(转移槽0.65 mA/cm 稳流2 h),用5% 脱脂奶粉4℃封闭过夜,加入用TBST(Tris缓冲盐- 吐温溶液,含10 mmol/L pH7.6 Tris-HCl,150 mmol/L NaCl,0.05% Tween-20)1∶5 000 稀释的鼠ANTI-GST 一抗,室温轻摇2 h,TBST 洗膜3 次,每次5 min ;加入用TBST 1∶10 000 稀释的羊抗鼠IgG,室温轻摇2 h,TBST 洗膜3 次,每次5 min ;BeyoECL 显色液显色,观察PVDF 膜上的显色条带。1.2.5 GST-HcMT 与金属离子的结合能力检测[13, 14]为了研究HcMT 结合金属离子的能力,分别将含有pGEX-6p-2 和pGEX-6p-2-HcMT 质粒的大肠杆菌E.coli(BL21)过夜培养物以1∶100 转接入50 mL LB(含Amp)新鲜培养基。当OD600 达到0.4-0.6 时,加入终浓度0.4 mmol/L 的IPTG,与此同时向其中添加终浓度分别为200 μmol/L Al3+、200 μmol/L Cu2+、200 μmol/L Mg2+、200 μmol/L Zn2+、100 μmol/L Cd2+、100 μmol/L Mn2+、20 μmol/L Pb2+ 和2 μmol/L Hg2+ 金属离子混合物,37℃过夜诱导。按1.2.4 所述方法分离纯化得到GST-HcMT,以GST 标签蛋白作为对照。将蛋白样品硝化溶解于15% 稀硝酸中,采用原子分光光度法(Atomic Absorption Spectrometry,AAS)测定各金属离子含量。为了测定其结合Pb2+、Zn2+、Cd2+ 的能力,在加入IPTG 的同时单独分别向培养基中加入终浓度为300 μmol/L Pb2+、400 μmol/L Zn2+ 或200 μmol/L Cd2+,离心洗涤菌体后,按如上方法分离纯化蛋白,然后测定各金属离子含量。每个样品重复3 次,数据用Graph Pad Prism 5 进行分析。
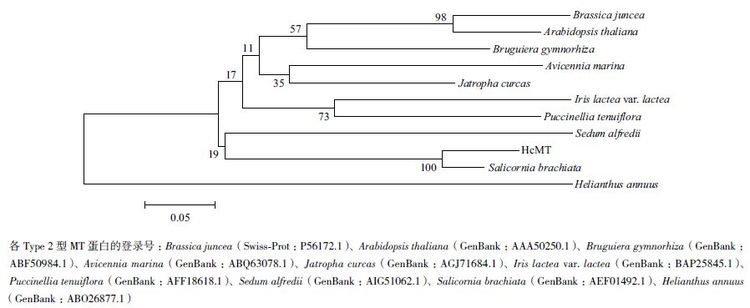
2 结果 2.1 HcMT序列分析将HcMT 序列与其他一些Type 2 型金属硫蛋白序列比对(图 1)显示,它们都具有相似的典型的结构特征。通过MEGA 4.0 系统进化树分析(图 2)显示,其与海蓬子(Salicornia brachiata)进化起源更近。

|
| 图 1 HcMT 与其他Type 2 型金属硫蛋白的序列比对 |
|
| 图 2 HcMT 与其他Type 2 型金属硫蛋白的系统进化树分析 |
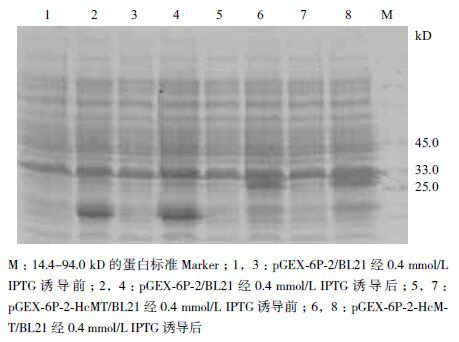
将鉴定正确的pGEX-6p-2-HcMT、pGEX-6p-2 转入菌液并分别诱导表达,结果(图 3)显示,前者诱导后能够表达出大小33 kD 左右的蛋白条带,而后者只在26 kD 处有一蛋白条带,与预期大小一致。
|
| 图 3 SDS-PAGE 检测GST-HcMT 表达情况 |
用GST 亲和层析柱纯化后的蛋白洗脱液,经SDS-PAGE(图 4)分析后发现皆可得到纯度相对较高的目的蛋白。然后将纯化后的蛋白进行Westernblot 鉴定,结果(图 5)表明在34 kD 位置出现了一条明显的条带,与SDS-PAGE 中GST-HcMT 融合蛋白的位置相符。
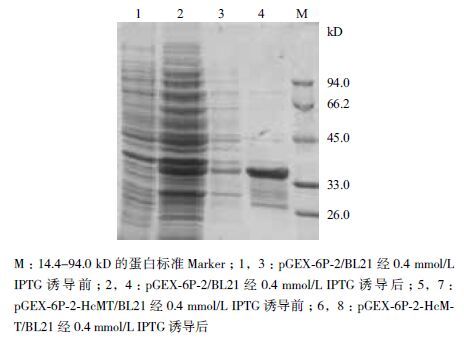
|
| 图 4 SDS-PAGE 鉴定纯化的GST-HcMT |

|
| 图 5 Western blot 鉴定纯化后的GST-HcMT |
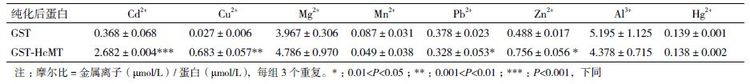
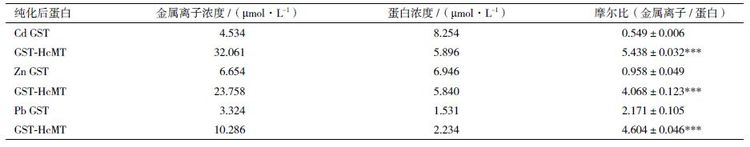
在诱导过程中,向培养基中外源添加各种金属离子之后分离纯化融合蛋白,运用AAS 测得各离子的量如表 1 所示。与对照组GST 相比,融合蛋白GST-HcMT 能够结合更多的Cd2+、Cu2+、Zn2+,对Mg2+、Mn2+、Al3+ 和Hg2+ 没有显著性差异,而对Pb2+的结合量显著性比对照小。Pb2+ 的结合量显著性下降引起了我们的兴趣,因此选择在混合添加过程中差异极显著的代表Cd2+、差异显著的代表Zn2+ 以及Pb2+ 进行分别单独在诱导过程中向培养基中添加实验。采用相同的方法测结合金属离子的含量,结果(表 2)显示,每摩尔GST 对照能够结合Cd2+、Zn2+、Pb2+这3 种离子的摩尔数分别为0.549、0.958 和2.171,而每摩尔融合蛋白GST-HcMT 能够结合Cd2+、Zn2+和Pb2+ 这3 种离子的摩尔数分别为5.438、4.068、4.604,基本上分别是对照的10 倍、4 倍和2 倍。
植物金属硫蛋白是一类在大多数的器官中表达的低分子量多肽,通常认为其主要的作用是重金属的解毒与维持必需金属离子的稳态。而作为金属离子螯合剂,它们同样在不同的生理进程中发挥作用,包括清除ROS、响应各种逆境胁迫、调节植物的生长等[15, 20, 21]。但植物金属硫蛋白的功能机制,尤其是在金属与自由基胁迫下的生物学功能,仍有待于进一步的阐明。
由于金属硫蛋白中丰富的半胱氨酸极不稳定且常不以单体的形式存在,很难检测其在体内的表达活性[22]。用于纯化的GST 标签蛋白为研究小分子蛋白质提供了解决方法,同时由于GST 标签蛋白可以抑制MTs 特别是其铰链区在大肠杆菌中被蛋白水解酶降解[6, 23],因而本研究选用含GST 标签的融合蛋白来研究HcMT 结合金属离子的能力。结果显示与GST 相比,GST-HcMT 融合蛋白具有较强的结合金属离子的能力,如Zn2+、Cu2+ 和Cd2+,提示一些金属离子优先与GST-HcMT 融合蛋白中的HcMT 结合。铜离子与锌离子是两种必需的参与氧化还原的金属离子,当过量时有潜在的毒性。植物需要从环境中获得Zn2+ 和Cu2+,所以它们需要调节这两种金属离子在细胞与组织间的上调、存储、分布与排出。锌与铜的缺失或过量都会影响植物的生长[24, 25]。锌与铜是必须金属元素中与金属硫蛋白结合量最大的两种,而且它们与植物金属硫蛋白的结合也被广泛研究[10]。HcMT 既能与Zn2+ 也能与Cu2+ 结合,而且与Zn2+ 的结合量更高,但GST-HcMT 与GST 的摩尔比之比显示HcMT 对Cu2+ 的选择性结合可能更好一些。一些研究表明尽管植物金属硫蛋白对金属离子的亲和力不同,但其表达以及与金属离子的结合能力在维持植物体金属耐受性和金属离子稳态发挥着重要作用。其他重金属离子更多的是对植物体造成氧化胁迫,如Cd2+ 等[14],而植物金属硫蛋白是其ROS 清除系统中重要的一部分,本实验显示出的金属硫蛋白与重金属离子的结合能力使重金属在体内累积以解除其毒害,可以看出这也是植物应对重金属胁迫的一种方式。而在表 1 中融合蛋白GSTHcMT相比于对照GST 结合量较少的Pb2+ 通过单独添加测得数据的表 2 中可以看出,融合蛋白GSTHcMT还是可以选择性结合Pb2+ 的,产生表 1 相反的结果一方面可能是由于混合添加时Pb2+ 加入量较少,另一方面可能是由于混合添加时其他金属离子的干扰造成的。AAS 法在进行多元素测定时确实存在准确度与精密度较差的缺陷[26, 27]。而在单独添加Cd2+、Zn2+ 时,融合蛋白GST-HcMT 和对照蛋白GST与混合添加相比结合金属离子的含量都显著性提高,但融合蛋白GST-HcMT 与对照蛋白GST 相比每摩尔结合的金属离子的量都极显著的提高,这一结果与混合添加时相一致。综合表 1 与表 2 结果可以看出,HcMT 结合金属离子的能力Cu2+>Cd2+>Zn2+>Pb2+。这些结果与其他一些2 型金属硫蛋白[28, 29, 30, 31]的结果相似,植物金属硫蛋白可以与多种金属离子结合,无论是一价离子[32]、二价离子还是更高价离子,而且其亲和力也存在一定区别,推测可能与其生长环境等有一定的关系。
4 结论本研究成功表达融合蛋白GST-HcMT,并得到Western blot 验证,又通过原子吸收分光光度法得出其可以结合Cu2+、Cd2+、Zn2+ 和Pb2+,且表现出不同的结合能力,这与以前报道这一类金属硫蛋白的结果相吻合。
| [1] | Jin S, Cheng Y, Guan Q, et al. A metallothionein-like protein of rice (rgMT)functions in E. coli and its gene expression is induced by abiotic stresses[J]. Biotechnol Lett, 2006, 28(21):1749-1753. |
| [2] | Hassinen VH, Tervahauta AI, Schat H, et al. Plant metallothioneinsmetal chelators with ROS scavenging activity?[J]. Plant Biology, 2011, 13(2):225-232. |
| [3] | Leszczyszyn OI, Imam HT, Blindauer CA. Diversity and distribution of plant metallothioneins :a review of structure, properties and functions[J]. Metallomics, 2013, 5(9):1146-1169. |
| [4] | Capdevila M. Metallothionein protein evolution :a miniassay[J]. J Biol Inorg Chem, 2011, 16(7):977-989. |
| [5] | Usha B, Venkataraman G, Parida A. Heavy metal and abiotic stress inducible metallothionein isoforms from Prosopis juliflora(SW)D. C. show differences in binding to heavy metals in vitro[J]. Mol Genet Genomics, 2009, 281(1):99-108. |
| [6] | Freisinger E. Structural features specific to plant metallothioneins [J]. J Biol Inorg Chem, 2011, 16(7):1035-1045. |
| [7] | Grennan AK . Metallothioneins, a diverse protein family[J]. Plant Physiol, 2011 :155. |
| [8] | Mir G. A plant type 2 metallothionein(MT)from cork tissue responds to oxidative stress[J]. J Eep Bot, 2005, 55(408): 2483-2493. |
| [9] | Shunsaku N, Liu S, Tetsuo T. Isolation and characterization of a metallothionein-1 protein in Chloris virgata Swartz that enhances stress tolerances to oxidative, salinity and carbonate stress in Saccharomyces cerevisiae[J]. Biotechnol Lett, 2007, 29(8):1301- 1305. |
| [10] | Yang Z, Wu Y, Li Y, et al. OsMT1a, a type 1 metallothionein, plays the pivotal role in zinc homeostasis and drought tolerance in rice [J]. Plant Mol Biol, 2009, 70(1-2):219-229. |
| [11] | Yang J, Wang Y, Liu G, et al. Tamarix hispida metallothionein-like ThMT3, a reactive oxygen species scavenger, increases tolerance against Cd2+, Zn2+, Cu2+, and NaCl in transgenic yeast[J]. Mol Biol Rep, 2011, 38(3):1567-1574. |
| [12] | Foley RC, Liang ZM, Singh KB. Analysis of type 1 metallothionein cDNAs in Vicia faba[J]. Plant Mol Biol, 1997, 33(4):583- 591. |
| [13] | Huang GY, Wang YS. Expression and characterization analysis of type 2 metallothionein from grey mangrove species(Avicennia marina)in response to metal stress[J]. Aquat Toxicol, 2010, 99 (1):86-92. |
| [14] | Huang GY, Wang YS, Ying GG. Cadmium-inducible BgMT2, a type 2 metallothionein gene from mangrove species(Bruguiera gymnorrhiza), its encoding protein shows metal-binding ability[J]. J Exp Mar Biol Ecol, 2011, 405(1-2):128-132. |
| [15] | An ZG, Li CJ, Zu YG, et al. Expression of BjMT2, a metallothionein 2 from Brassica juncea, increases copper and cadmium tolerance in Escherichia coli and Arabidopsis thaliana, but inhibits root elongation in Arabidopsis thaliana seedlings[J]. J Exp Bot, 2006, 57(14):3575-3582. |
| [16] | Hassinen VH, Tuomainen M, Peräniemi S, et al. Metallothioneins 2 and 3 contribute to the metal-adapted phenotype but are not directly linked to Zn accumulation in the metal hyper accumulator, Thlaspi caerulescens[J]. J Exp Bot, 2009, 60(1):187-196. |
| [17] | Veerle MJG, Barbara I, Henk WJH, et al. Expression of the Arabidopsis metallothionein 2b enhances arsenite sensitivity and root to shoot translocation in tobacco[J]. Environ Exp Bot, 2009, 66(1):69-73. |
| [18] | Young OA, Sun HK, Jeongyeo L, et al. Three Brassica rapa metallothionein genes are differentially regulated under various stress conditions[J]. Mol Biol Rep, 2012, 39(3):2059-2067. |
| [19] | Sereno ML, Almeida RS, Nishimura DS, et al. Response of sugarcane to increasing concentrations of copper and cadmium and expression of metallothionein genes[J]. J Plant Physiol, 2007, 164(11):1499-1515. |
| [20] | Yuan J. Characteristic and expression analysis of a metallothionein gene, OsMT2b, down-regulated by cytokinin suggests functions in root development and seed embryo germination of rice[J]. Plant Physiol, 2008, 146(4):1637-1650. |
| [21] | Xue T, Li X, Zhu W, et al. Cotton metallothionein GhMT3a, a reactive oxygen species scavenger, increased tolerance against abiotic stress in transgenic tobacco and yeast[J]. J Exp Bot, 2009, 60(1):339-349. |
| [22] | Murphy A. Purification and Immunological Identification of Metallothioneins 1 and 2 from Arabidopsis thaliana[J]. Plant Physiol, 1997, 113(4):1293-1301. |
| [23] | Abdullah SNA, Cheah S, Murphy DJ. Isolation and characterisation of two divergent type 3 metallothioneins from oil palm, Elaeis guineensis[J]. Plant Physiol Biochem, 2002, 40(3):255-263. |
| [24] | Mosleh YY, Paris-Palacios S, Biagianti-Risbourg S. Metallothioneins induction and antioxidative response in aquatic worms Tubifex tubifex(Oligochaeta, Tubificidae)exposed to copper[J]. Chemosphere, 2006, 64(1):121-128. |
| [25] | Znidarsic N, Tusek-Znidaric M, Falnoga I, et al. Metallothioneinlike proteins and zinc-copper interaction in the hindgut of Porcellio scaber(Crustacea :Isopoda)exposed to zinc[J]. Biol Trace Elem Res, 2005, 106(3):253-264. |
| [26] | 黄开胜, 李思源, 何小青, 等. ICP-AES 法和AAS 法测定涂料中多种元素的比较研究[J]. 中国涂料, 2010, 25(2):49- 51. |
| [27] | 黄开胜, 李思源, 何小青, 等. 电感耦合等离子发射光谱(ICPAES) 和原子吸收光谱(AAS)测定涂料中多种元素的比较研究[J]. 现代涂料与涂装, 2010, 13(1):38-40. |
| [28] | Zhang J, Zhang M, Tian S, et al. Metallothionein 2(SaMT2) from Sedum alfredii hance confers increased Cd tolerance and accumulation in yeast and tobacco[J]. PLoS One, 2014, 9(7): e102750. |
| [29] | Gu CS, Liu LQ, Zhao YH, et al. Overexpression of Iris. lactea var. chinensis metallothionein llMT2a enhances cadmium tolerance in Arabidopsis thaliana[J]. Ecotox Environ Safe, 2014, 105 :22- 28. |
| [30] | Tomas M, Pagani MA, Andreo CS, et al. Sunflower metallothionein family characterisation. Study of the Zn(Ⅱ)- and Cd(Ⅱ)- binding abilities of the HaMT1 and HaMT2 isoforms[J]. J Inorg Biochem, 2015 :148 :35-48. |
| [31] | Mudalkar S, Golla R, Sengupta D, et al. Molecular cloning and characterisation of metallothionein type 2a gene from Jatropha curcas L. , a promising biofuel plant[J]. Mol Biol Rep, 2014, 41 (1):113-124. |
| [32] | Zhang M, Takano T, Liu S, et al. Abiotic stress response in yeast and metal-binding ability of a type 2 metallothionein-like protein (PutMT2)from Puccinellia tenuiflora[J]. Molecular Biology Reports, 2014, 41(9):5839-5849. |