2. 公安部物证鉴定中心,北京 100741
2. Institute of Forensic Science,Ministry of Public Security of P. R. China,Beijing 100741
谷胱甘肽过氧化物酶(Glutathione peroxidases,GPXs)是维持细胞内H2O2 稳态的关键酶[1],它通过催化还原型谷胱甘肽(Glutathione,GSH)与H2O2 反应生成氧化型谷胱甘肽(GSSG)及水,从而阻止羟基自由基(·OH)的产生,避免由其引发的质膜过氧化,进而保护细胞膜结构和功能的完整性[2]。 由多个成员组成的GPXs 广泛存在于动物和植物中,目前已发现植物体GPXs 为诱导型表达,在不同胁迫条件下,编码GPXs 基因的mRNA 呈现不同水平的表达,GPXs 在植物抗氧化过程中可能具有重要作用[3, 4],因此关于植物中GPXs 的相关研究备受关注,包括GPXs 家族成员的获得、结构特征的阐释,以及应答胁迫的表达模式和亚细胞定位等[5, 6, 7]。
盐芥(Thellungiella salsuginea)是模式植物拟南芥的近缘物种,与拟南芥具有相似的生物学特征[8],且二者的cDNA 序列同源性高达90%-95%[9, 10],但属于盐生植物的盐芥却能够在含有500 mmol/L NaCl 的高盐环境或 -15℃的低温条件下生存[11],具有强耐逆性。此外由于盐芥具有模式植物的生物学特性,因此被作为耐盐性研究的模式植物[12, 13]。研究表明,拟南芥中AtGPXs 由8 个成员组成,其中AtGPX3 不仅可以作为氧化信号传感器,还能在干旱胁迫下清除植物体内多余的脱落酸(Abscisic acid,ABA),响应ABA 和干旱胁迫,这种双重机制在其他植物中也具有相似性[14]。本实验室前期对盐芥TsGPXs 家族的8 个成员进行了研究,皆具有3 个典型的GPXs 特征结构域,同时在应答不同胁迫时表达模式不同。 在8 个TsGPXs 成员中,只有TsGPX3 具有跨膜结构域,属于分泌蛋白,亚细胞定位预测分析显示可能定位在内质网或质膜上[7]。本研究通过构建植物表达载体、利用PEG 介导拟南芥原生质体的瞬时表达进行TsGPX3 亚细胞定位研究;构建原核表达载体,对蛋白表达条件进行初步研究,旨在为进一步研究 TsGPX3 与盐芥抗逆性关系及植物GPXs 的功能研究提供依据。
1 材料与方法 1.1 材料盐芥山东生态型种子为本实验室保存。Trizol 试剂购自Invitrogen 公司,反转录酶M-MLV、pGEM-T 载体、pET28a、限制性内切酶Nde I 和Sal I 购自 Promega 公司,大肠杆菌(Escherchia coli)DH5α 和 BL21(DE3)购自北京博迈德科技发展有限公司,pRTL2 表达载体由北京师范大学惠赠,限制性内切酶Xho I 和Xba I 购自Fermentase 公司,ECL 试剂盒购自天根生化科技(北京)有限公司,考马斯亮蓝R-250 购自北京百泰克生物技术有限公司,PVDF 膜购自Millipore 公司,辣根过氧化酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG 购自北京中杉金桥生物技术有限公司,根据盐芥TsGPXs 蛋白序列设计的盐芥TsGPX 特异抗体(TsGPX-A)由北京华大蛋白质研发中心制备。
1.2 方法 1.2.1 材料准备室内培养盐芥实生苗,培养基质为营养土∶蛭石= 3∶1 的混合土,培养条件为光周期16 h/d,光照强度93 μmol/(m2·s),相对湿度 60%/80%( 昼/ 夜),温度为23℃/18℃( 昼/ 夜),用Hoagland 营养液浇灌。生长8 周后,以Hoagland 营养液配制300 mmol/L NaCl 溶液,采用根灌法处理盐芥幼苗12 h 后取样,迅速冻于液氮中,保存于-80℃,用于总RNA 的提取。
1.2.2 盐芥总RNA 的提取与盐芥TsGPX3 基因全长的获得采用Trizol 法提取盐芥总RNA。以盐芥总 RNA 为模板,用M-MLV 反转录酶合成cDNA,操作步骤按说明书进行。
根据本实验室前期获得的TsGPX3 基因序列设计引物,引物序列为F1 :5'-TGTCGATGCCTAAATCAAGC- 3'/ R1 :5'-GAAAATGAGATTCACACTGGTACTC- 3'。以反转录得到的cDNA 为模板进行PCR 扩增,扩增条件为:95℃预变性3 min ;95℃变性30 s,54℃退火50 s,72℃延伸50 s,共30 个循环;72℃ 延伸7 min。PCR 扩增产物经1% 琼脂糖凝胶电泳检测后回收目的条带,回收产物与pGEM-T 载体连接,转化E.coli DH5α 感受态细胞,并送至北京华大基因公司进行测序。
1.2.3 盐芥TsGPX3 系统进化分析在NCBI 搜索与 TsGPX3 同源性较高的16 种植物GPX3 序列,采用 MEGA 5.0 进行系统进化分析。
1.2.4 盐芥TsGPX3 的亚细胞定位对TsGPX3 基因序列和含有绿色荧光蛋白(Green fluorescence protein,GFP)的植物表达载体pRTL2-GFP 进行酶切图谱分析,设计含酶切位点的引物F2 :5'-CCGCT CGAGCGATGCCTAAATCAAGCACTTGG-3'( 下划线部分为Xho I 的酶切位点)/ R2 :5'-GCTCTAGATCA AGCAGATGCCAATAGCTTC-3'(下划线部分为Xba I 的酶切位点)。利用限制性内切酶Xho I 和Xba I 将 TsGPX3 构建入pRTL2 的C 端GFP 载体中,获得重组质粒pRTL2-TsGPX3-GFP,转化至E.coli DH5α 中,菌液PCR 鉴定与测序验证。
制备拟南芥叶片细胞的原生质体,将鉴定正确的重组质粒pRTL2-TsGPX3-GFP 和空载体pRTL-GFP分别以PEG 介导转化拟南芥原生质体,用激光共聚焦显微镜观察GFP 标签的表达。
1.2.5 盐芥TsGPX3 的原核表达设计含有酶切位点的引物F3 :5'-GGGAATTCCATATGCGATGCCTAAATCAAGCACTTGG- 3'(下划线部分为Nde I 酶切位点)/ R3 :5'-ACGCGTCGACTCAAGCAGATGCCAATAGCTTC- 3'(下划线部分为Sal I 的酶切位点)。利用限制性内切酶Nde I 和Sal I 将 TsGPX3 构建入 pET28a 载体中,获得重组质粒pET-TsGPX3。将重组质粒pET-TsGPX3 和pET28a 空载体分别转化至 E.coli BL21(DE3)中,筛选阳性克隆进行酶切与测序验证。
分别将含有重组质粒pET-TsGPX3 和空载体 pET28a 的E.coli BL21(DE3) 接种于含氨苄青霉素(Ampicillin,Amp)的10 mL LB 液体培养基,于 37℃条件下振荡培养。在菌液到达对数期(OD600 为 0.8 左右)时加入终浓度为1 mmol/L 异丙基硫代半乳糖苷(IPTG)进行诱导。分别取1 mL 菌液,在 37℃下分别培养1、2、3、4 和5 h,以确定最佳表达时间。分别取1 mL 菌液,在16℃、28℃和37℃ 分别培养5 h 时,以确定最佳表达温度。分别收集上述条件下所得菌体。每个样品取5 μL 进行SDSPAGE 电泳,考马斯亮蓝R-250 染色,检测融合蛋白的表达情况。
1.2.6 诱导表达融合蛋白的Western blotting 检测SDS-PAGE 电泳后,将未进行染色的凝胶转硝酸纤维素膜( 转膜15 V,30 min),加入5% 脱脂奶封闭液,于 100 r/min 的摇床上室温封闭30 min。 加入一抗(TsGPX-A 抗体),于100 r/min 的摇床上 37℃孵育1 h,用TBST 洗3 遍,5 min/ 次。加入二抗(HRP 标记的山羊抗小鼠IgG),于100 r/min 的摇床上37℃孵育1 h,用TBST 洗3 遍,5 min/ 次。 用ECL 试剂盒进行显色,将试剂盒A、B 液1∶1 混合配成2 mL 溶液,室温孵育PVDF 膜1 min,用凝胶成像系统观察。
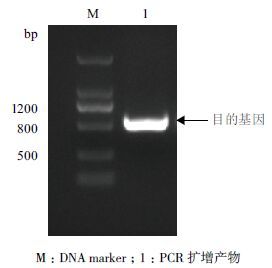
2 结果 2.1 盐芥TsGPX3基因的扩增与系统进化分析以引物序列F1/R1 扩增TsGPX3 的全长cDNA 序列,大小为776 bp,其中6-596 bp 为开放阅读框(ORF),编码196 个氨基酸(图 1)。TsGPX3 蛋白的理论相对分子量为23.258 kD,理论等电点为7.33。 TsGPX3 具有植物GPX 蛋白活性中心的3 个保守Cys (C)残基以及3 个保守特征结构域(催化结构域 NVASKCG、标志性基序ILAFPCNQF 和PHGPX 的特征基序KWNFAKFL),且3 个保守结构域中各含有1 个催化氨基酸残基,即C、Q 和W(图 2)。
|
| 图 1 盐芥TsGPX3 基因全长cDNA 的PCR 扩增产物 |

|
| 图 2 TsGPX3 的核苷酸及推测的氨基酸序列 |
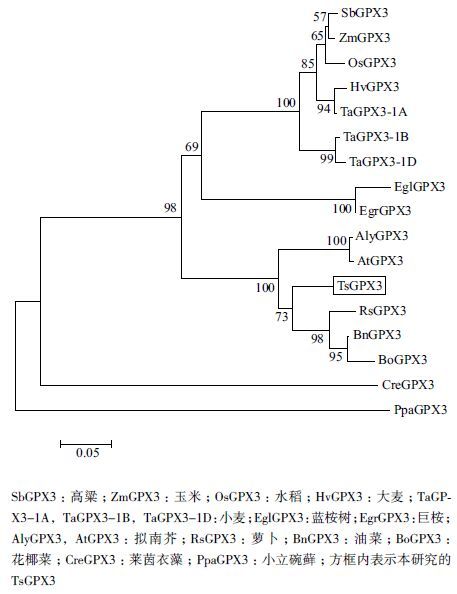
为了研究TsGPX3 的进化关系,采用MEGA 5.0 对TsGPX3 及与TsGPX3 同源性较高的16 种植物 GPX3 序列进行系统进化树分析,结果(图 3)显示,盐芥TsGPX3 与同属于十字花科的萝卜(Raphanus sativus)RsGPX3、油菜(Brassica napus)BnGPX3、 花椰菜(Brassica oleracea)BoGPX3、拟南芥(Arabidopsis lyrata)AlyGPX3 和拟南芥(A. thaliana)At- GPX3 同源性较高,聚为一类。与非十字花科的高粱 (Sorghum bicolor)SbGPX3、玉米(Zea mays)ZmGPX3 、水稻(Oryza sativa)OsGPX3、大麦(Hordeum vulgare)HvGPX3、蓝桉树(Eucalyptus globulus)EglGPX3 、巨桉(Eucalyptus grandis)EgrGPX3 以及小麦(Triticum aestivum)TaGPX3-1A、TaGPX3-1B、Ta- GPX3-1D 的同源性较低。另外,研究发现,上述物种与莱茵衣藻(Chlamydomonas reinhardtii)CreGPX3 和小立碗藓(Physcomitrella patens)PpaGPX3 的同源关系均较远。
|
| 图 3 盐芥TsGPX3 及其他植物GPX3 序列的系统进化分析 |
将pRTL2 空载体和经过鉴定的pRTL2-TsGPX3- GFP 载体以PEG 介导分别转化拟南芥原生质体,结果见图 4。pRTL2 空载体亚细胞定位结果(图 4-A) 显示,GFP 荧光蛋白在细胞的各个部位都有表达,显示清晰的GFP 绿色荧光信号。pRTL2- TsGPX3-GFP 载体亚细胞定位结果(图 4-B)显示,TsGPX3∷GFP 融合蛋白仅在细胞膜位置产生荧光,由此推测TsGPX3 基因所编码的蛋白主要定位在细胞膜上,与生物信息学预测结果基本一致。

|
| 图 4 空载体(A)及盐芥TsGPX3(B)亚细胞定位结果 |
以未被IPTG 诱导的pET28a 空载体为对照,将经过鉴定的含有重组质粒pET-TsGPX3 的E.coli BL21 (DE3) 在IPTG 诱导下表达1、2、3、4 和5 h 后进行SDS-PAGE 电泳,结果(图 5-A)显示,含有 pET-TsGPX3 表达载体的E.coli BL21(DE3)在不同诱导条件下、在27 kD 附近都出现1 条新的特异条带,与TsGPX3 预测大小基本一致,pET28a 空载体没有特异蛋白表达。在5 个诱导时间(1、2、3、4 和5 h) 处理中,TsGPX3 融合蛋白的表达呈逐渐上升趋势,在5 h 达到最高;在3 个处理温度(16℃、28℃和 37℃)下表达5 h,TsGPX3 融合蛋白的表达量逐渐增加,在37℃时达到最高。采用Western blotting 对诱导表达的融合蛋白进行验证,诱导表达的融合蛋白能够与抗体发生特异反应,证明表达产物为目的蛋白(图 5-B)。

|
| 图 5 pET-TsGPX3 在E.coli BL21(DE3)中表达的SDSPAGE检测(A)和Western blotting 鉴定(B) |
作为生物体抗氧化酶防御体系的关键酶之一,谷胱甘肽过氧化物酶(GPXs)通过多种信号途径在植物响应逆境中发挥重要作用[15]。本研究获得的盐芥TsGPX3 基因所编码的蛋白含有植物GPXs 蛋白活性中心的3 个保守Cys(C)残基以及植物GPXs 的3 个保守特征结构域,且在3 个保守结构域中均具有3 个GPXs 催化残基Cys70(C)、Gln101(Q)和 Trp159(W),说明本研究获得的TsGPX3 属于植物 GPXs 家族。与其他植物GPX3 进行系统进化分析结果显示,TsGPX3 与同属于十字花科物种的GPX3 亲缘关系最近,而与非十字花科物种的GPX3 亲缘关系较远,说明在进化过程中,不同科属植物物种的GPX3 序列发生了一定的变化。
植物GPXs 家族有多个成员,不同成员的亚细胞定位与其行使的生物学功能相关。采用PSORT 在线分析软件进行盐芥TsGPXs 8 个成员的亚细胞定位分析结果显示,TsGPX1 和TsGPX7 定位在叶绿体中,TsGPX2、TsGPX4、TsGPX5 和TsGPX8 定位在细胞质溶质中,TsGPX6 定位在线粒体中,而TsGPX3 定位在细胞膜和内质网膜上,且具有信号肽[7]。构建亚细胞定位载体进行亚细胞定位研究表明,盐芥 TsGPX6 主要定位在线粒体和内体中[16]。本研究通过亚细胞定位研究显示TsGPX3 定位于细胞膜上,与预测基本相符。由于膜上分布众多的载体蛋白、 与细胞活动相关的离子泵、通道蛋白和蛋白受体等,因此推测TsGPX3 对细胞质膜的稳定或控制蛋白转运具有一定的作用[17]。已有研究显示拟南芥[14]、 杨树[5]和百脉根[6]GPX3 定位在细胞质中,而盐芥 TsGPX3 与其不同,主要定位在细胞膜上,其不同物种的GPX3 亚细胞定位差异可能与抗逆功能有关,有待进一步探究。
大肠杆菌表达系统是目前应用最为广泛的原核表达系统[18],但融合蛋白在该系统中的表达结果可受多种因素影响,如诱导温度、诱导剂的浓度、 诱导时间等。已有研究显示TsGPX8 的原核表达融合蛋白大小约为23 kD,最佳表达条件为37℃,诱导培养5 h[19]。本研究构建了TsGPX3 的原核表达载体并进行了原核表达蛋白的分析。前期预测的 TsGPX3 的分子量约为23 kD,将TsGPX8 与His-tag 融合后分子量大约为27 kD,与原核表达电泳图显示的结果一致。采用Western blotting 验证诱导表达的融合蛋白,证明表达产物为目的蛋白。与TsGPX8 原核表达体系的表达条件相似,从本研究实验结果可知,TsGPX3 原核表达体系在37℃,诱导培养5 h具有较高的蛋白表达量。
4 结论盐芥TsGPX3 基因的全长cDNA 序列大小为 776 bp,编码一个包含196 个氨基酸的蛋白,具有植物GPXs 的特征结构域。系统进化分析表明,盐芥TsGPX3 与同属于十字花科的萝卜RsGPX3、油菜 BnGPX3 和花椰菜BoGPX3 等同源性较高。亚细胞定位研究显示TsGPX3 主要定位于细胞膜上。TsGPX3 原核表达体系在37℃,诱导培养5 h 具有较高的蛋白表达量。
| [1] | Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends Plant Sci, 2002, 7(9):405-410. |
| [2] | Bérczi A, Møller IM. Redox enzymes in the plant plasma membrane and their possible roles[J]. Plant, Cell and Environ, 2000, 23(12): 1287-1302. |
| [3] | 赵宝添, 孙娜娜, 马志媛, 等. 实时定量 PCR 检测拟南芥和盐芥谷胱甘肽过氧化物酶表达水平[J]. 现代农业科技, 2009 (14):332. |
| [4] | 苗雨晨, 白玲, 苗琛, 等. 植物谷胱甘肽过氧化物酶研究进展[J]. 植物学通报, 2005, 22(3):350-356. |
| [5] | Navrot N, Collin V, Gualberto J, et al. Plant glutathione peroxidases are functional peroxiredoxins distributed in several subcellular compartments and regulated during biotic and abiotic stresses[J]. Plant Physiol, 2006, 142(4):1364-1379. |
| [6] | Ramos J, Matamoros MA, Naya L, et al. The glutathione peroxidase gene family of Lotus japonicus :characterization of genomic clones, expression analyses and immunolocalization in legumes[J]. New Phytol, 2009, 181(1):103-114. |
| [7] | Gao F, Chen J, Ma TT, et al. The glutathione peroxidase gene family in Thellungiella salsuginea :genome-wide Identification, classification, and gene and protein expression analysis under stress conditions[J]. Int J Mol Sci, 2014, 15 :3319-3335. |
| [8] | 王莹, 任大明. 盐芥一新型耐盐模式植物及其研究进展[J]. 湖北农业科学, 2010, 49(9):2264-2267. |
| [9] | Wang ZL, Li PH, Zhang H, et al. Expressed sequence tags from Thellungiella halophila, a new model to study plant salttolerance [J]. Plant Sci, 2004, 166(3):609-616. |
| [10] | Wong CE, Li Y, Whitty BR, et al. Expressed sequence tags from the Yukon ecotype of Thellungiella reveal that gene expression in response to cold, drought and salinity shows little overlap[J]. Plant Mol Biol, 2005, 58(4):561-574. |
| [11] | Taji T, Seki M, Satou M, et al. Comparative genomics in salt tolerance between Arabidopsis and Arabidopsis-related halophyte salt cress using Arabidopsis microarray[J]. Plant Physiol, 2004, 135(3):1697-1709. |
| [12] | Meng CM, Cai CP, Zhang TZ, et al. Characterization of six novel NAC genes and their responses to abiotic stresses in Gossypium hirsutum L.[J]. Plant Sci, 2009, 176(3):352-359. |
| [13] | Hasegawa M, Bressan R, Pardo JM. The dawn of plant salt tolerance genetics[J]. Trends Plant Sci, 2000, 5(8):317-319. |
| [14] | Miao Y, Lv D, Wang P, et al. An Arabidopsis glutathione peroxidase functions as both a redox transducer and a scavenger in abscisic acid and drought stress responses[J]. Plant Cell, 2006, 10(18): 2749-2766. |
| [15] | Rodriguez Milla MA, Maurer A, Rodriguez Huete A, et al. Glutathione peroxidase genes in Arabidopsis are ubiquitous and regulated by abiotic stresses through diverse signaling pathways[J]. Plant J, 2003, 36(5):602-615. |
| [16] | 马亭亭, 周宜君, 高飞. 盐芥谷胱甘肽过氧化物酶基因 (ThGPX6)的克隆及表达分析[J]. 植物遗传资源学报, 2012, 13(2):252-258. |
| [17] | 邢浩然, 刘丽娟, 刘国振. 植物蛋白质的亚细胞定位研究进展[J]. 华北农学报, 2006, 21 :1- 6. |
| [18] | 李秀娟. 盐藻DsRab 基因的载体构建、原核表达及亚细胞定位分析[D]. 大连:大连海洋大学, 2014. |
| [19] | 张孜宸, 隋欣, 高飞, 等. 盐芥谷胱甘肽过氧化物酶基因 (ThGPX8)的克隆与原核表达[J]. 西北农林科技大学学报, 2013, 41(11):165-172. |




