2. 中国热带农业科学院甘蔗研究中心 中国热带农业科学院热带生物技术研究所 农业部热带作物生物技术重点开发实验,海口 571101
2. Sugarcane Research Center of CATAS,Institute of Tropical Bioscience and Biotechnology of CATAS,Key Laboratory for Tropical Crops of Ministry of Agriculture,Haikou 571101
甘蔗(Saccharum officinarum L.)是生长于热带和亚热带的高光效C4植物,是重要的糖料作物,同时也是蔗糖的主要原料,甘蔗糖占全国食糖的93%[1]。
在甘蔗中,蔗糖是光合作用的主要产物之一,也是甘蔗体内光合产物运输、分配及其储存的主要形式[2],同时也是重要的糖信号分子[3, 4]。蔗糖从源组织运输到库组织后,一部分被储存,一部分不能直接被植物体利用,需要重新水解为单糖,在己糖转运蛋白的协助下被库组织细胞吸收和利用[5],维持植物正常生理功能。己糖转运蛋白(hexose transporter,STP/HXT)是单糖转运蛋白的一种,广泛存在于植物中,能够跨膜转运葡萄糖、果糖和甘露糖等己糖类物质。根据质子对己糖转运蛋白运输方向,将植物己糖转运蛋白分为3类:(1)H+/己糖同向转运体[6, 7],(2)H+/己糖反向转运体[7],(3)己糖单向易化转运体[7]。目前已经从拟南芥中分离出26个己糖转运蛋白[7],葡萄中分离8个己糖转运蛋白[8],在其他植物中也陆续分离出己糖转运蛋白家族[9, 10, 11]。其功能主要参与植株和花粉的生长,影响植物的生长与发育,或参与植物体内己糖的运输,最终决定经济器官的品质;或参与植物与微生物的互作以及植物的衰老和逆境反应等多种生命活动,影响植物的抗性。糖为植物生长发育提供所必需的碳源和能源,源器官中光合作用所合成的光合同化物通过糖转运蛋白运输到库器官,为细胞生长发育提供能源或为蛋白质、核酸等提供骨架以维持植物生长发育[12]。
单糖转运蛋白的定位与其功能有密切的关系。迄今研究发现,大多数单糖转运蛋白定位在细胞膜上[11],也有研究发现了液泡中的糖转运蛋白,在水稻中还发现了定位在高尔基体上的糖转运蛋白[13]。不同部位的糖转运蛋白其功能也不同。本研究从甘蔗中克隆出己糖转运蛋白基因ShHXT6,对其进行生物信息学分析,运用荧光定量分析技术对其在不同组织中的表达量进行分析,并构建GFP融合载体,进行亚细胞定位,旨在进一步了解己糖转运蛋白对甘蔗生物量的影响。
1 材料与方法 1.1 材料 1.1.1 植物材料本实验所需要的植物材料为甘蔗品种ROC22,种植于中国热带农业科学院生物技术研究所海口实验基地。
1.1.2 菌株与试剂Escherichia coil DH5α购自广州复能公司。LA-Taq、pMD19-T、T4连接酶、实时荧光定量PCR试剂、反转录试剂盒均购自TaKaRa公司。植物总RNA提取试剂盒购自Omega公司,胶回收纯化试剂盒、质粒提取试剂盒购自Axgen。
1.2 方法 1.2.1 甘蔗总RNA及cDNA第一链合成取成熟的甘蔗叶片放于液氮中迅速研磨成粉,再按Omega公司试剂盒说明书提取RNA,消化基因组DNA。cDNA 第一链合成按TaKaRa公司说明书操作。
1.2.2 基因克隆根据已知的植物HXT6序列设计引物,以合成的cDNA为模板,进行PCR扩增,引物序列见表 1。PCR 反应体系为:2×GC buffer 12.5 μL,dNTPs 2.0 μL,cDNA 模板1 μL,引物 ShHXT6F(10 μmol/L):1 μL,引物ShHXT6R(10 μmol/L):1 μL,LA-Taq酶0.3 μL,ddHO 7.2 μL,共25 μL。PCR 扩增程序:95℃ 5 min;95℃ 1 min,65℃ 1 min,72℃ 2 min,34个循环;72℃ 15 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,回收目的片段,将其产物连接到pMD19-T载体,16℃过夜。再将连接产物转化到大肠杆菌感受态菌株DH5α,在含有氨苄青霉素抗性的LB固体培养基过夜培养后挑取单菌落,分别以同样的引物进行菌落PCR 扩增,挑取阳性克隆送上海生工生物工程技术有限公司测序。
利用DNAMAN对ShHXT6氨基酸与其他物种的己糖转运蛋白家族进行同源分析,并构建进化树。利用在线软件对其蛋白质分子量,等电点,亲水性等进行分析。
1.2.4 GFP融合载体的构建对ShHXT基因序列进行分析,找到其完整开放阅读框,在其两端设计带酶切位点的引物,如表 2所示。PCR 反应体系为:2×GC buffer 12.5 μL,dNTPs 2.0 μL,cDNA模板1 μL,引物 ShHXT6F(10 μmol/L):1 μL,引物ShHXT6R(10 μmol/L):1 μL,LA-Taq酶0.3 μL,ddHO7.2 μL,共25 μL。PCR 扩增程序:95℃ 5 min;95℃ 1 min,65℃ 1 min,72℃ 2 min,34个循环;72℃ 15 min。将PCR产物回收连接到pMD19-Tsimple载体中,转化,挑取单克隆进行PCR验证后提取质粒ShHXT-19T。用限制性内切酶Spe I对ShHXT-19T和pCAMBIA1302质粒进行单酶切,酶切产物回收ShHXT-19T小片段和pCAMBIA1302大片段,用T4连接酶连接转化到DH5α,重组质粒酶切验证后送上海生工生物工程技术有限公司测序,获得pCAMBIA-ShHXT融合载体。
取新鲜甘蔗的未成熟叶、成熟叶、未成熟茎、成熟茎及根。未成熟叶为甘蔗未抽出心叶;成熟叶为甘蔗植株由上及下完全展开且可见肥厚带的+3叶。未成熟茎为植株上部茎顶端生长点以下第2节;成熟茎为甘蔗植株由下及上第3或4节。根为挖取植株后成熟根。提取RNA,反转录成的cDNA为模板,根据SYBR Premix Ex Taq说明书进行实时荧光定量PCR分析,以甘蔗GADPH为内参矫正目的基因。PCR反应程序:95℃ 3 min;95℃ 15 s,60℃ 1 min,72℃ 30 s,34个循环。PCR引物,见表 3。
参考Xu等[14]的方法并进行修改。挑取对照质粒pCAMBIA1302和重组质粒pCAMBIA-ShHXT的阳性单克隆,至10 mL YEP 液体培养基(10 mg/mL Str+20 mg/mL Rif +50 mg/mL Kan),28℃,振荡培养至OD600=1.5-2.0,离心,收集菌体。再用50 mL配制好的侵染液重悬。最后将农杆菌侵染液注入已经在28℃,暗培养48 h的洋葱表皮,28℃暗培养72 h。再将洋葱表皮置于荧光显微镜下观察。
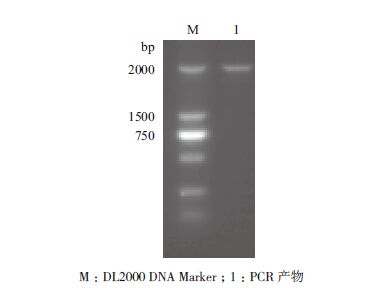
2 结果 2.1 ShHXT6的克隆以提取的甘蔗叶片RNA反转录的cDNA为模板,进行RT-PCR。扩增产物进行电泳,得到一条1 900 bp左右的条带(图 1),与预期条带大小一致,将其回收,连接转化,并送公司测序后得到1 929 bp长度的序列。
|
| 图 1 甘蔗ShHXT6 PCR 扩增产物 |
利用ProtParam软件进行在线预测分析,该基因编码475个氨基酸残基(图 2),蛋白分子量为51.95 kD,理论等电点为9.47,不稳定系数为42.06,说明为稳定蛋白。总平均疏水指数为0.463,表明该蛋白为疏水性蛋白。富含精氨酸Arg(A)(6.5%),丝氨酸Ser(S)(5.5%),苏氨酸Thr(T)(6.3%),丙氨酸Ala(A)(10.1%),亮氨酸Leu(L)(11.4%),苯丙氨酸Phe(F)(6.7%),缬氨酸Val(V)(9.5%)。其二级结构α-螺旋(H)47.96%,β-折叠(S)19.59%,β-转角(T)9.59%,无规则卷曲(C)22.86%。

|
| 图 2 甘蔗ShHXT6 的核苷酸序列及推导的氨基酸序列 |
从NCBI在线数据库中选出13个不同作物的己糖转运蛋白的氨基酸序列,将这些氨基酸序列与甘蔗ShHXT6的序列进行同源性分析,结果(图 3)显示,该基因编码的氨基酸与玉米、狗尾草和水稻的己糖转运蛋白一致性分别为80.85%、76.89%和72.86%。表明HXT6家族类型多样,但不同植物间的HXT6结构保守。

|
| 图 3 甘蔗ShHXT6 推导的氨基酸序列与其他植物的HXT6 同源性分析 |
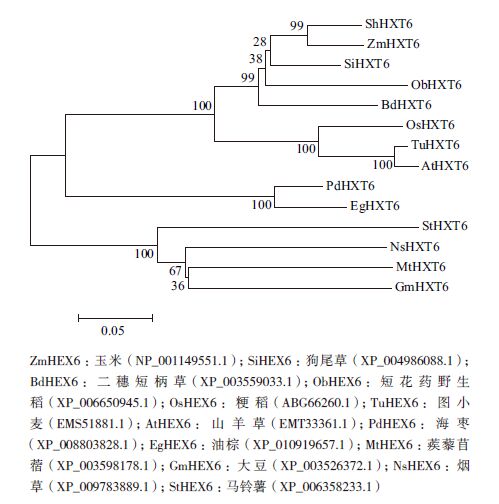
甘蔗ShHXT6氨基酸序列与其他植物己糖转运蛋白构建系统进化树,结果(图 4)显示,这些己糖转运蛋白分为4类:甘蔗与玉米聚为一类;图小麦(EMS51881.1)与山羊草(EMT33361.1)聚为一类;海枣(XP_008803828.1)与油棕(XP_010919657.1)聚为一类,ShHXT6与玉米的HXT6最接近。
|
| 图 4 甘蔗ShHXT6 与其他植物HXT6 的进化树 |
将得到的ShHXT-19T和pCAMBIA1302质粒用限制性内切酶Spe I进行单酶切回收ShHXT-19T小片段和pCAMBIA1302大片段,用T4连接酶连接转化到DH5α,然后将重组质粒进行酶切验证。结果(图 5)表明,重组质粒测序结构正确,获得pCAM-BIA-ShHXT融合载体。

|
| 图 5 pCAMBIA-ShHXT 酶切电泳图 |
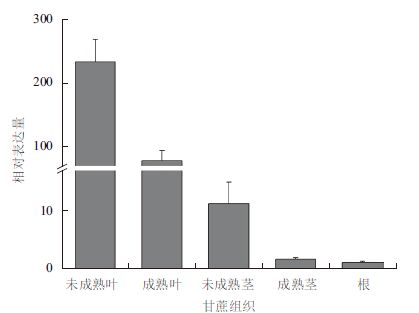
荧光定量PCR检测甘蔗叶、茎和根中HXT6表达量变化,结果(图 6)表明,该基因在甘蔗不同组织的表达差异,在叶片中,未成熟叶表达量远远高于成熟叶片;在茎中,未成熟茎表达量也高于成熟茎。尤其是未成熟叶,表达量达到最高,在根中几乎不表达。说明它在未成熟组织中表达量高。
2.6 ShHXT在洋葱表皮中的亚细胞定位
|
| 图 6 ShHXT6 在甘蔗不同组织的差异性表达 |
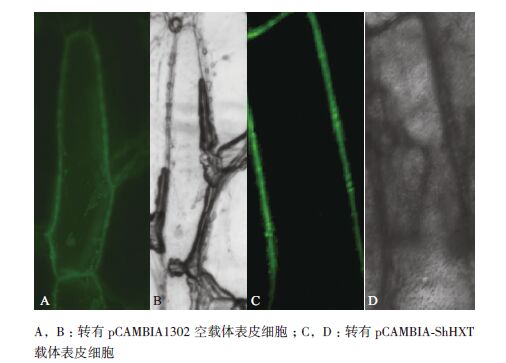
使用荧光显微镜在紫外光下观察农杆菌侵染的洋葱表皮细胞中的GFP表达情况。结果(图 6)显示,空载pCAMBIA1302在细胞各个部位都能观察到绿色荧光(图 6-A),转化的pCAMBIA-ShHXT融合载体的洋葱细胞,在细胞膜上有明显的绿色荧光,有明显的定位特征(图 6-C),因此推测ShHXT基因编码的蛋白是一种膜蛋白。
|
| 图 7 ShHXT 在洋葱表皮中的亚细胞定位 |
最初研究发现己糖转运蛋白主要在库中表达,即蔗糖直接从韧皮部释放到质外体中,并在此处由蔗糖转化酶分解成单糖,再由己糖转运蛋白带到库组织中,为细胞分化提供能量,从而影响植物生长发育,其中包括胚胎形成、种子萌发、营养生长和发育等。目前已经从一些植物中克隆出HXT基因,并对其功能进行研究。从烟草中分离出来的己糖转运蛋白主要在库组织表达:如根、花及未成熟叶[15];拟南芥中的己糖转运蛋白主要在根和花中表达[16]。葡萄中的己糖转运蛋白主要在浆果和未成熟叶中表达[17],黄瓜中己糖转运蛋白主要在花粉管中表达,促进花粉管的发育[18]。但在甘蔗中对HXT的研究很少。本研究从甘蔗中分离出HXT基因 ShHXT6,氨基酸一致性和系统进化树分析得到 ShHXT6是一种与甘蔗糖转运相关的己糖转运蛋白。过去对甘蔗的研究主要集中在甘蔗体内物质代谢的相关酶及蔗糖转运蛋白,从而提供甘蔗产量并改良品质。但对己糖转运蛋白在甘蔗产量和品质方面的研究甚少。本研究表明,ShHXT6在甘蔗未成熟叶中表达最多,在未成熟茎中也有表达,这与前人的研究结果相符。这说明它在未成熟组织中表达较高,可能在未成熟组织尤其是未成熟叶中对其利用率高,促进其细胞分化,为植物组织提供碳源和能量,促进其生长发育或储存在其中。光合产物的运输与分配直接影响作物的产量和品质,植物中的光合产物要有效地转运到库组织中才能提高作物经济产量。
单糖转运蛋白主要定位在膜蛋白,参与糖类物质的运输,为库组织的生长发育提供必需的能源和碳源。也有一些糖转运蛋白定位于液泡膜,可能参与糖类物质的存储[20]。本研究表明,ShHXT6基因编码的蛋白定位在细胞膜,可能参与糖类物质的运输,这与表达量分析结果一致。本研究对ShHXT6基因进行克隆,对其进行了表达量的分析及亚细胞定位,为了解甘蔗体内光合产物的运输分配,提高甘蔗产量及品质改良提供基因资源。
| [1] | 王俊刚, 赵婷婷. 甘蔗体内的蔗糖转运与运输途径[J]. 植物生物学通讯, 2008, 44(3):605-610. |
| [2] | Geiger D. Plant sucrose transporters from a biophysical point of view[J]. Molecular Plant, 2011, 4(3):395. |
| [3] | Wind J, Smeekens S, Hanson J. Sucrose:Metabolite and signaling molecule[J]. Phytochemistry, 2010, 71(14-15):1610-1614. |
| [4] | Dinant S, Lemoine R. The phlom pathway:new issues and old debates[J]. Comptes Rendus Biologies, 2010, 333(4):307-319. |
| [5] | 王俊刚, 赵婷婷. 植物单糖转运蛋白[J]. 植物生物学通讯, 2007, 43(6):1195-1198. |
| [6] | Bush DR. Proton-coupled sugar and amino acid transport-ers in plants[J]. Annual Review of Plant Biology, 1993, 44(1):513-542. |
| [7] | 刘珊. 质子对植物蔗糖转运蛋白和己糖转运蛋白活性的调节[J]. 黑龙江农业科学, 2012(7):14-18. |
| [8] | Lecourieux F, Kappel C, Lecourieux D, et al. An update on sugar transport and signalling in grapevine[J]. J Exp Bot, 2014, 65(3):821-832. |
| [9] | Xuan YH, Hu YB, Chen LQ, et al. Functional role of oligomerization for bacterial and plant SWEET sugar transporter family[J]. Proceedings of the National Academy of Sciences, 2013, 110(39):E3685-E3694. |
| [10] | Yuan M, Wang S. Rice MtN3/Saliva/SWEET family genes and their homologs in cellulLar organisms[J]. Molecular Plant, 2013, 6(3):665-674. |
| [11] | Chen LQ, Qu XQ, Hou BH, et al. Sucrose efflux mediated by SWEET proteins as a key step for phloem transport[J]. Science, 2012, 335:207-211. |
| [12] | Buttner M, Saue N. Monosaccharide transporters in plants:structure, function and physiology[J]. Bochimic Biophysica Acta, 2000, 1465:263-274. |
| [13] | Cao H, Guo S, Xu Y, et al. Reduced expression of a gene encoding a Golgi localized monosaccharide transporter(OsGMST1)confers hypersensitivity to salt in rice(Oryza sativa)[J]. Journal of Experimental Botany, 2011, 62(13):4595-4604. |
| [14] | Xu K, Huang X, Wu M, et al. A rapid, highly efficient and econom-ical method of Agrobacterium-mediated in planta transient transfor-mation in living onion epidermis[J]. PLoS One, 2014, 9(1):e83556. |
| [15] | Sauer N, Stadle R. A sink specific H+/monosaccharide cotransporter from Nicotoana tabacum:cloning and HXT6erologous express in baker’s yeast[J]. Plant J, 1993, 4:601-610. |
| [16] | Truernit E, Schmid J, Epple P, et al. The sink specific and stress-regulated Arabidopsis STP4 gene:enhanced express of a gene encoding a monmsaccharide transporter by wounding, elicitor, and pathogen challengge[J]. Plant Cell, 1996, 8:2169-2182. |
| [17] | Agasse A, Vignault C, Kappel C, et al. Sugar transport and sugar sensing in grape[M]//Roubelakis-Angelakis KA, ed. Grapevine Molecular Physiology and Biotechnology. Dordrecht:Springer, 2009:105-139. |
| [18] | Cheng J, Wang Z, Yao F, et al. Down-regulating CsHT1, a cucumber pollen-specific hexose transporter, inhibits pollen germination, tube growth and seed development[J]. Plant Physiology, 2015, 168(2):635-647. |
| [19] | Martinoia E, Meyer S, De Angeli A, et al. Vacuolar transporters in their physiological context[J]. Annual Review of Plant Biology, 2012, 63:183-213. |







