田间杂草与作物竞争阳光、水分、养分及生长空间,同时又是作物病原菌和害虫的中间寄主生物,严重影响了农作物产量和农产品质量[1]。同其他作物如水稻、小麦、玉米、大豆和油菜等一样,甘蔗杂草危害也相当严重,使用除草剂除草是目前备受青睐的除草方式。然而传统的除草剂如草铵膦和草甘膦除草无选择性,不能直接用于作物的生长期,因此这个时期的田间除草只能依赖于人工操作[2]。然而随着中国农村剩余劳动力的减少和劳动力成本的增加,使本来机械化水平就偏低的甘蔗生产成本进一步提高[3, 4, 5]。种植耐除草剂转基因作物是解决这个问题的最有效方法之一,在中国开展耐除草剂转基因育种具有巨大的市场需求[6]。
2014年,全球种植转基因作物1.815亿hm2,相当于全球总耕种面积的10%,其中具有耐除草剂性状的转基因作物占全球转基因作物面积的61%[7, 8]。开展耐除草剂转基因研究的作物有很多种,得到大面积推广应用的主要以玉米、大豆、油菜和棉花为主[9]。国内外对甘蔗耐除草剂转基因方面的研究也有一些报道[10, 11, 12],但对其推广应用还远不如大豆、玉米等其他作物,特别是在国内,甘蔗抗除草剂转基因的研究相对来说还比较落后。
世界上应用得比较多的耐除草剂的基因主要为bar基因和EPSPS基因[13, 14]。本研究通过农杆菌介导法,分别将bar基因和EPSPS基因导入甘蔗中,通过直接喷洒田间施用浓度的草铵膦和草甘膦,以期获得抗草铵膦和草甘膦的转基因甘蔗。
1 材料与方法 1.1 材料 1.1.1 品种、质粒和菌株受体材料为甘蔗主栽品种新台糖22号,抗草铵膦的bar基因来源于pCAMBIA3300载体,抗草甘膦的EPSPS基因来源于根癌农杆菌CP4菌株。分别含两个抗除草剂基因的植物表达载体均为本实验构建并保存,转化所用农杆菌菌株为EHA105。所使用草铵膦为浙江永农生物科技有限公司生产,农药名称为“百速顿”,产品批号:2014080701,其有效浓度为20%的草铵膦。所使用草甘膦为江苏丰山集团有限公司生产,农药名称为“双火”,产品批号:2014111201,其有效浓度为41%草甘膦异丙胺盐。
实验地点:农业部转基因植物及植物用微生物环境安全监督检验测试中心(海口) ——文昌基地。
1.1.2 培养基配方胚性愈伤组织诱导培养基:MS+2,4-D 1 mg/L+蔗糖30 g/L+卡拉胶8 g/L,pH5.8。
胚状体分化培养基:MS+6-BA 1 mg/L+KT 0.5 mg/L+蔗糖30 g/L+卡拉胶8 g/L,pH5.8。
生根诱导培养基:MS(大量元素减半,其他成分不变)+NAA 2 mg/L+蔗糖20 g/L+ 椰水100 mL/L+卡拉胶8 g/L+活性炭0.2 g/L,pH 5.8[15]。
MR培养基:MS(1/5大量元素)+30 g/L蔗糖+100 μm/L乙酰丁香酮,pH5.2。
1.2 方法 1.2.1 甘蔗胚性愈伤组织的诱导以田间生长良好的甘蔗顶端生长点处的幼叶组织为外植体,经酒精及升汞消毒、无菌水冲洗后,于无菌滤纸上吸干其表面的水分后,切成1 mm左右厚度的薄片接种于诱导培养基上,于避光条件下进行培养至诱导出愈伤组织。
1.2.2 农杆菌侵染菌液的制备通过冻融法将含bar基因及EPSPS基因的植物表达载体分别导入到EHA105中。将经PCR鉴定为阳性的农杆菌在含抗生素的YEP平板上划线,挑取单菌落接种到5 mL YEP的液体培养基中,振荡培养至对数生长期,于150 mL三角瓶中扩大培养,培养至OD为0.6左右,将菌液转移到离心管中,5 000 r/min离心5 min,弃上清,吸干残液,用MR液体培养基重悬菌体,最后置于28℃,200 r/min激活2 h,诱导细菌Vir基因的表达,作为转化材料的浸染液。
1.2.3 愈伤组织的转化挑取生长旺盛的愈伤组织于滤纸上吹干使其处于干缩状态,于工程菌液中浸泡30 min后,滤去菌液,用滤纸吸干残液,吹干,转移到MR固体培养基上。共培养3-4 d后,继代筛选培养20 d后,分化筛选培养15 d。待愈伤长出1 cm左右的小苗后,生根筛选培养30 d。
1.2.4 转化植株的移栽与培养当分别转入抗草铵膦的bar基因及抗草甘膦的EPSPS基因的植株在抗性生根培养基上生长至4-7 cm后,将经PCR鉴定为阳性的转化株系移栽到大花盆里,并置于室外进行种植培养,此次培养得到的植株设为T0代。到T0生长8个月左右后,砍去主茎,适量培土进行宿根培养,重新生长出来的植株设为宿根1代。待宿根1代生长到8个月左右,再次砍去所有主茎,再次进行宿根培养,重新生长出来的植株设为宿根2代。而将所砍取的T0代的甘蔗茎段作为种茎,移栽大田扩繁种植,称为T1代。
1.2.5 转化植株的分子检测分别合成bar基因及EPSPS基因的特异性引物,分别对T0代、T1代、宿根1代及宿根2代的转化植株进行PCR检测,分析bar基因及EPSPS基因在转基因甘蔗中的遗传稳定性。进行PCR扩增检测,扩增时设置正负对照。并对植株扩增产物进行回收测序,检测扩增目的条带的准确性。
1.2.6 T0代、T1代、宿根1代及宿根2代的转化植株的耐除草剂特性检测对转有bar基因的T0代、T1代、宿根1代及宿根2代的转化植株,喷洒田间建议使用浓度4.5/hm2的百速顿草铵膦除草剂(200 g/L草铵膦,永农生物科技有限公司,浙江)。对转有EPSPS基因的T0、T1、宿根1代及宿根2代的转化植株,喷洒田间建议使用浓度6 L/hm2的农达草甘膦除草剂(41%草甘膦异丙胺盐,丰山集团有限公司,江苏)。
2 结果 2.1 bar基因及EPSPS基因植物表达载体转化农杆菌的鉴定用合成的bar基因及EPSPS基因的特异性引物,对通过冻融法将含抗草铵膦的bar基因及抗草甘膦的EPSPS基因的两个植物表达载体分别导入EHA105中的农杆菌菌株进行PCR鉴定,并通过农杆菌质粒DNA间接酶切鉴定法进行质粒载体的酶切鉴定[16]。如图 1所示,1、2号菌株能扩增出与预期条带359 bp大小一致的条带,且如图 2-A所示,通过酶切可以获得与bar基因550 bp大小一致的条带,说明含抗草铵膦的bar基因的植物表达载体已经正确导入到EHA105农杆菌菌株中。同样如图 1所示,3、4号菌株能扩增出与预期条带643 bp大小一致的条带,且如图 2-B所示,通过酶切可以切出与EPSPS基因1 600 bp大小一致的条带,说明含抗草甘膦的EPSPS基因的植物表达载体已经正确导入到EHA105农杆菌菌株中。
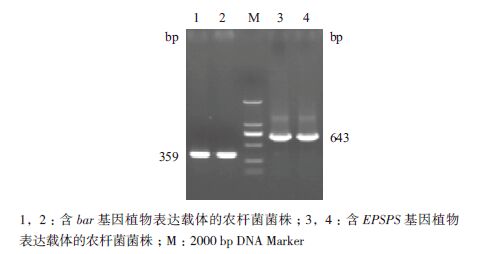
|
| 图 1 农杆菌菌株PCR 鉴定 |

|
| 图 2 植物表达载体的酶切鉴定 |
通过农杆菌介导法,用含抗草铵膦的bar基因及抗草甘膦的EPSPS基因的两个植物表达载体分别对甘蔗新台糖22号进行遗传转化,结果(图 3)表明,为转化筛选后得到了分别含抗草铵膦的bar基因及抗草甘膦的EPSPS基因的转化植株。

|
| 图 3 转含bar 基因(A)EPSPS 基因(B)的甘蔗遗传转化 |
当所获得的转化抗性植株生长至4-7 cm,按编号剪取小苗叶片组织约10-20 mg,剪碎置于eppendorf管中,用CTAB法提取DNA。用1.2.5合成的bar基因及EPSPS基因的特异性引物,对分别转有bar基因及EPSPS基因的转化植株进行PCR检测。图 4显示,所检测的转bar基因的23株转化抗性植株中有20株为bar基因阳性(编号为:b1、b2、b3、b5、b6、b7、b8、b9、b10、b12、b13、b14、b15、b17、b18、b19、b20、b21、b22、b23)。而所检测的转EPSPS基因的23株转化抗性植株中有15株为EPSPS基因阳性(编号为:E1、E5、E6、E8、E9、E10、E12、E14、E15、E17、E18、E20、E21、E22、E23)。
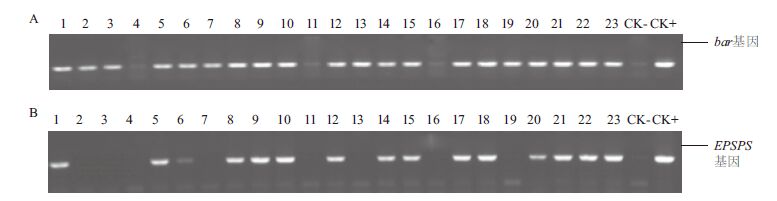
|
| 图 4 转化bar 基因(A)及EPSPS 基因(B)植株T0 代的PCR 检测 |
砍取T0代为阳性的植株主茎转移到大田扩繁种植,称为T1代。而T0代在花盆中留下的蔗头则连续进行两次宿根培养,称为宿根1代及宿根2代。通过bar基因及EPSPS基因的特异性引物,对T1代、宿根1代及宿根2代进行PCR检测,以检测bar基因及EPSPS基因在转基因甘蔗中的遗传稳定性。图 5显示,T0代检测为bar基因PCR阳性的20个转化植株,在T1代、宿根1代及宿根2代中均能检测到bar基因的存在,说明bar基因可以在转基因甘蔗中得到稳定的遗传。图 6则显示,T0代检测为EPSPS基因PCR阳性的15个转化植株,在T1代、宿根1代及宿根2代中均能检测到EPSPS基因的存在,说明EPSPS基因也可在转基因甘蔗中得到稳定的遗传。

|
| 图 5 转bar 基因甘蔗的遗传稳定性检测 |

|
| 图 6 转EPSPS 基因甘蔗的遗传稳定性检测 |
分别对转bar基因与EPSPS基因的转基因甘蔗T0代、宿根1代及宿根2代,喷洒田间施用浓度的草铵膦4.5 L/hm2和草甘膦6 L/hm2。转bar基因与EPSPS基因的转基因甘蔗T0代、宿根1代及宿根2代喷洒除草剂7 d后观察,并拍照。转bar基因甘蔗T0代、宿根1代及宿根2代喷洒草铵膦7 d后的结果(图 7)显示,每个花盆的左边为补充种植的非转基因对照植株,已经干枯并逐渐死亡,而右边为转bar基因植株则不受草铵膦的任何影响继续健康生长。说明转bar基因的甘蔗T0代、宿根1代及宿根2代都具备稳定的耐除草铵膦特性。转EPSPS基因甘蔗T0代、宿根1代及宿根2代喷洒草甘膦7 d后的结果(图 8)显示,每个花盆的右边为补充种植的非转基因对照植株,已经干枯并逐渐死亡,而左边为转EPSPS基因植株则不受草甘膦的任何影响继续健康生长。说明转EPSPS基因的甘蔗T0代、宿根1代及宿根2代都具备稳定的耐除草甘膦特性。

|
| 图 7 转bar 基因甘蔗喷洒草铵膦 |

|
| 图 8 转EPSPS 基因甘蔗喷洒草甘膦 |
分别对转bar基因与EPSPS基因的转基因甘蔗田间扩繁T1代,喷洒田间施用浓度的草铵膦4.5 L/hm2和草甘膦6 L/hm2。
田间喷洒草铵膦除草剂10 d后的结果(图 9)显示,杂草及非转基因对照甘蔗均枯黄,基本接近死亡,对草铵膦没有任何耐受性(图 9-A);喷洒了草铵膦的转bar基因的甘蔗不受草铵膦的任何影响继续健康生长(图 9-B),说明转bar基因的甘蔗对草铵膦有极强的耐受性。
田间喷洒草甘膦除草剂10 d后的效果(图 10)显示,杂草及非转基因对照甘蔗均枯黄,基本接近死亡,对草甘膦没有任何耐受性(图 10-A);喷洒了草甘膦的转EPSPS基因的甘蔗不受草甘膦的任何影响继续健康生长(图 10-B),说明转EPSPS基因的甘蔗对草甘膦有极强的耐受性。

|
| 图 9 田间喷洒草铵膦除草剂10 d 后 |

|
| 图 10 田间喷洒草甘膦除草剂10 d 后 |
草甘膦和草铵膦从化学结构上讲都属含磷的氨基酸类除草剂。草甘膦于1974年投入市场,而草铵膦于1986年投入市场。这两种除草剂都是非选择性的灭生性除草剂,这是他们的共同之处,但作用机制却不同。草甘膦为5-烯醇丙酮酰莽草酸-3-磷酸合成酶(EPSP)抑制剂。草甘膦通过阻碍此酶,从而破坏杂草所必须的芳香族氨基酸的合成,诸如色氨酸、酪氨酸、丙氨酸,导致杂草枯死。而草铵膦则为谷氨酰胺合成酶(GS)抑制剂,通过阻碍该酶的合成而灭杀杂草。目前草甘膦是全球销售市场最高的除草剂,也是全世界销售额第一的农药品种,2012年,其销售额达45.75亿美元。可见,草甘膦的销售与应用远远超过了草铵膦。所以目前抗草甘膦转基因作物的推广应用也最为广泛。
但随着草甘膦抗性难除杂草的增多、百草枯禁用日期临近,草铵膦作为理想的替代选择成为业界关注的热点品种。在2014年11月的草铵膦应用技术与市场推广交流会上,不少业内专家认为,除草剂将进入草铵膦时代。草铵膦对土壤、作物根系和后茬无影响,杀草谱广、持效期较长,可以减少用药次数,降低成本,性价比优势明显,未来应用面积将进一步扩大。国内百草枯水剂退市后,近4万t市场空白将被草铵膦等灭生除草剂替代,而草铵膦将成为唯一的快速灭生除草剂,尤其是浅根作物行间除草,增长空间大。草铵膦生产工艺复杂,要经过13道反应工序,历经半个多月的时间才能生产出来,国内能生产出这一产品的厂家屈指可数,产能供应不足。同时,价格偏高也限制了其在大田作物的应用。虽然草铵膦的用药成本是百草枯的2-3倍,但至少能节约一次用药,每公倾可以节省用工成本300多元钱,目前人工成本贵,而且劳动力紧缺。百草枯的退市,使得灭生性除草剂选择空间变小;现在农户对种植成本有了新的认识,不是简单看价钱,关键看性价比;随着草铵膦规模的不断扩大和科技进步,也会逐渐降低生产成本,这几大因素让草铵膦有非常大的发展潜力。同时这也将进一步推进抗草铵膦转基因作物的研究与应用[17]。
4 结论利用农杆菌介导法分别获得了抗草甘膦与草铵膦的转基因甘蔗,并对T0代、宿根1代、宿根2代及田间扩繁T1代外源基因遗传稳定性和耐除草剂稳定性进行较为系统的研究。结果证明,转bar基因耐草铵膦和转EPSPS基因耐草甘膦的甘蔗转基因植株的外源基因均能稳定遗传,耐除草剂特性强且稳定。因此,转bar基因和转EPSPS基因的耐除草剂转基因甘蔗有良好的应用前景。
| [1] | http://www.fao.org/news/story/en/item/29402/icode/ |
| [2] | 邱龙, 马崇烈, 刘博林, 章旺根. 耐除草剂转基因作物研究现状及发展前景[J]. 中国农业科学, 2012, 45(12):2357-2363. |
| [3] | 宋丽萍. 中国劳动力成本上升的原因及对策[J]. 经济论坛, 2010, 484(12):26-28. |
| [4] | 刘皞春, 区颖刚, 曾志强. 湛江农垦甘蔗机械化现状调查与分析[J]. 农机化, 2013, 6:28-33. |
| [5] | 赵德昭, 许和连. FDI、农业技术进步与农村剩余劳动力转移—基于“合力模型”的理论与实证研究[J]. 科学学研究, 2012, 30(9):1342-1353. |
| [6] | 强胜, 宋小玲, 戴伟民. 抗除草剂转基因作物面临的机遇与挑战及其发展策略[J]. 农业生物技术学报, 2010, 18(1):114-125. |
| [7] | Global Status of Commercialized Biotech/GM Crops:2010, ISAAA Brief 42-2010. [8] 张成, 刘定富, 易先达. 全球转基因作物商业化进展及现状分析[J]. 湖北农业科学, 2011, 50(14):2819-2823. |
| [9] | 何少海, 郑叶平, 严景城, 等. 农作物抗除草剂草丁膦基因的发展进程[J]. 现代农业, 2015, 1:33-34. |
| [10] | 王继华, 张木青, 曹干. 抗除草剂转基因甘蔗农艺性状调查[J]. 广东农业科学, 2011(9):23-34. |
| [11] | Dong SJ, Delucca P, Geijskes RJ, et al. Advances in agrobacterium-mediated sugarcane transformation and stable transgene expression[J]. Sugar Tech, 2014, 16(4):366-371. |
| [12] |
Mayavan S, Subramanyam K, Arun M, et al. Agrobacterium tume- faciens-mediated in planta seed transformation strategy in sugarcane [J]. Plant Cell Rep, 2013, 32(10):1557-1574. |
| [13] | 张宏军, 刘学, 张佳. 草铵膦的作用机理及其应用[J]. 农药与科学管理, 2004, 25(4):23-27. |
| [14] | Bonny S. Genetically modified glyphosate-tolerant soybean in the USA:adoption factors, impacts and prospects[J]. Agron Sustain Dev, 2008, 28:21-32. |
| [15] | 王文治, 杨本鹏, 蔡文伟, 等. 甘蔗转基因甘露糖筛选系统的建立[J]. 生物技术通报, 2015, 31(1):92-97. |
| [16] | 马滋蔓, 王文治, 杨本鹏, 张树珍. 农杆菌质粒DNA的间接酶切鉴定[J]. 生物技术通报, 2009(7):171-173. |
| [17] | 凌进. 草铵膦、百草枯、草甘膦对非耕地杂草的防效比较[J]. 农药, 2014, 53(8):613-615. |




