石油是重要的工业原料,同时又是能源与燃料。随着世界石油工业迅速发展,石油需求量大幅度增加,使得开采面积不断扩大。在开采、运输、贮藏及加工过程中,由于管道、储油罐等意外溢洒或泄漏事故,导致石油排放到农田、海洋及地下水中使环境遭受到污染,直接危害到人类生产与生活[1, 2, 3]。石油污染已成为目前世界公害之一,每年全世界约有 800 万t的石油进入环境,污染土壤、地下水、河流和海洋[4]。石油对土壤的污染主要是破坏土壤结构,影响土壤的通透性,损害植物根部,阻碍根的呼吸与吸收,最终导致植物死亡。石油中的许多成分,如苯、甲苯、乙苯、菲、苯并[a]芘等物质毒性大,且有致癌、致突变等作用,而且能通过食物链在动植物体内逐渐富集,进入食物链造成人体损伤[5, 6],因此被美国环保局(EPA)列为优先控制污染物范围。
20世纪80年代以前,处理石油污染土壤的主要方法是物理或化学方法,这些方法不仅成本高,且后续处理比较困难[7, 8, 9]。20世纪80年代以来,人们将注意力转向生物法治理石油污染土壤,通过改变生物外部生活环境和依照生物自身的遗传变异规律提高石油降解速度和程度[10, 11]。生物治理手段主要包括生物刺激、生物强化、固定化微生物技术和植物——微生物联用技术,因其具有成本低、效率高、消耗少、对环境影响小和无二次污染的优点,正逐步成为石油污染土壤治理的热点领域[12]。本研究主要从生物刺激和生活强化两方面对油污土壤的处理效果进行比较与研究,以确定最佳的处理方案。
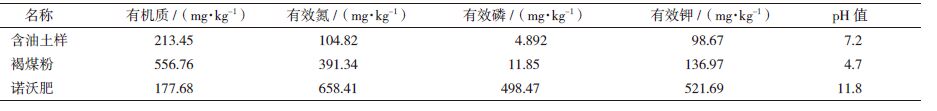
1 材料与方法 1.1材料 1.1.1 供试含油土样采自长庆油田安塞县招安镇招3-6井场内部及周围土壤,土样取自表层以下10-20 cm处,属粉砂质黄土,土中含有少量3-12 mm的小砾石。土壤样品经风干后,剔除石块、杂草,研碎过40目筛子备用。
1.1.2 氮磷钾复合肥氮磷钾复合肥由陕西迪隆生态科技有限公司提供,其中N:PK比例为8:6:5。
1.1.3 褐煤粉褐煤粉由陕西迪隆生态科技有限公司提供,其中腐殖酸含量在50%左右。
1.1.4 诺沃肥诺沃肥购买于天津市经济技术开发区诺维信(中国)生物技术有限公司。诺沃肥是诺维信酶制剂公司在生产酶产品后,土豆面粉、玉米淀粉等原材料的发酵残余液,经添加石灰沉淀、高温灭菌和脱水处理而得,富含N、P等营养元素。
1.1.5 复合菌剂复合菌剂由枯草芽孢杆菌(Bacillus subtilis)和铜绿假单胞菌(Pseudomonas aeruginosa)按照(V:V=1:1)混合后接入发酵罐中,发酵48 h后,将发酵液倒入已用75%的酒精消毒过的25 L的塑料桶中,再按比例添加0.8 g NH4NO3和0.1 g KH2PO4复合而成,由西安工程大学实验室制备。
实验含油土样、褐煤粉、诺沃肥基本理化性质,见表 1。
该试验装置由0.3 m×0.25 m×1.2 m的塑料垃圾桶改装所得,在塑料桶前后两侧按一定间距各钻5个直径为6 cm的小孔(方便取样与测量相关指标),在底部连接有鼓风机,适时进行鼓风。实验共设为3个处理组:处理组A(添加浓度为2.5%,质量比为1:1的褐煤粉—诺沃肥混合物,并施加氮磷钾复合肥调节C:N为10:1);处理组B(添加浓度为2.5%的复合菌剂,并施加氮磷钾复合肥调节C:N为10:1);对照组CK(不做任何处理)。实验周期为60 d,每周翻堆一次,使土壤含水率保持在45%左右,定期采用四分法取样测定各项指标。
1.2.2 实验指标及测定方法实验指标:石油烃组分含量、表面张力、微生物数量、酶活性。
石油烃组分含量采用层析法分离,再使用重量法测定各组分含量[13, 14];表面张力采用自动界面张力仪(JYW-200A)测定土壤溶液表面张力[15];土壤中总异养菌数采用涂布平板分离培养,并用血球计数法进行测定;土壤中石油烃降解菌数的测定采用最大或然数法(MPN)进行[16, 17];土壤脱氢酶活性采用TTC法测定,其大小用每克土样中生成三苯基甲臜(TPF)量来表征;酯酶活性采用4-硝基苯丁酸酯的异丙醇溶液进行提取,后采用紫外分光光度计测定,其大小用每克土样中生成的4-硝基苯酚(pNP)量表征[18]。
1.2.3 数据统计分析所有数据采用Excel整理,DPS统计软件进行分析。 2 结果 2.1修复过程中土壤TPH含量的变化
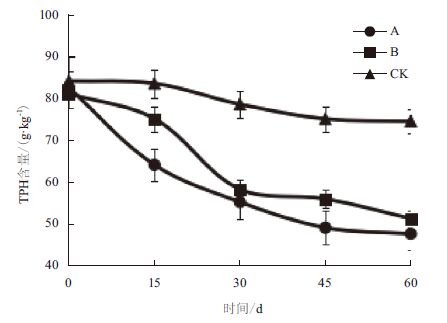
图 1显示,3组处理经过60 d的修复实验,土壤中TPH含量均有不同程度的降低。对照CK开始时TPH含量为84.16 g/kg,实验结束时土壤中TPH含量下降至74.60 g/kg,降解率仅为11.36%;处理A在修复过程中TPH含量由82.59 g/kg降至47.65 g/kg,降解率高达42.30%;处理B土壤中TPH含量由开始的81.14 g/kg下降到51.28 g/kg,降解率为36.80%。
|
| 图 1 修复过程中土壤TPH 含量的变化 |
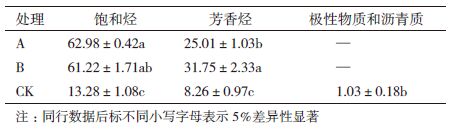
表 2显示,各处理对石油烃各组分的降解程度排序为:饱和烃>芳香烃>极性物质和沥青质,说明相比较芳香烃和极性物质,饱和烃更容易被生物利用和降解。饱和烃的累积降解率最低的是对照CK处理,仅为13.28%,采用生物刺激的处理A对饱和烃的降解率显著高于CK,高达62.98%,而采用生物强化的处理B对饱和烃的降解率为61.22%,低于处理A。
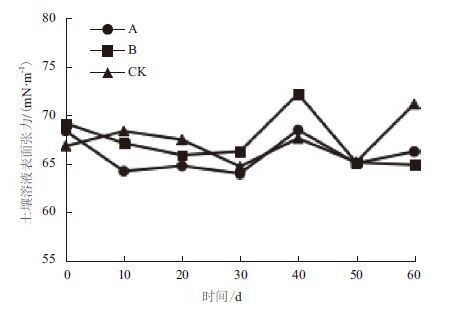
图 2显示,各处理的土壤溶液的表面张力值趋势基本一致,均表现为上下波动现象,无显著性差异。处理A、处理B和对照CK起始时表面张力值分别为68.33 mN/m、69.13 mN/m和66.78 mN/m,在修复进行至第30天时,其表面张力值均有所下降,分别为63.97 mN/m、66.23 mN/m和64.69 mN/m。随着实验的进行,至第40天时,3组处理土壤溶液的表面张力值表现出跳跃现象,随后逐渐降低至稳定。
|
| 图 2 修复过程中土壤溶液表面张力的变化 |
图 3显示,在修复过程中,对照CK土壤中总异养菌数和石油烃降解菌数变化不大,其数量级维持在4.5-6.0之间。在修复前40 d,处理组A和处理组B中总异养菌数和石油烃降解菌数均呈现上升趋势,处理组A总异养菌数数量级上升至7.0左右,石油烃降解数量级达到6.0左右;处理组B总异养菌数和石油烃降解菌数量级在6.0附近波动。在修复40 d后,处理组A土壤中总异养菌数和石油烃降解菌数下降趋势显著,下降高达两个数量级;处理组B和对照CK则降低程度缓慢。
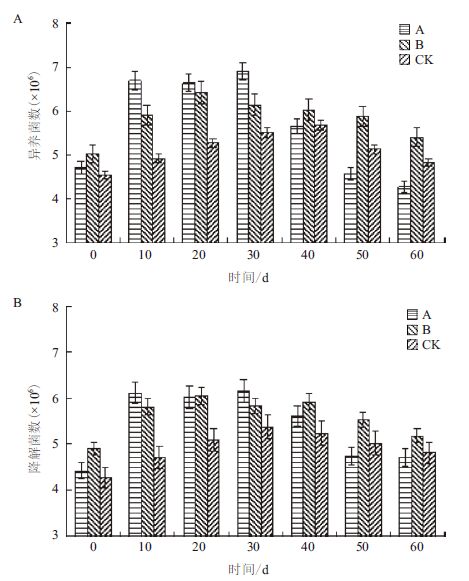
|
| 图 3 修复过程中总异养菌数(A)和石油烃降解菌数(B) 的变化 |
土壤酶活性作为衡量微生物活性的重要指标常用在生物修复中,它可用来实时监测微生物对污染物的代谢能力,进而对修复效果做出评价。图 4显示,在第10天时,处理A和处理B土壤中脱氢酶的活性分别为3.28 mg/g和3.14 mg/g,显著高于对照CK组的0.51 mg/g;在修复进行至第50天时,处理组A和处理组B脱氢酶活性快速下降至0.4 mg/g和0.36 mg/g,而对照CK则稳定在0.7 mg/g左右。处理组A和处理组B酯酶活性在整个修复过程中上下波动,且酯酶活性均高于对照CK。
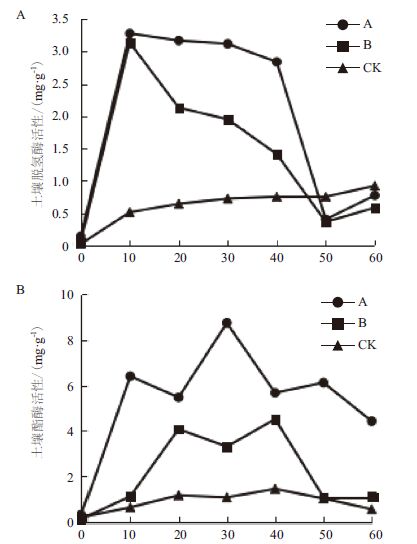
|
| 图 4 修复过程中土壤脱氢酶活性(A)和酯酶活性(B) 的变化 |
结合修复过程中TPH含量的测定以及石油烃各组分的累积降解率可知,各处理对石油烃各组分的降解程度排序为:饱和烃>芳香烃>极性物质和沥青质,说明相比较芳香烃和极性物质,饱和烃更容易被生物利用和降解,对于芳香烃的降解程度,处理B则高于处理A,表明加入外来菌可能对更难降解的石油烃组分有良好的去除效果。极性物质和沥青质因其在处理过程中含量略有增加,所以不能够计算出累积降解率,此现象在其他研究中也有报道[19]。
从实验结果分析可知,处理A和处理B对石油烃的去除效果高于对照CK组的原因并不是腐殖酸和外来菌剂的表面活性剂作用,而是由其他作用主导,如:营养条件、pH等,因为褐煤粉富含腐殖酸,可以产生表面活性剂,但其对土壤溶液的表面张力影响不够显著且处理B中添加的外来菌群可能与土壤中的土著菌存在竞争作用从而影响到表面活性剂的产生。
在修复前40 d,处理A土壤中总异养菌数和石油烃降解菌数在所有处理组中最大,说明诺沃肥的添加对土壤中微生物的数量起到了非常显著的积极作用,这与在修复过程中处理A对石油烃的去除率最高相吻合,表明诺沃肥的添加在促进土壤中微生物快速增长的同时,加强了土壤中石油烃的降解。在修复40 d之后,3个处理组中微生物数量均有不同程度的降低,但处理B降低幅度最小,其总异养菌数和石油烃降解菌数在3个处理组中达到最高,主要原因是处理B中添加有外源菌,它可以在修复前40 d利用易降解的石油烃组分,在修复后期可利用难降解的芳香烃组分,故后期微生物数量可维持较高水平。
实验开始时,处理A和处理B土壤中脱氢酶的活性显著高于对照CK,说明生物刺激和生物强化能有效的提高土壤中微生物的活性。在修复进行至40 d时,处理A和处理B土壤中脱氢酶活性明显降低,而对照CK趋于稳定,其原因是在修复后期伴随着营养助剂的消耗、易利用污染物的降解以及有毒代谢物的积累,造成微生物大量死亡,活性降低。整个修复过程中处理A和处理B中酯酶活性均显著高于对照CK组,其变化趋势为先迅速增高后突然降低,而后又大幅度增高且处理B酯酶活性始终低于处理A,一方面是因为处理A中添加的脂类化合物——诺沃肥被微生物利用;另一方面是处理B中添加的外来菌与土著菌产生竞争,对酯酶活性有消极影响。
4 结论生物刺激、生物强化修复技术对油污土壤的修复效果显著优于对照组CK,说明土壤中添加营养助剂或外来菌都能改善土壤中的营养条件,提高土壤中微生物数量和酶活性,从而促进石油烃的降解[20]。
通过比较生物刺激和生物强化两种修复方式的差异,可以设想将生物强化应用在生物刺激修复之后,使投加的外来菌尽量避免与土著菌发生竞争作用,可以最大程度提高石油烃降解效果。
修复过程中土壤含水率维持在45%左右,一方面含水率过高会影响土壤孔隙度、导致土壤通风不良、氧气浓度降低、从而影响石油降解菌的活性,导致菌群对石油烃降解效果下降;另一方面,水分是菌剂生命活动的必要物质,含水率为45%的土壤既能保证菌群生命代谢活动用水,又不影响土壤孔隙度。
| [1] | 张闻, 陈贯虹, 高永超, 等. 石油和重金属污染土壤的微生物修复研究进展[J]. 环境科学与技术, 2012, 35(12):174-181. |
| [2] | 唐金华, 于春光, 张寒冰, 等. 石油污染土壤微生物修复的研究进展[J]. 湖北农业科学, 2011, 50(20):4125-4128. |
| [3] | Luna JM, Rufino RD, Sarubbo LA, et al. Evaluation antimicrobial and antiadhesive properties of the biosurfactant lunasan produced by Candida sphaerica UCP0995[J]. Current Microbiology, 2011, 62(5):1527-1534. |
| [4] | 初建新. 大庆油田含油污泥对环境的影响及处理技术[J]. 内蒙古石油化工, 2014, 24(2):102-103. |
| [5] | SanthoskumarAU, DevarajanS, Palanivelu K, et al. A new additive formulation to improve biodegradation of low density polyethylene[J]. International Journal of ChemTech Research, 2014, 6(9):4194-4200. |
| [6] | 马超, 刘光全, 赵林, 等. 表面活性剂在油污土壤修复中的应用[J]. 污染防治技术, 2013, 26(5):55-59. |
| [7] | 张珍明, 林昌虎, 何腾兵, 等. 浅析石油污染土壤的微生物修复研究现状[J]. 贵州科学, 2010, 28(3):76-81. |
| [8] | 李春荣, 王文可, 曹玉清, 等. 石油污染物的微生物降解研究[J]. 生态环境, 2008, 17(1):113-116. |
| [9] | 祝威. 石油污染土壤和油泥生物处理技术[M]. 北京:中国石化出版社, 2010:33-34. |
| [10] | 王悦明, 王继富, 李鑫, 等. 石油污染土壤微生物修复技术研究进展[J]. 土壤修复, 2014, 18(4):157-163. |
| [11] | 焦海华, 黄占斌, 白志辉. 石油污染土壤修复技术研究进展[J]. 农业环境与发展, 2012, 12(2):48-54. |
| [12] | 屠明明, 王秋玉. 石油污染土壤的生物刺激和生物强化修复[J]. 中国生物工程杂志, 2009, 29(8):129-134. |
| [13] | 张海荣, 唐景春, 孙克静, 张清敏. 耐盐碱石油烃降解菌的筛选鉴定及其耐盐碱性研究[J]. 生物技术通报, 2015(1):151-159. |
| [14] | 陈莉, 苏莹, 刘兆普. 一株石油烃降解菌对原油的降解特性[J]. 安全与环境学报, 2011, 11(3):49-53. |
| [15] | 龙绛雪, 傅海燕, 高攀峰, 等. 生物-非离子型表面活性剂对土壤石油污染的去除[J]. 湖北农业科学, 2014, 53(6):1277-1280. |
| [16] | 张秀霞, 武海杰, 白雪晶, 等. 土壤修复过程中微生物数量和酶活性与石油降解率的关系[J]. 石油学报, 2014, 30(1):94-99. |
| [17] | 陈亮, 赵兰坡, 赵兴敏. 秸秆焚烧对不同耕层土壤酶活性和微生物数量以及土壤理化性状的影响[J]. 水土保持学报, 2012, 26(4):112-116. |
| [18] | 张晶, 张惠文, 张勤, 张成刚. 长期石油污水灌溉对东北旱田土壤微生物生物量及土壤酶活性的影响[J]. 中国生态农业学报, 2008, 16(1):67-70. |
| [19] | Oudot J, Merlin FX, Pinvidic P. Weathering rates of oil components in a biodegradation experiment in estuarine sediments[J]. Mar Environ Res, 1998, 45:113-125. |
| [20] | 张强, 郑立稳, 孔学, 等. 助剂对石油污染土壤生物修复的强化作用[J]. 山东科学, 2015, 28(1):78-81. |