2.海南大学农学院,海口 570228
2.College of Agriculture,Hainan University,Haikou 570228
甘蔗(Saccharum officinarum L.)是世界上一种重要的糖料作物和能源作物。培育高产、高糖、高抗的甘蔗新品种一直是甘蔗育种的主要目标。随着分子生物学的快速发展,转基因技术已成为甘蔗育种的重要方法。该技术通过将特定的基因导入甘蔗中,不仅可以使甘蔗的产量和品质性状得以提高,还能缩短育种的年限和周期[1]。目前,对转基因甘蔗植株的初步检测,国内外的实验室及检测部门运用最广泛的是PCR技术,该方法简便快捷,灵敏度高[2, 3]。然而对转基因甘蔗进行PCR鉴定的前提是必须提取甘蔗植株基因组DNA,目前提取DNA的方法有很多种,使用最多的主要有CTAB法[4]、SDS法[5]及其改良法[6]。这些方法提取DNA所需材料多,步骤繁琐,费时费力且纯化程序复杂,因此当需要检测的转基因植株较多时,这些方法显得不太适用[7, 8]。本实验拟研究出一种适用于转基因甘蔗检测的PCR 模板的快速制备方法。该方法快速制备PCR模板,无需DNA 提取过程,具有使用材料少,成本低、简便、快捷等优点。尤其适合材料比较宝贵的转基因甘蔗的预筛选和大样本量的PCR 检测,以期为转基因甘蔗分子育种的实际应用创造了条件。
1 材料与方法 1.1 材料 1.1.1 植物材料转KP4基因和转CryIAc-2A-gna融合基因甘蔗植株由本课题组利用农杆菌介导法获得,导入转基因植株的骨架载体为pCAMBIA3300,筛选基因为bar基因,对照植株为非转基因ROC-22植株。
1.1.2 主要试剂与仪器2×Taq MasterMix购自康为世纪生物科技有限公司;2000 bp DNA Ladder Maker(M1101)购自东盛生物公司;琼脂糖购自Sigma公司;NaOH、HCl、Tris-HCl等购自广州化学试剂厂,均为分析纯;PCR扩增仪T1 Thermocycle(Biome-tra);常温离心机(HETTICHD-78532);恒温水浴锅(浦光HH-4)。
1.2 方法 1.2.1 引物设计利用Primer Premier V 5.0分别设计合适引物,再利用Oligo V6.22对设计的引物进行评估排除引物之间的干扰,引物设计完成由上海生工合成(表 1)。
取甘蔗幼嫩叶片0.5 cm2左右剪碎,放入1.5 mL的Eppendorf管中,加入100 μL 0.25 mol/L的NaOH,将此离心管插入沸水中煮30 s,取出加入100 μL 0.25 mol/L的HCl和50 μL 1 mol/L Tris-HCl(pH 8.0)再将该管放入沸水中孵育2 min,室温条件下10 000 r/min离心2 min,取上清2 μL直接作为模板进行PCR反应。
1.2.3 单PCR检测甘蔗转基因成分以转KP4、CryIAc-2A-gna基因甘蔗的叶片浸出液为模板,分别用表 1中相应引物进行PCR反应。PCR反应体系:2×Taq MasterMix 10 μL,上下游引物各1 μL(10 μmol/L),模板2 μL,用ddHO将终体积调整到20 μL。KP4和bar基因PCR扩增的退火温度为60℃,CryIAc基因和CryIAc-2A-gna基因的退火温度为56℃,Shactin基因退火温度为52℃,所有基因的退火时间均为1 min,PCR结束后取10 μL PCR扩增产物进行1%的琼脂糖凝胶电泳检测。
1.2.4 多重PCR检测甘蔗转基因成分选取6株转基因甘蔗作为实验材料,阴性对照为非转基因植株ROC-22,ddHO作为空白对照,同时扩增KP4基因和bar基因及CryIAc-2A-gna基因、CryIAc基因和bar基因验证该方法在转基因甘蔗多重PCR检测上面的可靠性及适用性。(1)KP4基因、bar基因扩增体系:2×Taq MasterMix 10 μL,模板2 μL,KP4基因和bar基因上、下游引物各1 μL(10 μmol/L),用ddHO将终体积调整到20 μL。PCR扩增的退火温度为60℃,时间1 min,PCR结束后取10 μL PCR扩增产物进行1%的琼脂糖凝胶电泳检测。(2)CryIAc-2A-gna融合基因、CryIAc基因、bar基因扩增体系:2×Taq MasterMix 10 μL,模板2 μL,CryIAc-2A-gna融合基因、CryIAc基因及bar基因上下游引物各1 μL(10 μmol/L),用ddHO将终体积调整到20 μL。PCR扩增的退火温度为56℃,时间1 min,PCR结束后取10 μL PCR扩增产物进行1%的琼脂糖凝胶电泳检测。
1.2.5 碱处理叶片浸出液在不同温度下保存的DNA稳定性将模板分别保存室温、4℃、-20℃的环境下,分别于7、15和30 d,进行单PCR扩增CryIAc-2A-gna融合基因检测模板DNA的稳定性。
1.2.6 转基因甘蔗用量对PCR模板制备的影响以转KP4基因甘蔗幼嫩叶作为材料,嫩叶用量设置0.25、0.5、1、1.5、2和2.5 cm2 6个处理,用碱处理法制备PCR模板,制备方法同1.2.2,比较PCR扩增效果。
1.2.7 转基因甘蔗不同生长状态对PCR模板制备的影响分别选取转KP4基因甘蔗生长初期幼嫩叶、生长中期绿色叶、生长中后期泛黄叶及生长后期枯黄老叶作为实验材料,用碱处理法制备PCR模板,制备方法同1.2.2,比较PCR扩增效果。
2 结果 2.1 单PCR检测甘蔗转基因成分如图 1所示,以碱处理的叶片浸出液为模板,不同基因引物进行单PCR反应扩增甘蔗转基因成分及内源基因,均能扩增出与目的基因预期大小相符的基因片段。

|
| M:DL2000 DNA Maker;1:KP4 基因;2:bar 基因;3:CryIAc-2A-gna 融合基因;4 :CryIAc 基因;5 :甘蔗内源基因Shactin 基因;6 :ddH2O 图 1 单PCR 检测甘蔗转基因成分电泳结果 |
如图 2-A所示,以CTAB法提取的模板为阳性对照,6株转KP4基因植株碱处理的叶片浸出液为模板,同时加入KP4基因及bar基因引物,均能扩增出与阳性对照大小相同的基因片段。如图 2-B所示,以转CryIAc-2A-gna基因植株碱处理的叶片浸出液为模板,同时加入CryIAc基因、bar基因及CryIAc-2A-gna基因引物,均扩增出了与阳性对照大小相同的基因片段。

|
| M :DL2000 DNA Maker ;1 :CTAB 法阳性对照;2 :非转基因ROC-22 ;3 :空白对照H2O ;4-9 :转基因甘蔗,A :转KP4 基因甘蔗多重PCR ;B :转CryIAc-2A-gna 基因甘蔗多重PCR 图 2 多重PCR 反应检测甘蔗转基因成分电泳结果 |
碱处理的叶片浸出液分别保存于常温、4℃、-20℃条件下,3种条件下保存7 d的模板均能扩增出目的基因片段且扩增结果无显著差异(图 3-A);室温保存15 d的模板有部分扩增产生了杂带,未能扩增出目的基因片段,而4℃、-20℃保存的模板均能扩增出特异的目的基因片段(图 3-B);室温保存30 d的模板均扩增出非特异条带,未能扩增目的基因片段,4℃、-20℃保存的模板仍可扩增出特异的目的基因片段(图 3-C)。
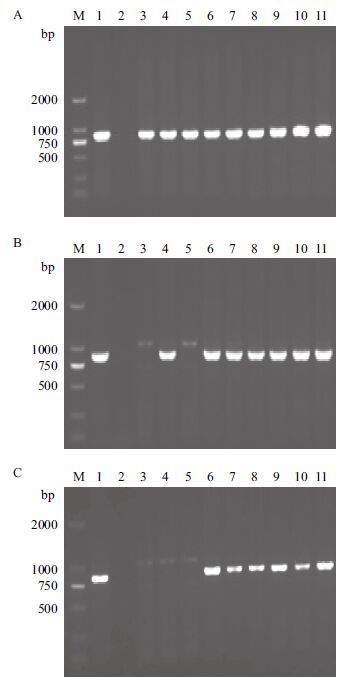
|
| M :DL2000 DNA Maker ;1 :鲜叶片;2 :H2O ;3-5 :常温;6-8 :4℃ ;9-11 :-20℃ 图 3 模板DNA 在不同温度下保存7 d(A)、15 d(B)和30 d(C)的PCR 扩增电泳图 |
如图 4所示,对样品不同生长状态下的叶片制备的模板进行KP4基因及bar基因的扩增结果表明,幼嫩叶扩增条带最亮,随着叶片的老化,扩增条带渐暗,叶片成枯黄时虽能扩增条带,但条带已很模糊。对不同样品用量制备的模板进行KP4基因(图 4-A)及bar基因(图 4-B)的扩增结果表明:取0.25 cm2左右的嫩叶剪碎制取的模板扩增条带较不清晰,叶面积在0.50-2.5 cm2 之间制备的模板扩增结果无显著差异。

|
| A :KP4 基因扩增;B :bar 基因扩增。M :DL 2000 DNA Maker ;1 :嫩叶;2 :绿叶;3 :泛黄叶;4 :枯黄叶;5 :0.25 cm2 嫩叶;6 :0.50 cm2 嫩叶;7 :1cm2 嫩叶;8 :1.5 cm2 嫩叶;9 :2.0 cm2 嫩叶;10 :2.5 cm2 嫩叶 图 4 样品不同生长状态及不同用量所制取模板的PCR 扩增图 |
本研究的出发点是为大批量的转基因甘蔗建立一种简便、快捷的检测方法,为甘蔗分子育种工作奠定基础。运用本实验的方法仅需要取幼嫩叶片微量的叶尖即可进行上百次的PCR反应,同时碱处理法制备PCR模板仅需加热和中和两个过程,区别于传统的CTAB法和SDS法,可以省去低温研磨、DNA抽提等繁琐步骤,虽然此方法制备的模板可能含有蛋白质、盐类等杂质,但通过实验对单基因和多基因扩增实验反复验证,证明其在转基因检测中的可靠性。该方法在转基因水稻[9, 10]、小麦[11]检测中已有相关文献报道,并在检测中得到了实际运用。针对甘蔗快速制备PCR模板的方法之前已有文献报道,如陈忠良等[12]用于甘蔗SSR-PCR模板制备采用的改良SDS法、DNA快速提取法;陈平华等[13]快速制备大批量甘蔗模板的碱裂解叶片法等。陈忠良等采用的改良SDS法在传统SDS法基础上进行了操作步骤的简化,DNA快速提取法则是直接用提取液来处理甘蔗叶片,之后在处理液中加入蛋白酶K进行水浴和冰浴处理,离心取上清并加入RNaseA,最后即可制取模板。这两种方法与本实验的碱裂解法相比操作步骤相对繁琐,成本较高,但其具有制取的模板所含杂质较少的优点。陈平华等[13]采用的碱裂解叶片法与本实验的方法有许多相似之处,但是采用的裂解液与中和液有明显区别,其所用裂解液为KOH与Tween-20的混合液,中和液为Tris-HCl与EDTA的混合液,而本实验采用的裂解液NaOH溶液,中和液为HCl和Tris-HCl。陈平华等的方法与本实验方法相比所用试剂较多,成本较高但与本实验扩增效果无明显差别。
实验在样品不同生长状态下制备模板扩增结果表明,幼嫩叶较宜制备模板。其原因可能是幼嫩叶所含DNA量大,加热处理细胞易破裂,而随着叶片的衰老,其体内的DNA出现了一定程度的降解,同时DNA从细胞中释放的难度也有所加大。对样品用量研究表明,0.5 cm2左右嫩叶就能满足实验的要求,且随着样品用量的增加模板扩增结果并无显著变化。其原因可能是在提取试剂一定的情况下,样品量的加大并不能使制取的模板量增大。对模板稳定性的研究结果表明,如果模板放置于室温条件下稳定性较差,其主要原因可能是室温条件,利于菌类生长,导致模板的降解。4℃、-20℃的条件较常温不利于菌的生长,同时较低的温度更有利于稳定模板DNA的结构,一般能保存较长时间。本实验对条件的摸索确定将为后期的研究工作奠定基础,提供参考。
4 结论以转基因甘蔗叶片为材料,0.5 cm2左右嫩片经碱并短暂高温处理,再中和,形成裂解混合物。直接以此为模板,转基因甘蔗外源基因及内源基因基因扩增结果稳定、准确、重复性强。用此方法制备的模板室温下2周之内,4℃、-20℃下一个月之内结果不变。本方法制备的甘蔗叶组织模板可用于后续转基因甘蔗检测。
| [1] | 甘仪梅, 张树珍, 曾凡云, 等. 甘蔗转基因育种研究进展[J]. 生物技术通报, 2013(3):1-9. |
| [2] | 郭斌, 祁洋, 尉亚辉. 转基因植物检测技术的研究进展[J]. 中国生物工程杂志, 2010, 2:120-126. |
| [3] | Gachet E, Martin GG, Vigneau F, et al. Detection of genetically modified organisms(GMOs)by PCR:a brief review of methodologies available[J]. Trends in Food Science & Technology, 1998, 9(11):380-388. |
| [4] | Murray MG, Thompson WF. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research, 1980, 8(19):4321-4326. |
| [5] | 单志, 吴宏亮, 李成磊, 等. 改良SDS法提取多种植物基因组DNA研究[J]. 广东农业科学, 2011, 8:113-115. |
| [6] | 王英, 邱海燕, 高和琼, 等. 甘蔗基因组DNA提取方法的研究[J]. 中国农学通报, 2008, 12:44-49. |
| [7] | Lodhi MA, Ye GN, Weeden NF, et al. A simple and efficient method for DNA extraction from grapevine cultivars andVitis species[J]. Plant Molecular Biology Reporter, 1994, 12(1):6-13. |
| [8] | Aljanabi SM, Martinez I. Universal and rapid salt-extraction of high quality genomic DNA for PCR-based techniques[J]. Nucleic Acids Research, 1997, 25(22):4692-4693. |
| [9] | 桑贤春, 何光华, 张毅, 等. 水稻PCR扩增模板的快速制备[J]. 遗传, 2003, 6:705-707. |
| [10] | 张启军, 吕川根, 宗寿余, 等. 一种快速检测水稻外源基因的方法[J]. 分子植物育种, 2007, 5:729-734. |
| [11] | 汪秀峰, 杨剑波, 吴丽芳, 等. 小麦叶片直接用于PCR和RAPD反应的方法[J]. 遗传, 2002, 3:332-334. |
| [12] | 陈忠良, 秦翠鲜, 郭元元, 等. 一种适用于甘蔗SSR-PCR的DNA快速提取方法[J]. 广西农业科学, 2010, 11:1155-1157. |
| [13] | 陈平华, 王恒波, 许莉萍, 等. 碱裂解叶片两步快速制备PCR模板技术研究[J]. 热带作物学报, 2010, 3:422-429. |





