2.同济大学附属东方医院,上海 200085
2. Oriental Hospital Affiliated to Tongji University,Shanghai 200085
单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)是一种全世界流行的疱疹性疾病病原体[1]。HSV-1基因组152 kb的双链DNA,编码76个以上的病毒蛋白。HSV-1主要感染人的口腔、皮肤黏膜、眼粘膜及中枢神经系统,引起龈口炎、唇疱疹、咽炎、角膜炎和疱疹性脑炎,而HSV-1引发的脑炎对人类健康危害最为严重[2]。近年来我国HSV-1感染发病率迅速上升,由其所引起的单纯疱疹病毒性脑炎(herpes simplex encephalitis,HSE)约占脑炎病例的5%-20%,占病毒性脑炎病例的20%-68%[3]。然而,HSV-1引发脑炎的病理机制尚不十分清楚。已有研究表明HSV-1 感染后,病毒Us11 蛋白在拮抗宿主先天免疫反应中发挥重要作用。Us11能拮抗Ⅰ 型干扰素刺激产生的抗病毒蛋白PKR、2'-5'寡腺苷酸合成酶;此外HSV-1 Us11 蛋白能隔离dsRNA,阻断了dsRNA激活PKR[2, 4, 5]。为了研究HSV-1利用Us11拮抗宿主抗病毒免疫应答的机制,本研究分别构建Us11原核和真核表载体统,原核表达Us11蛋白并制备Us11兔源多克隆抗体,通过间接免疫荧光(IFA)、免疫印迹(Western blot)实验鉴定Us11真核表达载体转染细胞并表达Us11蛋白。
1 材料与方法 1.1 材料 1.1.1 细菌、细胞和实验动物大肠杆菌DH5α、BL21(DE3)由本实验室保存;293T细胞由本实验室保存;新西兰大耳白实验兔购自上海斯莱克实验动物中心。
1.1.2 主要试剂与耗材原核表达载体pCold Ⅰ和真核表达载体pFLAG 7.1由本实验室保存;Us11基因、核苷酸引物和序列测定由上海桑尼生物完成;Taq DNA聚合酶、T4连接酶、限制性内切酶、DNA纯化试剂盒、DNA标准分子量marker购自TaKaRa(大连)公司;标准蛋白marker(普通及预染)购自Fermentas公司;异丙基-β-D 硫代半乳糖苷(IPTG)购自Sigma公司;弗氏完全佐剂(FCA)和弗氏不完全佐剂(FICA)购自Sigma公司;质粒小量/大量抽提试剂盒购自Axygen公司;His标签蛋白纯化预装柱购自GE公司;3 kD蛋白超滤管购自Millipore 公司;羊抗兔IgG-HRP、羊抗兔IgG-FITC购自CTL公司;West Pico化学发光试剂盒购自Thermo scientific公司;Lipofectamine® 3000购自Invitrogen公司,其他试剂均为进口或国产分析纯。
1.2 方法 1.2.1 HSV-1 Us11基因扩增通过NCBI数据库查询Human herpesvirus 1 strain F Us11基因(GenBank:GQ999614.1),根据序列合成Us11全长基因。
根据合成的Us11基因序列,在全长Us11两端设计PCR引物序列,引物5'末端引入酶切位点。引物序列如下:
上游引物:5'-GGCAAGCTT atgagccagacccaaccc-ccg-3'(下划线为Hind Ⅲ酶切位点),下游引物:5'-GGCGAATTCctatacagacccgcgagccg-3'(下划线为EcoR Ⅰ酶切位点)。
以合成的Us11基因为模板,扩增Us11基因用于表达载体克隆。PCR反应体系为:95℃5 min;95℃ 30 s,54℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min。扩增产物经1%琼脂糖凝胶电泳分析,切胶回收目的片段。
1.2.2 pCold-Us11原核表达载体构建将pCold Ⅰ载体和Us11回收片段分别用Hind Ⅲ、EcoR Ⅰ双酶切,回收纯化后使用T4 DNA连接酶连接过夜,转化大肠杆菌DH5α感受态细胞后涂布于LB/Amp 平板培养,挑取克隆进行PCR、酶切和测序鉴定,将鉴定正确的质粒命名为pCold-Us11。
1.2.3 Us11蛋白的诱导表达和纯化将重组质粒转化宿主表达菌BL21(DE3)感受态细胞,挑取单菌落接种至LB/Amp液体培养基,37℃振荡培养过夜。次日以1∶100比例转接至新鲜LB/AMP培养基中,37℃振荡培养2-3 h,OD600值到达0.6时取出,冷却至15℃时加入IPTG至终浓度为0.1 mmol/L,15℃振荡培养24 h。诱导后的菌液冷却后离心收集菌体,PBS(0.1 mmol/L PMSF)重悬,在冰浴中超声波破碎,12 000 r/min 4℃离心后分别收集裂解后的沉淀和上清,加入5X电泳上样缓冲液,100℃煮沸5 min后进行SDS-PAGE电泳,分析目的蛋白可溶性表达情况。同时设置pCold Ⅰ空载体质粒转化BL21(DE3)宿主菌和BL21(DE3)空菌同步诱导作为对照。
将重组菌单克隆按上述方法接种扩大培养,超声波裂解菌体后获得上清,按照HisTrap FF Crude操作手册纯化蛋白,然后使用3 kD蛋白超滤管3 500 r/min 4℃浓缩蛋白。浓缩蛋白通过SDS-PAGE鉴定并使用分光光度计测定浓度,分装,-80℃保存备用。
1.2.4 Us11兔源多克隆抗体的制备取纯化后Us11蛋白,加入等体积的佐剂,充分乳化,皮下多点注射免疫健康的新西兰大耳白兔,每只每次免疫蛋白量为100 µg。基础免疫使用福氏完全佐剂,加强免疫使用福氏不完全佐剂,每次免疫间隔2周,共免疫3次。第3次免疫后2周,对兔子心脏采血,分离血清,分装,-20℃保存备用。
1.2.5 pFLAG-Us11真核表达载体的构建和扩增将pFlag 7.1载体和Us11回收片段分别用Hind Ⅲ、EcoR Ⅰ双酶切,回收纯化后使用T4 DNA连接酶连接过夜,转化大肠杆菌DH5α感受态细胞后涂布于LB/Amp 平板培养,挑取阳性克隆进行PCR、酶切和测序鉴定,将鉴定正确的质粒命名为pFLAG-Us11。
挑取重组菌单克隆接种至LB/Amp液体培养基扩大培养,收获菌体使用质粒大量提取试剂盒提取pFLAG-Us11质粒,分装-20℃保存备用。
1.2.6 IFA检测293T细胞表达Us11蛋白将293T细胞接种于24孔细胞板,待细胞生长至70% 时将pFLAG-Us11质粒按照Lipofectamine® 2000操作手册转染细胞,质粒 500 ng/孔。培养48 h后取出细胞板,用PBS温和清洗细胞,加入4%多聚甲醛4℃固定细胞30 min,清洗后用0.1% TritonX-100室温透化细胞5 min,清洗细胞弃多余液体。以制备的Us11兔抗血清为一抗,按1∶1 000稀释加入细胞37℃孵育1 h。PBS清洗细胞4遍,以羊抗兔IgG-FITC为二抗,1∶1 000稀释加入细胞37℃孵育1 h。PBS清洗细胞4遍,在荧光显微镜下观察细胞。
1.2.7 Western blot检测pFLAG-Us11转染细胞表达Us11蛋白将293T细胞接种于24孔细胞板,待细胞生长至70%时将pFLAG-Us11质粒按照Lipofectamine® 2000操作手册转染细胞,质粒 500 ng/孔。培养48 h后取出细胞板,用PBS温和清洗细胞,加入RIPA裂解液充分反应后吸取裂解液4将293T细胞 12 000 r/min离心10 min。获取上清蛋白液进行SDS-PAGE,取下凝胶在在半干转印仪中转移至PVDF膜,恒压20 V转移20 min。取出PVDF膜在含5%脱脂乳的TBST中4℃封闭过夜。次日用PBST洗两遍,Us11兔抗血清用封闭液按1∶500稀释后加到PVDF膜上,室温缓慢摇晃2 h。取出膜用PBST摇晃洗涤3遍,每次10 min。1∶5 000稀释的羊抗兔IgG-HRP作为二抗,室温缓慢摇晃1 h,同样用PBST摇晃洗涤3遍,最后用ECL化学发光试剂盒显色,在胶片上曝光。
2 结果 2.1 pCold-Us11原核表达载体构建和鉴定根据GenBank收录的Human herpesvirus 1 strain F Us11基因序列设计一对特异性引物,从合成的基因模板扩增出Us11全长475 bp(图 1),连接到pCold Ⅰ载体。重组质粒经PCR鉴定和Hind Ⅲ、EcoR Ⅰ双酶切鉴定(图 1)。重组质粒测序结果显示,Us11基因序列和GenBank中的Human herpesvirus 1 strain F Us11序列一致。证明pCold Ⅰ-Us11原核表达载体构建成功。

|
| M1:DL2000 marker;M2:DL15000 marker;1:空白;2:US11基因PCR扩增的结果;3:空白;4:PCR鉴定重组;5:通过Hind Ⅲ、EcoR Ⅰ双酶切鉴定pCold Ⅰ;6:通过Hind Ⅲ、EcoR Ⅰ双酶切鉴定pCold Ⅰ-Us11原核表达载体 图 1 Us11基因扩增和pCold-Us11原核表达载体酶切鉴定 |
在IPTG诱导下,pCold Ⅰ-Us11在BL21(DE3)中可溶性表达,目的蛋白17.4 kD(图 2)。大量表达后经过镍离子柱纯化并进行浓缩,蛋白液浓度为1.6 mg/mL。收获的Us11蛋白和佐剂充分乳化后多点免疫大耳白兔,免疫3次后采集抗血清,用于真核表达载体pFLAG-Us11转染细胞表达鉴定分析。

|
| M:蛋白marker;1:pCold Ⅰ空载体质粒转化BL21(DE3)宿主菌对照;2:BL21(DE3)空菌同步诱导对照;3:pCold Ⅰ-Us11转化BL21(DE3)宿主菌诱导表达;4:经纯化的表达蛋白 图 2 pCold Ⅰ-Us11在BL21(DE3)中的表达 |
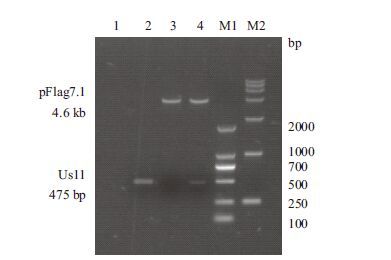
将PCR扩增出的Us11全长基因片段连接到pFlag7.1载体,重组质粒经PCR鉴定和Hind Ⅲ、EcoR Ⅰ双酶切鉴定(图 3)。重组质粒测序结果显示,Us11基因序列和GenBank中的Human herpesvirus 1 strain F Us11序列一致。证明pFlag7.1-Us11真核表达载体构建成功。
|
| 1:空白;2:PCR鉴定重组;3:通过Hind Ⅲ、EcoR Ⅰ双酶切鉴定pFlag7.1;4:通过Hind Ⅲ、EcoR Ⅰ双酶切鉴定pFlag7.1-Us11真核表达质粒;M1;DL2000 marker;M2:DL15000 marker 图 3 pFLAG-Us11真核表达载体酶切鉴定 |
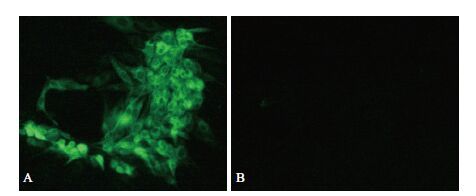
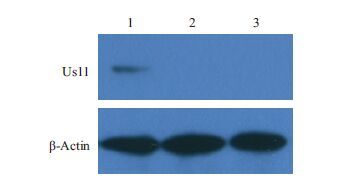
鉴定正确的重组菌单克隆扩大培养,大量抽提质粒后瞬时转染293T细胞,以制备的Us11兔血清为一抗进行FIA检测,用荧光显微镜观察,可见转染pFLAG-Us11重组质粒的细胞绿色荧光弥散分布整个胞浆,而转染pFlag7.1空载体的细胞未见免疫荧光(图 4)。同时,将pFLAG-Us11质粒瞬时转染细胞培养后裂解获取上清,SDS-PAGE后转印至PVDF膜,以制备的Us11兔血清为一抗进行Western blot检测,结果(图 5)显示,重组质粒表达产物在17.4 kD处产生特异性条带,而对照组无免疫印迹。实验表明,上述制备的Us11兔多抗能鉴定pFLAG-Us11在细胞中的真核表达。
|
| A:转染pFlag7.1-Us11重组质粒的293T细胞与兔US11免疫血清的反应荧光图(100×);B:转染pFlag7.1空载体的293T细胞与兔US11免疫血清的反应荧光图(100×) 图 4 IFA检测Us11蛋白真核表达 |
|
| 1:pFLAG-Us11的表达;2:pFlag7.1的表达;3:空白 图 5 Western blot检测Us11蛋白真核表达 |
HSV-1原发感染后机体很快产生特异性的免疫力,清除大部分病毒从而使症状消失。也有少数病毒可长期潜伏在神经节中的神经细胞内,但不产生临床症状[2, 3, 6],当机体免疫力低下时,病毒引起复发性局部疱疹。疫苗和抗病毒药物依然是预防和治疗HSV-1感染的最佳选择,但HSV-1的疫苗研制多处于研究阶段[5, 7, 8, 9]。葛兰素史克公司(Glaxo Smith Kline,GSK)研制的HSV糖蛋白D(gD-2)的亚单位疫苗实验表明只对HSV-1和HSV-2血清阴性的女性有效,而对男性和HSV-1血清阳性的女性群体免疫效果不佳。Chiron公司研发的HSV-2糖蛋白B(gB-2)和gD-2联合亚单位疫苗因免疫后虽然能产生抗体,但不能抑制对HSV-2的感染,最终停止了研究[5, 6, 10]。广泛使用阿昔洛韦(acyclovir,ACV)导致HSV耐药毒株自1982年就已出现,在免疫系统正常的HSV患者中感染ACV耐药毒株比例在0.6%以下,而免疫缺陷的患者中ACV耐药毒株比例高达3%-6%,骨髓移植受体HSV患者的耐药毒株比例达14%。目前仍无用于临床安全有效的HSV-1疫苗,其重要原因是HSV-1感染宿主后的致病机制及病毒逃避宿主免疫反应的机制还不完全清楚[7]。
类似于大多数病毒,HSV-1进化出多种策略对抗宿主的先天免疫反应,如干扰IFN信号途径和IFN刺激基因的抗病毒功能,抑制病毒感染细胞的凋亡利于病毒复制等机制[11]。在HSV-1复制周期早期阶段病毒能够抑制干扰素刺激基因转录产物的积聚,这是通过早期蛋白ICP0抑制IRF3介导的ISGs的转录激活[12]。值得注意的是,HSV-1感染晚期,能够在IFN处理的细胞内复制而不会激活RNase L介导的抗病毒反应途径。HSV-1 感染后Us11 蛋白能抑制2'-5'寡腺苷酸合成酶(2'-5'OAS)的合成,2'-5'OAS/RNase L途径是IFNs刺激的经典抗病毒先天免疫反应。Us11蛋白RNA结合结构域是抑制OAS必需的。已有研究报道Us11能抑制PKR和PACT介导的抗病毒途径,其中研究较多的是HSV-1拮抗Ⅰ 型IFN刺激产生的抗病毒蛋白PKR、2'-5'寡腺苷酸合成酶。PKR是宿主重要抗病毒蛋白,能抑制HSV-1的复制[13]。目前研究表明,HSV-1抑制PKR的抗病毒功能至少涉及两种机制。HSV-1 L蛋白ICP34.5 能提高蛋白磷酸酶1(PP1)的表达,阻断PKR介导的磷酸化eIF2进程,从而干扰PKR-eIF2抗病毒途径。此外,HSV-1 Us11 蛋白能隔离dsRNA,阻断dsRNA激活PKR。Us11 和ICP34.5 蛋白在对抗IFNs的抗病毒功能中发挥作用。而且Us11还能抑制 2'-5'寡腺苷酸合成酶抗病毒系统[14, 15]。Us11能结合RNA,干扰TLR3和RLR对dsRNA的识别作用。
4 结论本研究运用分子生物学方法,表达了Us11蛋白并免疫兔子制备了多克隆抗体,并使用该抗体对Us11的真核表达进行了鉴定,为深入研究HSV-1 Us11拮抗宿主先天免疫反应提供有价值的技术手段和实验材料。
| [1] | 郑秀峰, 韩金祥. 单纯疱疹病毒研究现状[J]. 中国麻风皮肤病杂志, 2008, 24(5):370-373. |
| [2] | 姚建婷, 晋安. HSV及其实验室检测研究进展[J]. 安徽卫生职业技术学院学报, 2010, 9(1):88-89. |
| [3] | 蔡晓辉, 张钦宪. 单纯疱疹病毒Ⅰ型基因治疗载体的快速构建[J]. 中国组织工程研究与临床康复, 2011, 15(41):7701-7705. |
| [4] | 李深, 任哲, 王巧利, 等. 单纯疱疹病毒1型US12基因siRNA筛选及其对病毒增殖的影响[J]. 中国病理生理杂志, 2011, 27(3):528-532. |
| [5] | Wang L, Ren XM, Xing JJ, et al. The nucleolus and viral infection[J]. Virologica Sinica, 2010, 25(3):151-157. |
| [6] | Ren Z, Zhang CH, Wang LJ, et al. In vitro anti-viral activity of the total alkaloids from Tripterygium hypoglaucum against herpes simp-lex virus type 1[J]. Virologica Sinica, 2010, 25(2):107-114. |
| [7] | Lin A, Xu H, Yan W. Modulation of HLA expression in human cytomegalovirus immune evasion[J]. Cellular & Molecular Immunology, 2007, 4(2):91-98. |
| [8] | Cao H, Zhang GR, Geller AI. Antibody-mediated targeted gene transfer to NMDA NR1-containing neurons in rat neocortex by helper virus-free HSV-1 vector particles containing a chimeric HSV-1 glycoprotein C-staphylococcus A protein[J]. Brain Research, 2010, 1351:1-12. |
| [9] | Cao H, Zhang GR, Geller AI. Antibody-mediated targeted gene transfer of helper virus-free HSV-1 vectors to rat neocortical neurons that contain either NMDA receptor 2B or 2A subunits[J]. Brain Research, 2011, 1415:127-135. |
| [10] | Yan Z, Wang JW, Ma B, et al. Cloning and sequence analysis of US1gene in duck enteritis virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2011, 33(2):105-109. |
| [11] | Bryant-Hudson KM, Chucair-Elliott AJ, Conrady CD, et al. HSV-1 targets lymphatic vessels in the eye and draining lymph node of mice leading to edema in the absence of a functional type I interferon response[J]. The American Journal of Pathology, 2013, 183(4):1233-1242. |
| [12] | Bigley NJ. Complexity of Interferon-gamma Interactions with HSV-1[J]. Frontiers in Immunology, 2014, 5:15. |
| [13] | Bryant-Hudson K, Conrady CD, Carr DJ. Type I interferon and lymphangiogenesis in the HSV-1 infected cornea - are they beneficial to the host?[J]. Progress in Retinal and Eye Research, 2013, 36:281-291. |
| [14] | Xing J, Wu F, Pan W, et al. Molecular anatomy of subcellular localization of HSV-1 tegument protein US11 in living cells[J]. Virus Research, 2010, 153(1):71-81. |
| [15] | Awasthi S, Belshe RB, Friedman HM. Better neutralization of herpes simplex virus type 1(HSV-1)than HSV-2 by antibody from recipients of GlaxoSmithKline HSV-2 glycoprotein D2 subunit vaccine[J]. The Journal of Infectious Diseases, 2014, 210(4):571-575. |




