羧肽酶(carboxypeptidases,CPs)是一种专一性地从肽链的C端逐个降解、释放游离氨基酸的一类肽链外切酶。主要分为丝氨酸羧肽酶(EC 3.4.16-)、金属羧肽酶(EC 3.4.17-)和半胱氨酸羧肽酶(EC 3.4.18-)3个亚类。羧肽酶广泛应用于医药、食品等工业领域。在食品工业,可用于制备高F值寡肽[1],食品和饲料中赭曲霉素的去除[2]、用作脱苦味剂[3]等。动物来源的羧肽酶主要存在于猪、牛等的胰脏中,如羧肽酶A/B(carboxypeptidaseA/B),其数量非常有限、价格昂贵、导致其应用受到限制。微生物来源的羧肽酶存在于酵母、曲霉等真菌的液泡中,具有广阔的应用前景,但后期纯化及大量获得仍然存在困难。因此,借助基因工程策略采用微生物为宿主大量生产重组羧肽酶,有助于进一步降低生产成本、提高产品质量、深化酶学性质研究、扩展应用范围。赵莹[4]完成了猪羧肽酶A1酶原在毕赤酵母中的表达,易静等[5]完成了人羧肽酶A1的毕赤酵母可溶表达,为进一步研究CPA1 在抗体导向酶-前体药物疗法中的应用奠定了基础。
赭曲霉毒素A(Ochratoxin A,OTA)是由曲霉属(Aspergillus spp.)和青霉属(Penicillium spp.)等霉菌产生的次级代谢产物,属于聚酮类化合物,主要存在于谷物及其副产品中[6]。OTA具有强烈的肾脏毒性和肝脏毒性,并有致畸、致突变和致癌作用[7],对动物和人体健康有很大的潜在危害,研究OTA的脱毒对人类健康生活至关重要。1969年Pitiou[8]用薄层层析和光谱方法就发现羧肽酶(CPA)能将赭曲霉毒素A降解为OTα和L-苯丙氨酸。Deberghes[9]在含有赭曲霉的液体培养基(50 mL)中分别加入100 µL的1、2、5 U的牛胰脏羧肽酶A,结果发现1 U羧肽酶A降解率为17%,2 U羧肽酶A降解率为49%,5 U羧肽酶A降解率达了100%。本实验所用菌由师磊等[10]证明具有降解赭曲霉毒素A效果。
巴斯德毕赤酵母表达系统是应用广泛而成功的蛋白表达系统。与其他真核蛋白及原核蛋白表达系统相比,具有以下优点[11]:(1)生长速度快,易实现高密度发酵;(2)可生产分泌型蛋白,方便收集及纯化;(3)可避免内毒素及噬菌体污染;(4)可进行蛋白的翻译后修饰,包括多肽的折叠、糖基化、甲基化等;(5)有良好的酵母表达载体,如pPIC 9K、pPICZα、pMET B等。外源蛋白的表达条件如诱导时间、pH、碳源、诱导剂浓度等对目标蛋白的产量及活性影响较大。优化培养条件可有效提高外源蛋白含量。
响应面法(Response surface methodology,RSM)是以多元二次回归数学模型为工具,描述相互作用的实验因子与响应值之间的关系的数据处理方法。响应面法能有效地找到因素间的最优组合,相比于传统的全因子实验设计,该法能在更为经济的试验次数下,得到精确的统计结果,具有周期短、精确度高等优点。因此,本研究利用单因素实验,初步优化了培养基成分,诱导pH值、诱导前菌体OD600值和甲醇含量。在单因素实验的基础上,利用响应面法优化实验对初始诱导pH值、诱导前菌体OD600值和甲醇含量三因素对牛胰脏羧肽酶A表达量的影响进行研究,分析各因素的变化规律,以期获得牛胰脏羧肽酶A表达的最佳条件。
1 材料与方法 1.1 材料重组巴斯德毕赤酵母Pichia pastoris(GSll5/pPIC9K/proCPA,His+,Mut+,本实验室构建、保存(牛胰脏ProCPA基因(Accession No.NM_174750)由北京奥科鼎盛有限公司依据P.pastoris对密码子的偏爱性进行密码子优化);Werstern Blot 实验中的His 标签小鼠单克隆抗体、AP标记的山羊抗小鼠IgG抗体均购自Abcam;BCIP/NBP显色液购自Amresco;培养基试剂购自北京奥博星生物技术有限责任公司;其余试剂均为分析纯。
1.2 方法 1.2.1 菌株活化将毕赤酵母重组菌株在新鲜YPD平板上划线,于30℃倒置培养2 d。
1.2.2 种子培养从YPD平板挑取单菌落接种到50 mLYPD培养基中,30℃和200 r/min 振荡培养过夜,然后接入50 mL BMGY培养基中继续培养至OD600达6.0-8.0。
1.2.3 牛proCPA基因的表达250 μL种子培养液接种于25 mL BMGY(13. 4 g /L YNB,4 ×10- 5 g /L 生物素,100 mL /L 磷酸缓冲液,10 mL /L 甘油)培养液中。于28℃,250 r /min 的速度振摇至菌浓度为所需的OD600。离心收集菌体弃去BMGY培养液,用25 mL 改良BMMY(13. 4 g /L YNB,4 ×10- 5g /L 生物素,100 mL /L 磷酸缓冲液,1% 山梨醇,所需的甲醇浓度)培养液。于28℃,250 r /min 的速度振摇,开始诱导表达,每12 h或24 h 补充甲醇。于24、48、72、96、120 h 分别取1 mL 上清液。
1.2.4 发酵产物分析每天收集1 mL的发酵上清液,测量OD值,4℃,10 000 r/min离心5 min,取出上清,-20℃保存,备检。
1.2.5 表达上清检测对上清中的蛋白进行SDS-PAGE、Western Blot验证及纯化。利用Bradford法,结合标准曲线对表达上清中的蛋白含量进行分析。980 μL考马斯亮蓝G250中加入20 μL的表达上清,充分混匀。室温反应2 min,测定595 nm处的吸光值。依据标准曲线,计算蛋白浓度。
SDS-PAGE 分析:配制12% 分离胶和5% 浓缩胶,取上述样品40 μL,加入10 μL 5×Loading Buffer,混合制样。每孔上样30 μL,浓缩胶电压80 V,分离胶电压120 V。电泳结束后,ddH2O冲洗后,在考马斯亮蓝染色液中振荡染色40 min,然后用ddH2O 反复冲洗,放入脱色液(10% 的乙酸)中脱色,直至背景清晰,此过程需不定时更换脱色液。
Western Blot 验证:将SDS-PAGE电泳结束后未染色的胶,电转至NC膜上;加入封闭液(5%的BSA溶于TBST中)室温振荡孵育1 h;TBST振荡洗涤6次,每次5 min;加入TBST溶液稀释的His标签的鼠源一抗,4℃孵育过夜(12-16 h);TBST振荡洗涤6次,每次5 min;加入TBST溶液稀释的AP标记的羊抗鼠二抗,室温振荡孵育1 h;TBST振荡洗涤6次,每次5 min;加入BCIP/NBP显色液,避光显色5-10 min,肉眼观察结果。
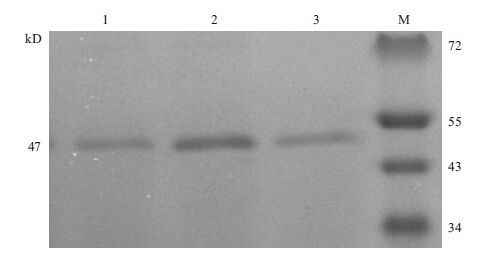
2 结果 2.1 目的蛋白SDS-PAGE、Western Blot验证及纯化含重组质粒(pPIC9K/proCPA,His+,Mut+)的巴斯德毕赤酵母GS115菌株经甲醇诱导后在47 kD左右有明显的蛋白条带(图 1),与目的蛋白大小符合。经Western Blot分析为目的蛋白(图 2)。
|
| M:蛋白质marker;1:1.0%甲醇含量每24 h补加;2:0.5%甲醇含量每24 h补加;3:1.0%甲醇含量每12 h补加 图 1 目的蛋白的SDS-PAGE验证 |

|
| 甲醇含量每12 h补加;2:1.0%甲醇含量每24 h补加;3:0.5%甲醇含量每24 h补加 图 2 目的蛋白的Western Blot验证 |
用BSA制作蛋白标准液,根据不同蛋白浓度绘制蛋白浓度(mg/mL)-吸光度A的标准曲线。经数据处理分析获得蛋白质标准曲线回归方程为:y=0.4837x+0.2068,R2=0.9931。
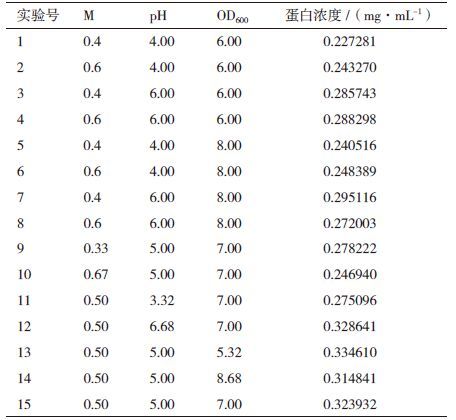
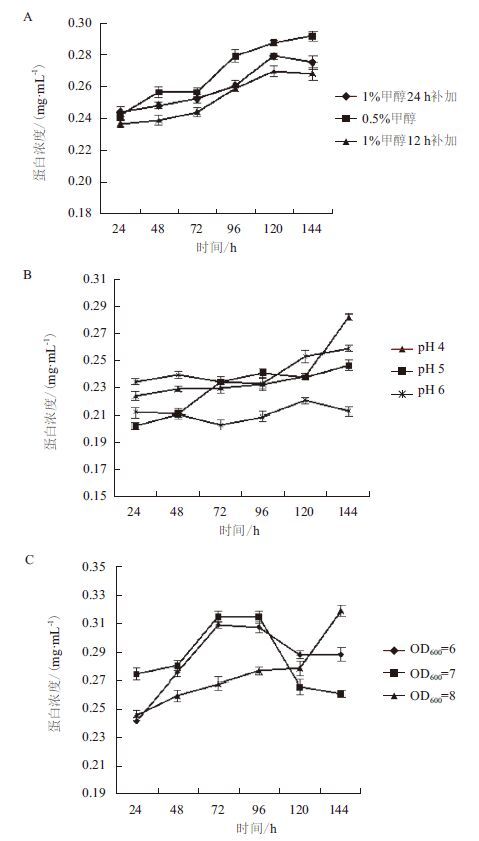
2.3 单因素实验结果 2.3.1 甲醇诱导浓度对蛋白表达量的影响考察甲醇含量分别为1% 每24 h补加、0.5% 甲醇每24 h补加、1% 甲醇每12 h补加时蛋白的表达量。当甲醇浓度为0.5% 时,蛋白浓度最大,且在第4天后涨势缓慢,第6天时浓度最大(图 3-A)。考虑到工业生产的时间成本问题,诱导表达时间为4 d。
|
| 图 3 甲醇浓度(A)、初始诱导pH值(B)、及诱导时菌体OD600(C)对蛋白表达量的影响 |
考察诱导pH分别为3、4、5、6时目的蛋白的表达量。发现诱导pH值为4时第4天目的蛋白表达量均较高(图 3-B)。因此,单因素实验中的最适诱导pH值为4。
2.3.3 诱导时菌体OD600对蛋白表达量的影响考察诱导时菌体OD600值分别为6、7、8时目的蛋白的表达量。诱导时菌体OD600值为7时目的蛋白表达量最高(图 3-C)。因此,选择菌体OD600值为7作为诱导表达时的最适的菌体OD600值。
2.4 响应面法实验设计根据CCD实验设计原理,综合单因素影响实验结果,以诱导pH值(pH)、诱导表达前培养基OD600(OD)和甲醇添加量(M)三因素为自变量,以牛胰脏羧肽酶A表达量为响应值,利用CCD组合设计实验方案,并以-1、0和1 分别代表变量的因素编码(表 1),进行毕赤酵母菌表达牛胰脏羧肽酶A的优化。采用Design Expert 8.0.6软件进行实验设计。
根据表 2结果计算各项回归系数,以这些回归系数建立牛胰脏羧肽酶A表达量与诱导pH值(pH)、诱导表达前培养基OD600(OD)和甲醇添加量(M)三个因素的数学回归模型。由表 2可以得出二次回归方程式为:牛胰脏羧肽酶A表达量= -1.23998+3.07479×M+0.18464×pH-0.082985×OD-0.055525×M×pH-0.042232×M×OD-3.15950E-003×pH×OD-2.5376×M2-0.011486×pH2-3.4090E-003×OD2;M、pH 变量的正系数表明,该变量的正向变化能引起响应值的增加;OD变量负系数表明,该变量的正向变化能引起响应值的减少。负的二次项系数表明,方程的抛物面开口向下,具有极大值点,能够进行最优分析。
回归模型方差分析(表 3)显示,实验选用的模型显著(P<0.05),说明模型是合适的;方差分析中的确定系数R2=0.801 6,校正确定系数R2Adj=0.622 9。R2Adj可显示所选模型的拟合程度,即预测值与实测值之间的相关性,Jalgeker和May建议—个拟合较好的模型R2至少应为0.80[12]。
由表 3 可知模型的一次项B影响显著,A,C 影响不显著。从F 值可以看出,单因素对提取率的影响顺序依次是B>A>C,即pH>甲醇添加量>OD。交互项影响不显著,二次项A2 影响极显著,表明该影响因素对表达量的影响不是简单的线性关系。
2.6 响应面交互作用分析与工艺优化对诱导pH值(pH)、诱导表达前培养基OD600(OD)和甲醇添加量(M)三因子,两两作交互作用分析,对其作响应面图,分别见图 4-图 6。等高线的形状反映交互效应的强弱大小,圆形表示两因素交互作用不显著,而椭圆形则表示两因素交互作用显著。3张图中等高线均呈椭圆形,故3个因素两两之间交互作用显著,其中交互作用显著程度初始诱导pH值与甲醇添加量<诱导pH值与诱导表达前培养基OD600<甲醇添加量与诱导表达前培养基OD600。在求取最优提取条件时RSM 能够综合考虑各因素对2 个响应值不同的影响程度及趋势进行综合评价。可得最佳工艺参数为:甲醇每24 h含量0.5%、诱导pH为5.90、诱导表达前培养基OD600为6.54,在此优化条件下,牛胰脏羧肽酶A蛋白表达量为0.326 mg/mL。为了进一步验证响应面分析法的可靠性,采用上述最优条件进行蛋白表达,3组平行,测得牛胰脏羧肽酶A蛋白表达量分别为:0.324 mg/mL、0.324 mg/mL和0.326 mg/mL,取平均值为0.325 mg/mL,与理论值相比,相对误差较小,为0.38%。因此,采用响应面法分析优化得到的牛胰脏羧肽酶A的参数准确可靠,可用于实际操作。
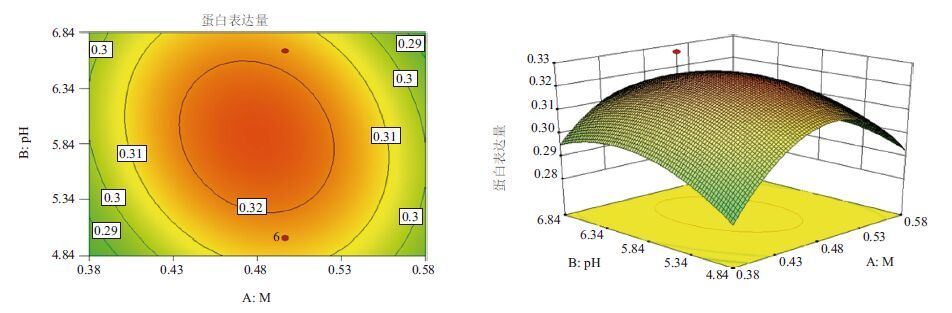
|
| 图 4 甲醇添加量和诱导pH值的响应曲面和等高线图 |
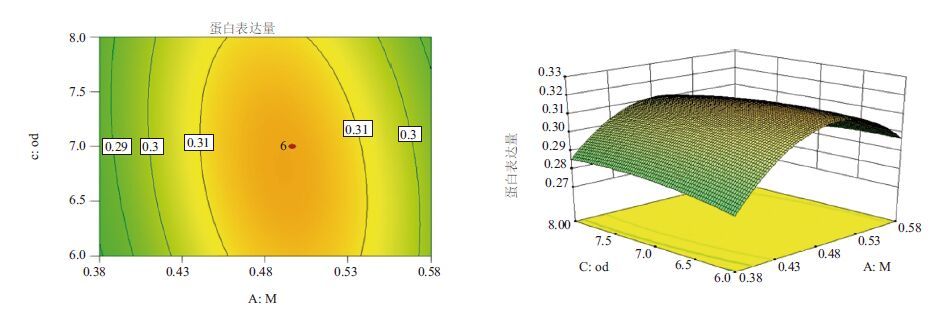
|
| 图 5 甲醇添加量和诱导表达前培养基OD600的响应曲面和等高线图 |
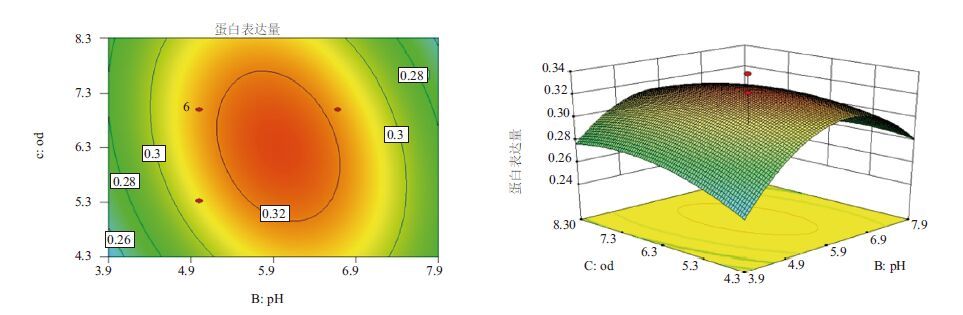
|
| 图 6 诱导pH值和诱导表达前培养基OD600的响应曲面和等高线图 |
本研究利用毕赤酵母表达系统成功实现了牛胰脏羧肽酶A的可溶性表达及纯化,对表达产物进行了SDS-PAGE及Western Blot验证。通过单因素及响应面法优化了表达条件。羧肽酶作为一大类水解酶,应用及其广泛,而其来源有限、价格昂贵使其应用受到了限制。借助基因工程手段可以实现羧肽酶的大量生产,有助于摆脱来源有限,价格昂贵的限制。毕赤酵母表达系统是一种应用成熟的表达系统,其分泌型表达使表达产物实现可溶状态,广泛用于各类酶的表达。Damaso等[13]在毕赤酵母中优化表达了耐热木聚糖,Minning等[14]在毕赤酵母中优化表达了米根霉脂肪酶。
外源蛋白的表达量受到许多因素的调节。由于毕赤酵母对所使用的氨基酸密码子具有明显的偏爱性,同义密码子的表达效率差别明显[15]。故在表达外源蛋白时,应进行密码子优化和GC含量的调整[16]。本研究中所使用的表达载体在构建时已进行了密码子的优化,且表达量有显著提高。宿主菌的选择也至关重要。目前,用于外源基因表达的菌株种类众多,如GS115,X-33,KM71 等。为了防止外源蛋白被同时表达的蛋白酶酶解,蛋白酶缺陷型菌株SMD1168(pep4-)、SMD1165(prb1-)和SMD1163(pep4-prb1-)也被广泛使用[17]。此外,表达载体的选择,表达载体导入酵母菌基因组,多拷贝菌株的筛选,信号肽的选择和改造也至关重要。
发酵条件的优化,如溶氧、pH、温度、甲醇浓度、碳源、诱导时间等都是影响蛋白产量的重要条件。pH 值影响细胞的生物量、蛋白表达量、活性及稳定性。在pH5.0 时,重组人生长激素的生物量为42 g/L,蛋白表达量为271 mg/L,而当培养基pH 达6.0 时,虽然细胞生物量最高可达53 g/L,但是蛋白表达量仅为24 mg/L[18]。低温诱导或许可以通过降低蛋白酶活力,增加外源蛋白稳定性来提高外源蛋白的产量。合适的甲醇浓度是维持细胞高活性,促进蛋白高表达的关键因素。过低的甲醇浓度不足以完全诱导蛋白的表达,而当甲醇浓度过高时又会对细胞产生毒性,一般超过1%的甲醇浓度就会对酵母细胞产性毒性。本研究中,甲醇浓度为0.5%,每天补加培养基体积0.5%的纯甲醇时即可诱导目的蛋白表达,且表达量高于1%的甲醇浓度。另外,当使用甲醇作为唯一碳源时,细胞生长缓慢,混合碳源补加的方法能有效提高表达量。常用的混合碳源有甲醇和山梨醇,甲醇和甘油等。Diego等[19]在培养基中添加山梨醇显著提高了牛凝乳酶B的表达量。山梨醇的添加有助于降低耗氧量及热产率[20]。本研究中发现添加山梨醇可以增加蛋白表达量,故在添加1%山梨醇的BMMY培养基中进行优化实验。一般来说,表达体系中细胞密度增加,蛋白表达量也会相应升高。但较高的细胞密度,溶氧量、营养成分,酵母细胞的代谢产物会影响目的蛋白的产量和稳定性。诱导前培养基的OD值表示了酵母细胞的生物量,本研究中,诱导表达前菌体的OD600值分别为6、7、8,当OD600的值为7时,第1天的蛋白表达量明显高于其他两组,且在前4天一直高于其他两组。
4 结论本研究采用CCD实验设计原理设计及响应面分析,建立牛胰脏羧肽酶A表达量的二次多项式数学模型。经检验证明该模型是合理可靠的,能够较好地预测牛胰脏羧肽酶A表达量。
利用模型的响应面及其等高线,对影响牛胰脏羧肽酶A表达量的关键因素及其相互作用进行探讨,通过典型分析并考虑到实际操作的便利性得到的最终优化条件参数为甲醇每24 h含量0.5%、诱导pH为5.90、诱导表达前培养基OD600为6.54。同时,在此优化条件下,牛胰脏羧肽酶A表达量的理论值为0.326 mg/mL。
采用上述最优条件进行蛋白表达,3组平行,测得牛胰脏羧肽酶A蛋白表达量分别为0.324 mg/mL、0.324 mg/mL和0.326 mg/mL,取平均值为0.325 mg/mL,与理论值相比,相对误差较小,为0.38%。因此,采用响应面法分析优化得到的牛胰脏羧肽酶A的参数准确可靠,获得了较高的蛋白表达量。
| [1] | 吴静, 闵柔, 邬敏辰, 等. 羧肽酶研究进展[J]. 食品与生物技术学报, 2012, 31(8):793-801. |
| [2] | Abrunhosa L, Santos L, Venancio A. Degradation of ochratoxin A by proteases and by a crude enzyme of Aspergillus niger[J]. Food Biotechnol, 2006, 20:231-242. |
| [3] | 冯红霞. 羧肽酶菌株的筛选及其酶的分离纯化、酶学性质的研究[D]. 南京:南京农业大学, 2002. |
| [4] | 赵莹. 猪羧肽酶 A1 酶原的基因克隆及其在毕赤酵母中的表达[D]. 成都:四川农业大学, 2009. |
| [5] | 易静, 郝晓柯, 苏明权, 等. 人羧肽酶A1活性中心的毕赤酵母可溶表达[J]. 第四军医大学学报, 2006 27(5):389-391. |
| [6] | Doreen D, Huaming W, Gunter S, et al. Structural and functional characterization of ochratoxinase, a novel mycotoxin-degrading enzyme[J]. Biochemistry Journal, 2014, 462:441-452. |
| [7] | Zhihong L, Kunlun H, Yunbo L. Ochratoxin A and ochratoxin-producing fungi on cereal grain in China:a review[J]. Food Additives & Contaminants:Part A, 2015, 32(4):461-470. |
| [8] | Pitout, M. J. The hydrolysis of ochratoxin A by some proteolytic enzymes[J]. Biochemical Harmacology, 1969, 18:485-489. |
| [9] | Deberghes P, Betbeder AM, Boisard F, et al. Detoxification of ochratoxin A, a food contaminant:prevention of growth of Aspergillus ochraceus and its production of ochratoxin A[J]. Mycotoxin Researsh, 1995, 11:37-47. |
| [10] | 师磊. 两柱芽孢杆菌和重组羧肽酶A对赭曲霉毒素A的脱毒研究[D]. 北京:中国农业大学, 2014. |
| [11] | Li PZ, Anumanthan A, Gao XG, et al. Expression of recombinant proteins in Pichia Pastoris[J]. Applied Biochemistry and Biotechnology, 2007, 142:105-124. |
| [12] | Jodekar AM, May AT. Product exceuence through design of experiments[J]. Cereal Foods World, 1987, 32(12):857—868. |
| [13] | Damaso MC, Almeida MS, Kurcenbach E, et al. Optimized express-ion of a thermostable xylanase from Thermomyces lanuginosus in Pichia pastoris[J]. Applied and Environment Microbiology, 2003, 69(10):6064-6072. |
| [14] | Minning S, Serrano A, Ferrer P, et al. Optimization of the high-level production of Rhizopus oryzae lipase in Pichia pastoris[J]. J Biotechnol, 2001, 86:59-70. |
| [15] | 陆永超, 蒋琳. 毕赤酵母高效表达策略概述[J]. 微生物学免疫学进展, 2013, 41(1):70-76. |
| [16] | 卢其湘, 赵树进. 外源基因在毕赤酵母中表达的优化[J]. 氨基酸和生物资源, 2005, 27(4):27-29. |
| [17] | Joan LC, James MC. Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J]. FEMS Microbiology Reviews, 2000, 24:45-66. |
| [18] | Bayraktar E. Effects of pH on human growth hormone production by Pichia pastoris considering the expression levels of regulatory genes[D]. Ankara:Middle East Technical University, 2009. |
| [19] | Diego GN, Matías NR, Martín B, et al. Cloning, expression and optimized production in a bioreactor of bovine chymosin B in Pichia(Komagataella)pastoris under AOX1 promoter[J]. Protein Expression and Purification, 2013, 92:235-244. |
| [20] | Jungo C, Schenk J, Pasquier M, et al. A quantitative analysis of the benefits of mixed feeds of sorbitol and methanol for the production of recombinant avidin with Pichia pastoris[J]. Journal of Biotechnology, 2007, 131:57-66. |