2. 重庆医科大学附属第二医院,重庆 400010
2. The Second Affiliated Hospital, Chongqing Medical University, Chongqing 400010
羧肽酶G2(carboxypeptidase G2,CPG2)是羧肽酶G家族成员之一,最初是从假单胞菌属(Pseu-domonas)菌株RS-16中分离获得[1]。羧肽酶G可水解叶酸及其衍生物的C端谷氨酸残基[2, 3, 4]。CPG2在物理特性与动力学特征上与羧肽酶Gl(CPGl)类似,但其对MTX的亲和力要高于CPGl。
CPG2全序列为415个氨基酸,其中包含一个25个氨基酸的信号肽序列和390个氨基酸的成熟蛋白序列。CPG2活性分子为同源二聚体,分子量83 kD-84 kD,催化活性需Zn2+。最初CPG2的制备是RS-16发酵而来,表达量仅为200-300 U/L,且CPG2表达量低于菌体总蛋白的0.1%,不能满足研发的需要[5, 6]。因此,用基因工程的方法生产重组羧肽酶G2是另一选择。
CPG2分子无糖基化和二硫键,用原核系统表达是首选。近年CPG2基因已用基因工程的方法表达重组CPG2[7, 8]。在原核系统中表达量最高可占菌体总蛋白的20%[7, 9, 10]。CPG2必须以二聚体形式存在才具有完全的生物学活性[11]。所以,在大肠杆菌中以可溶形式表达CPG2并能够自发形成二聚体,是大肠杆菌表达CPG2必须考虑的因素。
为了进一步提高CPG2的表达水平,获得有活性的目的蛋白,满足研发的需要,实验通过基因工程的方法在大肠杆菌中高效表达CPG2蛋白,并对其酶学活性进行初步研究,旨在为CPG2的临床应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株和载体Escherichia coli DH5α和BL21(DE3)、表达载体pET-30a为本公司保存。
1.1.2 工具酶、引物和试剂限制性内切酶、T4 DNA连接酶和Taq酶等购自大连TaKaRa生物工程有限公司;PCR引物由上海Sangon公司合成;PCR产物纯化试剂盒、DNA marker、蛋白质marker、YNB、生物素、酵母粉、蛋白胨、卡那霉素、EZ-10 Spin Column DNA Gel Extraction Kit、鼠抗His单克隆抗体(一抗)、羊抗鼠HRP-IgG(二抗)、牛血清白蛋白(BSA)购自上海Sangon公司;其他化学试剂均为国产或进口分析纯。
1.2 方法 1.2.1 引物及基因合成根据GenBank登录的CPG2基因序列(登录号:M12599)进行基因合成(上海生工完成)。设计一对扩增CPG2 cDNA的特异性上下游引物,上游引物CPG2-F中引入Bgl Ⅱ酶切位点,下游引物CPG2-R引入NotⅠ酶切位点,引物由上海Sangon合成(表 1)。
以人工合成的CPG2为模板,CPG2-F和CPG2-R为引物,PCR扩增该序列,引入Bgl Ⅱ酶切位点、肠激酶切割位点(DDDDK)和Not Ⅰ酶切位点。1%琼脂糖凝胶电泳后,切胶纯化回收。将纯化的目的基因片段与pET-30a Bgl Ⅱ和NotⅠ酶切回收后,16℃连接过夜,转化DH5α感受态细胞,提取质粒后双酶切鉴定,证明目的基因片段已正确插入pET-30a载体;质粒经上海Sangon测序,测序正确的重组质粒命名为pET-30a-CPG2。重组质粒转化BL21(DE3)。
1.2.3 CPG2在E.coliBL21(DE3)中的重组表达挑取工程菌pET-30a-CPG2/BL21(DE3)接种到20 mL LB(Kan 50 μg/mL)液体培养基中,37℃,250 r/min,培养过夜。次日,按1%的比例接种母液到200 mL LB(Kan 50 μg/mL)液体培养基,37℃,250 r/min培养,OD600达到0.6后,加入IPTG至终浓度为0.4 mmol/L,30℃继续诱导表达4 h。将摇瓶置于冰上5 min,5 000×g,4℃,离心5 min收集菌体。
1.2.4 CPG2蛋白纯化发酵液菌体按1∶5(W/W)悬浮于裂解液(20 mmol/L Tirs-HCl,0.2 mmol/L Zn2+,pH8.0)中,超声破壁,8 000 r/min离心5 min收集上清;破菌液上清上样于经0.2 mol/L NiSO4处理并以20 mmol/L Tris-HCl(pH8.0)平衡的Ni2+Chelating Sepharose Fast Flow 鳌合层析介质,分别以50 mmol/L和100 mmol/L咪唑(含20 mmol/L Tris-HCl,pH8.0)洗脱,目的蛋白集中于100 mmol/L咪唑洗脱部分;收集的目的蛋白以截留分子量l0 kD离心超滤管超滤脱盐,置换缓冲为25 mmol/L Tris-HCl(含0.2 mmol/L Zn2+,pH8.0),lowry测定蛋白浓度,按每1 mg蛋白加入0.5 U肠激酶(50 mmol/L Tris-HCl,2 mmol/L CaCl2,0.1% Tween-20,pH8.0)在4℃条件下酶切融合蛋白约16 h;酶切目的蛋白上样于25 mmol/L Tirs-HCl(pH8.5),0.2 mmol/L Zn2+平衡的Q-Sepharose Fast Flow(GE Healthcare),用25 mmol/L,Tris-HCl(pH8.5)缓冲液再冲洗5-6个柱床体积后,用50 mmol/L Tris-HCl(pH8.0)洗脱杂蛋白,再以0.1 mol/L Tris-HCl,pH7.5,0.2 mmol/L Zn2+一次性洗脱目的蛋白,收集洗脱蛋白峰。SDS-PAGE检测分子量约为42 kD,纯度大于95%。
1.2.5 免疫印迹分析纯化的带有His标签的融合蛋白经SDS-PAGE分离后电转至PVDF膜上,用5%脱脂奶粉封闭2 h,滴加鼠抗 His一抗(1∶300)(上海生工),4℃孵育过夜,TBST 洗膜3次,再滴加HRP标记的羊抗鼠抗体(1∶1 000)(上海生工),37℃孵育2 h,TBST和PBS各洗膜3次,用滤纸吸干膜表面。利用DAB试剂盒进行显色。
1.2.6 生物活性分析取2.82 mL 0.l mol/L Tris-HCl,pH7.3,0.2 mmol/L ZnCl2,加入180 μL 1 mmol/L氨甲蝶吟(MTX,中国药品生物制品检定所)。用蒸馏水调零。快速加入50 μL标准品或待测样品(适当稀释,含0.03-0.06 U羧肽酶),混匀,倒入比色杯中于320 nm处测其吸光值,间隔15 s检测一次。记录吸光值变化。
1.2.7 羧肽酶G2酶学性质的研究(1)最适酶活反应温度:实验在pH7. 5,反应时间为30 min时分别测定4℃、16℃、25℃、30℃、35℃、37℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃及75℃时的酶活。(2)最适酶活反应pH:测定羧肽酶G2酶液在不同pH值的缓冲液中酶活力,确定pH值对羧肽酶G2酶活力的影响。温度为37℃,反应时间为30 min时,分别测定pH5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0和10.0时的酶活性,以确定最佳反应pH值。
2 结果 2.1 表达载体pET-30a-CPG2的构建与鉴定以人工合成的CPG2基因序列为模板,PCR法扩增该序列,并引入Bgl Ⅱ和NotⅠ酶切位点及肠激酶酶切位点,回收 DNA 片段长度约1 200 bp。将 Bgl Ⅱ/NotⅠ酶切的PCR产物插入pET-30a,成功构建pET-30a-CPG2原核表达载体,并转化至E. coli DH5α感受态细胞。菌落PCR、质粒酶切图谱(图 1-A)及测序结果显示pET-30a-CPG2重组质粒构建成功。

|
| A:PCR分析BL21(DE3)阳性转化子,其中1:DL5000 DNA marker,2:pET-30a-CPG2/BL21(DE3)cDNA。B:PCR 和限制酶酶切鉴定 pET-30a-CPG2,1:DL5000 DNA marker,2:Bgl Ⅱ 酶切pET-30a-CPG2,3:NotⅠ酶切pET-30a-CPG2,4:Bgl Ⅱ/NotⅠ酶切pET-30a-CPG2 图 1 重组表达质粒pET-30a-CPG2和BL21(DE3)阳性转化子的鉴定 |
将pET-30a-CPG2表达载体转入感受态的E. coli BL21(DE3)宿主菌,涂布LB平板,经菌落PCR扩增出1 200 bp片段的菌落为阳性克隆(图 1-A),双酶切重组质粒表明能获得阳性目的片段(图 1-B)。将pET-30a-CPG2/BL21(DE3)经37℃培养的菌液OD600达到0.6-0.8时,加入终浓度为0.4 mmol/L的异丙基硫代-β-D-半乳糖苷(IPTG),30℃诱导目的蛋白表达,收集菌体,并进行SDS-PAGE检测。结果(图 2)显示,与诱导前相比,IPTG 诱导之后在43 kD附近有一条明显的蛋白条带,与融合蛋白理论分子量相当。菌体经超声波破碎后离心,分别取上清和沉淀进行SDS-PAGE分析。结果(图 2)表明,CPG2以可溶的形式表达。

|
| 图 2 CPG2蛋白在大肠杆菌BL21(DE3)中诱导表达的SDS-PAGE检测 M:蛋白质分子量标准;1:诱导前全菌蛋白;2:诱导后全菌蛋白;3:包涵体;4:破菌上清 |
菌体裂解后的上清,经过组氨酸亲和层析和阴离子交换层析,并经Sephadex G-25凝胶过滤层析脱盐、过滤除菌后就得到CPG2蛋白原液。通过该纯化工艺,可以获得纯度大于95%的CPG2蛋白。纯化过程中CPG2蛋白产物的纯度分析(图 3-A),目的蛋白分子量约为42 kD。Western blotting结果(图 3-B)表明,CPG2融合蛋白可与鼠抗His发生特异性反应。
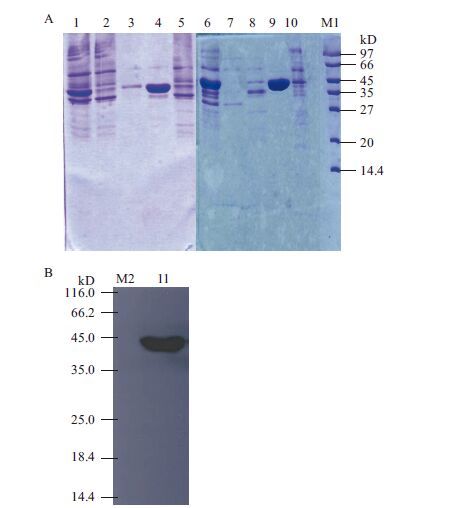
|
| M1:Protein Marker,Mid Range(97-14.4 kD);M2:低分子量蛋白质Marker Ⅱ(14.4-116kD);1:出发样;2:穿透峰;3:洗脱峰1;4:洗脱峰2;5:NaOH洗脱;6:出发样(同4纯化样品);7:穿透峰;8:洗脱峰1;9:洗脱峰2;10:NaOH洗脱;11:CPG2 图 3 融合蛋白CPG2的纯化结果(A)及Western blotting 检测(B) |
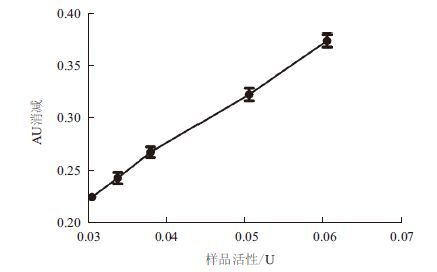
用酶动力学方法对CPG2的活性进行了测定,反应体系中最终加入酶量0.1-1.0 U,检测MTX降解率,以计算酶活性。定义37℃条件下1 min内降解1 μmol MTX所需要的酶量为1个活性单位(U)。经检测,CPG2原液比活性为400 U/mg。随着CPG2浓度的上升,MTX的裂解率也随之上升,两者成呈剂量依赖关系(图 4)。
|
| 图 4 CPG2剂量-反应曲线 |
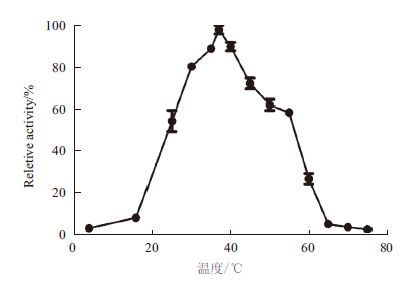
最适酶活反应温度在pH7.5的条件下、用UV法测定4℃、16℃、25℃、30℃、35℃、37℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃和75℃下的CPG2的酶活性,通过3次平行试验,取平均值,绘制曲线如图 5。酶的最适温度为37℃,在温度为30℃-40℃范围内,酶活性保持在80%-100%,当温度高于55℃时,酶活性急剧下降至60%,到60℃以后,酶活性急剧下降接近为0。
|
| 图 5 温度对羧肽酶G2活性的影响 |
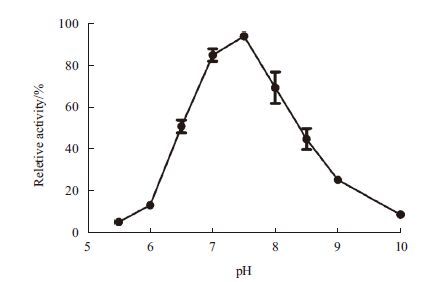
在最适温度37℃下用UV法分别测定pH5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0和10.0的缓冲体系下酶活性,通过3次平行试验,取平均值,绘制pH曲线,酶活情况由图 6可见。
|
| 图 6 pH对羧肽酶G2活性的影响 |
本研究将CPG2连接至原核表达载体pET-30a上,采用 IPTG诱导CPG2融合蛋白的表达。pET-30a原核表达载体具有两个显著特点:一是含有T7启动子,可被宿主细胞提供的T7 RNA 聚合酶识别,T7 RNA 聚合酶的转录效率比大肠杆菌 RNA 聚合酶高5倍,能够高效转录 mRNA,实现融合蛋白的高表达;二是载体上携带His·Tag和S·Tag,诱导表达的 43 kD标签蛋白对目的蛋白的结构及生物学活性影响很小,His·Tag为蛋白纯化提供了亲和位点,而且两者之间有肠激酶酶切位点,便于纯化后将标签蛋白切除[12, 13, 14, 15]。
在蛋白纯化过程中,首先采用 Ni2+柱进行亲和层析,之后的SDS-PAGE分析出现43 kD的蛋白条带。重组蛋白的理论等电点pI为6.5,所用缓冲液pH8.0,选择Q柱进行阴离子交换层析,最终获得目的蛋白的纯度大于95%。
羧肽酶G2可水解MTX成无毒的非活性代谢物2,4-二甲基-N10-甲基蝶吟酸(DAMPA)和谷氨酸,两者可以通过肝脏代谢提供一个非肾的MTX清除通道,减轻肾脏毒性[16, 17]。目前,临床上MTX高剂量化疗所致的毒副作用,通常采用亚叶酸钙进行解救。亚叶酸钙与MTX竞争进入细胞、靶组织(骨髓、胃肠道上皮),阻止MTX的作用,补偿DNA合成代谢途径,从而达到缓解HD-MTX引发的不良反应。MTX浓度升高时需要更高浓度的亚叶酸钙,但大剂量亚叶酸钙同样可解救肿瘤细胞,降低抗肿瘤效果。通过水化和碱化尿液增强MTX的水溶性来降低肾毒性,可将毒性影响范围降低到1.5%,但仍会发生因清除延迟而致全身毒性。CPG2是目前被证明用于MTX大剂量治疗的特异性解救药,其可特异迅速裂解MTX,且不透过血-脑屏障(BBB)和细胞膜,因而不会抵消细胞内MTX的作用。MTX裂解产物可在肝代谢,因此CPG2治疗实际上间接提供了一种肝解毒途径[18]。
CPG2还被用于抗体导向酶-前药疗法(ADEPT)[19, 20, 21]。ADEPT是利用抗体作为载体携带前药的专一性活化酶,选择性地结合于肿瘤部位,使前药可以区域特异性地在肿瘤组织内转化为活性细胞毒分子,起到专一杀伤肿瘤的作用[22, 23]。高纯度的CPG2为上述研究的深入进行提供了可能性。
4 结论成功构建了CPG2原核表达体系,并纯化获得了纯度较高的蛋白,初步证明其具有预期的生物学活性。下一步将重点围绕CPG2蛋白的体内外活性开展深入研究。
| [1] | Levy CC, Goldman P. The enzymatic hydrolysis of methotrexate and folic acid[J]. J Biol Chem, 1967, 242(12):2933-2938. |
| [2] | Chabner BA, Bertino JR. Activation and inhibition of carboxypepti-dase G 1 by divalent cations[J]. Biochim Biophys Acta, 1972, 276(1):234-240. |
| [3] | Goldman JM, Dawson AA. Combination therapy for advanced resist-ant Hodgkin’s disease[J]. Lancet, 1975, 2(7947):1224-1227. |
| [4] | McGuire JJ, Bertino JR. Enzymatic synthesis and function of folylpolyglutamates[J]. Mol Cell Biochem, 1981, 38(1):19-48. |
| [5] | Sherwood D, Snodgrass DR, O’Brien AD. Shiga-like toxin production from Escherichia coli associated with calf diarrhoea[J]. Vet Rec, 1985, 116(8):217-218. |
| [6] | Niculescu-Duvaz D, Niculescu-Duvaz I, Friedlos F, et al. Self-immo-lative nitrogen mustards prodrugs cleavable by carboxypeptidase G2(CPG2)showing large cytotoxicity differentials in GDEPT[J]. J Med Chem, 2003, 46(9):1690-1705. |
| [7] | Minton NP, Atkinson T, Sherwood RF. Molecular cloning of the Pseudomonas carboxypeptidase G2 gene and its expression in Escherichia coli and Pseudomonas putida[J]. J Bacteriol, 1983, 156(3):1222-1227. |
| [8] | Minton NP, Atkinson T, Bruton CJ, et al. The complete nucleotide sequence of the Pseudomonas gene coding for carboxypeptidase G2[J]. Gene, 1984, 31(1-3):31-38. |
| [9] | Chambers JC1, Kenan D, Martin BJ, et al. Genomic structure and amino acid sequence domains of the human La autoantigen[J]. J Biol Chem, 1988, 263(34):18043-18051. |
| [10] | Lancaster EK1, Evans RA, Kos S, et al. Measurement of bone in the os calcis:a clinical evaluation[J]. J Bone Miner Res, 1989, 4(4):507-514. |
| [11] | 高闪电, 常惠芸, 独军政, 等. 一种高效、稳定的可溶性原核表达载体的构建及应用[J]. 华北农学报, 2009, 24(6):46-49. |
| [12] | Mergulhāo FJ, Summers DK, Monteiro GA. Recombinant protein secretion in Escherichia coli[J]. Biotechnol Adv, 2005(3):177-202. |
| [13] | 李永进, 陈媛媛, 毕利军. 融合标签技术及其应用[J]. 生物工程学报, 2006, 22(4):523-527. |
| [14] | 姜媛媛, 刘铭瑶, 任桂萍, 等. 高效可溶性重组蛋白表达载体的构建[J]. 生物工程学报, 2010, 26(1):121-129. |
| [15] | 肖飞, 晁耐霞, 曾庆堂, 等. GCF2基因片段原核表达载体的构建与鉴定[J]. 广西医学, 2011, 5:513-515. |
| [16] | Patterson DM, Lee SM. Glucarpidase following high-dose methotr-exate:update on development[J]. Expert Opin Biol Ther, 2010, 10(1):105-111. |
| [17] | Donehower RC, Hane KR, Drake JC, et al. Presence of 2, 4-diami-no-N10-methylpteroic acid after high dose methotrexate[J]. Clin Pharmacol Ther, 1979, 26:63-72. |
| [18] | Widemann BC, Sung E, Anderson L, et al. Pharmacokinetics and metabolism of the methotrexate metabolite 2, 4-diamino-N10-meth-ylpteroic acid[J]. J Pharm Exper Ther, 2000, 294:894-901. |
| [19] | 朱莉, 王驰. 抗肿瘤前药在肿瘤靶向治疗中的新进展[J]. 中国新药杂志, 2007, 16(17):1345-1348. |
| [20] | 周思群, 王耐勤. 抗体导向酶-前药疗法在肿瘤治疗研究中的应用[J]. 中国药学杂志, 1994, 29(8):451-453. |
| [21] | 张丹妮. 靶向抗肿瘤前药系统的研究进展[J]. 辽宁医学院学报, 2013(5):88-91. |
| [22] | Bagshawe KD. The first bagshawe lecture. towards generating cytotoxic agents at cancer sites[J]. Br J Cancer, 1989, 60(3):275-281. |
| [23] | 王智, 武国军, 刘智广, 等. 抗体导向酶-前药疗法的研究和应用进展[J]. 中国肿瘤生物治疗杂志, 2000, 7(1):73-75. |




