生物质(农业废弃物、草本和木本植物等)是世界上储量丰富、廉价、应用潜能巨大的可再生能源。我国具有丰富的生物质资源,据统计2010年秸秆理论资源量为8.4×108 t(折合4×108 t标煤),仅玉米秸秆约2.73×108 t。加快推进秸秆能源化利用如生产纤维乙醇,有助于减少温室气体CO2的排放,缓解化石燃料短缺的压力,实现碳减排目标,符合可持续能源发展战略[1]。
通常纤维乙醇的生产过程包括原料的预处理、酶水解、发酵和蒸馏,其中酶解是整个纤维乙醇生产的主要技术和经济瓶颈[2]。降低酶解糖化过程的成本、提高酶解率及减少酶用量成为重要因素。纤维素酶,是能够将纤维素降解为葡萄糖单体的一种多组分复杂酶体系,主要组分包括内切型-β-1,4葡聚糖酶(Cx酶)、外切型-β-1,4葡聚糖酶(C1酶)、β-1,4-葡萄糖苷酶(CB)。纤维素酶的作用机制目前普遍认可的是协同作用理论。首先内切酶在纤维素内部的非结晶区进行切割,随机水解β-1,4-糖苷键,形成外切酶所需新的游离末端,然后由外切酶从多糖链的还原端或非还原端切下纤维二糖单位,最后由β-葡萄糖苷酶将纤维二糖降解为葡萄糖[3]。酶解过程需要这3种组分的彼此协调配合,且各组分配比要恰当。
纤维素酶生产菌株有木霉属(Trichoderma)、曲霉属(Aspergillus)和青霉属(Penicillium)。应用较多的是木霉属中的里氏木霉(Trichoderma reesei),它可发酵得到高活力的内切葡聚糖酶和外切葡聚糖酶,但所产生的β-葡萄糖苷酶的活性较差,致使纤维二糖不能及时的转化为葡萄糖而累积,对酶解过程形成明显的反馈抑制作用[4]。Selig等[5]研究了纤维素酶水解过程中加入木聚糖酶对酶解率的影响,未进行酶系组分和配比的深入研究。有关文献报道[6],混合使用不同微生物生产的酶有利于提高水解效率。在T. reesei 酶体系中加入β-葡萄糖苷酶比不加β-葡萄糖苷酶的糖化效果好。
关于酶复配技术的工艺优化研究报道并不多。本研究以蒸汽爆破处理后的玉米秸秆作为考察对象,拟通过单因素实验和正交实验相结合的方式来优化酶复配技术的工艺参数,系统的研究纤维素酶、木聚糖酶和β-葡萄糖苷酶对酶解效率影响的规律,以期获得最佳的纤维素酶配系比,进而提高还原糖浓度。该复配技术的建立可为纤维素乙醇的工业化生产中的酶解工艺提供有益的启示和参考依据。
1 材料与方法 1.1 材料 1.1.1 材料和试剂玉米秸秆收购于南阳郊区农田。纤维素酶和木聚糖酶由河南天冠纤维乙醇有限公司生产,纤维素酶的滤纸酶活为580 FPU/mL,木聚糖酶酶活23 000 IU/mL,β-葡萄糖苷酶购于康地恩公司其酶活为6 880 IU/mL,复合诺维信酶购于诺维信公司,其他所用试剂均为分析纯。
1.1.2 仪器和设备电子恒温水浴锅,精密增力定时电动搅拌器,电热鼓风干燥箱,SHB-III循环水式多用真空泵,MJ33快速水分测定仪,SXL-1002程控箱式电炉,精密电子天平,计量称,SBA-40C型生物传感分析仪,新型密封式粉碎机,手提式蒸汽灭菌锅,耐压管,JSM-6700F型扫描电子显微镜,高效液相色谱仪Agilent 1200。
1.2 方法 1.2.1 原料蒸汽爆破预处理将收购的玉米秸秆经自然风干、粉碎后,装入蒸汽爆破罐,通入高温蒸汽迅速升高罐压至1.5-1.8 MPa,维持时间20 min后,通过瞬间泄压来实现原料的组分分离和结构变化;秸秆爆破后经水洗脱毒,进入立式板框压缩,收集并用粉碎机粉碎至粒径≤4 mm以供实验用。测定其中纤维素、半纤维素和木质素的含量。
1.2.2 玉米秸秆酶解实验底物浓度设计为25%(质量分数),300 g的体系,初始投料量为总物料的1/6,每次补料剩余量的1/10,分10次补完,用0.05 mol/L的柠檬酸缓冲溶液调节酶解初始pH为4.8-5.0,根据实验设计表添加所需酶液,初始加入总酶量的2/3,补料6次后加入剩余的酶,将料、酶、水混合均匀后,在50℃的电子恒温水浴锅中以120 r/min的转速进行酶解。酶解48 h 后将酶解液离心分离,取上清液测葡萄糖含量并进HPLC以分析其中木糖和纤维二糖的含量。
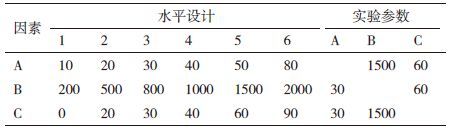
1.2.2.1 单因素实验设计分别进行影响因子纤维素酶(A)、木聚糖酶(B)和β-葡萄糖苷酶(C)的添加梯度实验,具体设计如表 1所示。
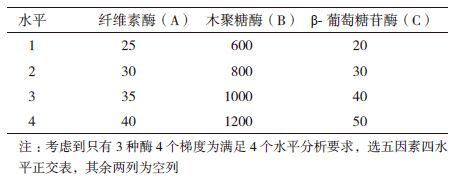
在前面单因素实验的基础上,初步确定纤维素酶(A)、木聚糖酶(B)和β-葡萄糖苷酶(C)的变化区间,选用五因素四水平的正交表进行优化实验(表 2),确定酶解最佳工艺条件。
纤维素酶的酶活测定根据IUPAC推荐的滤纸酶活法进行[7],一个滤纸酶活的国际单位(FPU)为在标准条件下,酶促反应中1 min生成1 μmol葡萄糖所需的酶量。
木聚糖酶酶活的测定参照文献[8]中的检测方法并加以改进,木聚糖酶活力单位(IU)是指在标准条件下,1 min催化1.2%的木聚糖底物水解生成1 μmol木糖所需酶量。
β-葡萄糖苷酶酶活采用对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)为底物进行测定[9]。
1.2.3.2 秸秆分析玉米秸秆处理前后纤维素、半纤维素和木质素含量的测定按照美国可再生能源实验室(NREL)标准方法[10]进行。通过扫描电镜SEM观察秸秆爆破前后表面结构的改变情况。水分用水分测定仪测定。
1.2.3.3 酶解液成分分析酶解液中各种糖组分含量用高效液相色谱(HPLC)进行定量分析,操作条件:Zorbax Eclipse XDB-C18色谱柱,流动相:0.55 mL色谱纯浓H2SO4用纯水定容至1 000 mL;流速:0.5 mL/min;柱温:65℃,柱压:42 bar。葡萄糖含量测定采用山东省科学院生物研究所研制的SBA-40C型生物传感分析仪。
1.2.3.4 计算公式酶解率(%)=(葡萄糖含量×0.9)/(秸秆质量×固形物×纤维素含量)×100%,其中,0.9为葡萄糖与纤维素的折算系数。固形物=1-含水率。
2 结果 2.1 玉米秸秆的化学组分玉米秸秆经蒸汽爆破处理后,能实现原料的组分分离和结构变化,纤维素内部的氢键被打断,有序结构发生重排,游离出新的羟基,聚合度降低,增加纤维素酶的吸附能力。表 3显示,秸秆汽爆后,半纤维素脱乙酰基大部分被降解生成可溶性成分,含量明显减少,仅剩3.65%;纤维素相对百分含量达42.21%,原料可水解部分增多;木质素含量相对有所提高。SEM结构(图 1)显示,未处理秸秆,结构紧凑,排列致密,爆破过程中因受到类酸性水解作用、热降解和机械断裂作用,纤维素结晶结构被破坏,木质素发生解聚、软化与纤维分离,物料孔隙率增大,便于后续酶解的进行。

|
| 图 1 玉米秸秆SEM 结构图 |
考虑到纤维素酶糖化过程受纤维二糖的抑制影响,添加足量β-葡萄糖苷酶。由图 2知,纤维素酶的添加量对玉米秸秆酶解过程起决定性作用,直接影响酶解效果的好坏,纤维二糖和木糖的生成量基本稳定。随着纤维素酶用量的增加,酶解率迅速提高,且增长速度先快后慢,渐渐趋向平衡,纤维素酶添加量40 FPU/g绝干秸秆时,酶解率为75.45%,继续添加纤维素酶对玉米秸秆纤维素转化率作用影响有所增大但变化不显著,添加80 FPU/g,酶解率为77.57%,提高仅2.12%。原因主要是,酶解反应是液固非均相反应,液相中的酶分子首先吸附在底物纤维素表面上,二者形成不稳定的化合物,进而降解生成还原糖,当吸附位点全部被占据达到饱和再继续增加酶量,对整个过程起不到明显的促进作用。还可能是反应时间延长,酶出现变性失活;产物还原糖的积累等。从转化率和成本综合考虑,酶法糖化工艺,要尽可能降低酶成本,减少酶用量。因此,选择合适的酶用量至关重要。

|
| 图 2 不同纤维素酶添加量对酶解的影响 |
在纤维素酶用量30 FPU/g,β-葡萄糖苷酶量60 IU/g的条件下,分析不同木聚糖酶添加量对酶解率的影响。结果(图 3)显示,起初加入木聚糖酶,酶解率开始增大,超过500 IU/g后,增速变缓,达到1 500 IU/g时,最高为78.03%,之后略有下降的趋势。可能是物料中的半纤维素被木聚糖酶降解,其对纤维素的包覆作用减弱,纤维素酶和纤维素的液-固异相反应的空间位阻降低,更多的纤维素被暴露出来,加快了纤维素酶与底物的吸附、扩散速度和纤维素酶的水解速率,进而增加酶解率;木聚糖酶超过2 000 IU/g,可能吸附到纤维素表面上,和纤维素酶形成竞争位点,阻碍纤维素酶的水解程度。木糖含量随木聚糖酶加入量的增加逐渐增大,进一步说明半纤维被降解,木聚糖酶对酶解的协同增强作用。纤维二糖的变化和酶解率曲线基本相一致。
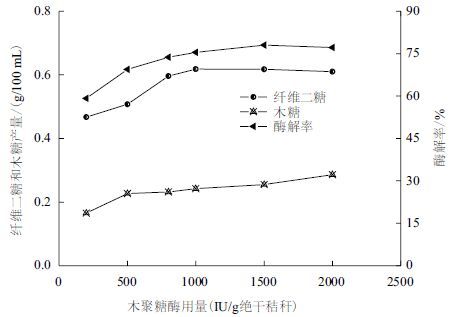
|
| 图 3 不同木聚糖酶用量对酶解的影响 |
为降低酶解过程中因纤维二糖的富集造而成的反馈抑制,增加纤维底物的酶解效率,需向酶解体系中补加纤维二糖酶以提高纤维二糖酶的活力,增强酶解效果。纤维素酶添加30 FPU/g,木聚糖酶用量60 IU/g的条件下,改变β-葡萄糖苷酶的加入量考虑其对酶解的影响。结果(图 4)显示,未加β-葡萄糖苷酶,纤维二糖浓度为0.720 1 g/100 mL,酶解率仅为60.88%,说明纤维二糖的累积对酶解过程形成较大的抑制作用。随着β-葡萄糖苷酶用量的提高,纤维二糖含量不断减少,糖化率逐渐增大,慢慢的趋向稳定。当加入40 IU/g时,纤维二糖0.330 4 g/100 mL,酶解率达76.45%,提高了15.57%,超过40 IU/g后,基本达到饱和。因此β-葡萄糖苷酶的使用对整个过程中酶活的发挥影响较大。

|
| 图 4 不同β-葡萄糖苷酶添加量对酶解的影响 |
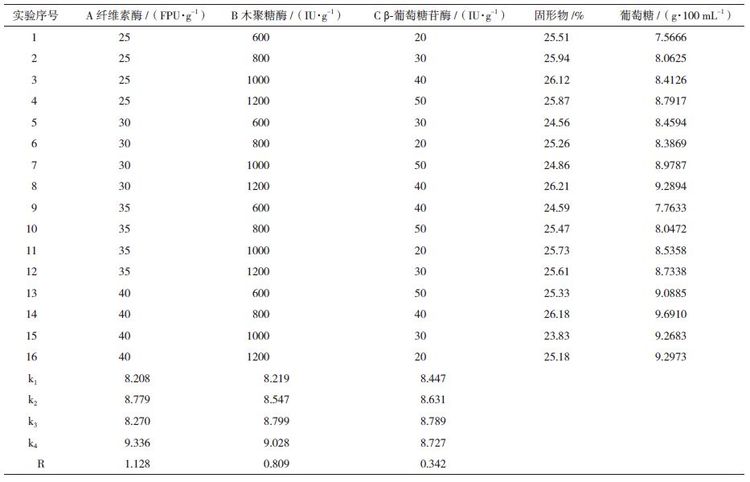
在单因素实验的基础上,选L16(45)正交表进一步考查纤维素酶(A)、木聚糖酶(B)和β-葡萄糖苷酶(C)对酶解的综合影响,实验结果见表 4。
从极差R的大小看,3种酶的影响先后顺序为:纤维素酶>木聚糖酶>β-葡萄糖苷酶,酶解率最高的组合为A4B4C3,即纤维素酶添加量40 FPU/g,木聚糖酶1 200 IU/g,β-葡萄糖苷酶40 IU/g。结合经济性分析,降低酶解成本在纤维乙醇生产中是关键,确定最佳配比条件:纤维素酶添加30 FPU/g,木聚糖酶800 IU/g,β-葡萄糖苷酶40 IU/g;在该条件进行底物浓度25%(W/W)的酶解,并与诺维信酶(添加40 IU/g)进行对比实验,诺维信葡萄糖为9.8 g/100 mL,复配后葡萄糖达9.3 g/100 mL,两者相差5.1%,若只用天冠纤维素酶,葡萄糖仅5.9 g/100 mL,提高了57.63%。
3 讨论纤维素酶是由三种组分组成的复合酶系,各组分间如何发挥作用,目前普遍认可的酶解机制是协同作用模型。在协同降解过程中首先由CX酶在纤维素的内部起作用,在纤维素的非结晶部位进行切割产生新的末端,然后再由C1酶以纤维二糖为单位从末端进行水解,最后由CB酶将纤维二糖水解为葡萄糖[11, 12]。纤维素酶各组分间的比例以及彼此相互协同作用对整个酶解过程影响较大,纤维素酶多组分的协同作用比单一组分的水解效果要显著。
相关文献报道[13]液体酶制剂复配时,除了加入水,还加入了稳定剂来控制水的活度。本实验酶的复配是料水混匀后同时加入不同3种酶进行酶解。Nidetzky等[14]研究了由里氏木霉发酵产生的纤维素酶各组分间的相互协同作用和最佳配合比例,结果表明,最大的协同作用出现在β-葡萄糖苷酶和内切葡聚糖酶之间,纤维素酶各组分是按次序发挥水解作用的。Berlin等[15]对酶复配优化木质纤维素水解进行了研究发现,添加木聚糖酶、果胶酶、β-葡萄糖苷酶可明显促进酶解,所需的总蛋白大约减少两倍及葡萄糖和木糖转化率分别为99%和88%,有助于改善酶解和降低水解过程成本。林增祥等[16]采用混料设计分析了两种不同厂家的纤维素酶和木聚糖酶的复配对酶解影响,研究得出经过多酶复配比使用单一纤维素水解酶的效率增加了约40%,这对提高水解酶的水解率、降低成本有重要意义。本研究通过单因素实验和正交实验,系统全面地研究了天冠集团生产的纤维素酶、木聚糖酶和购买的β-葡萄糖苷酶进行复配对酶解的影响规律,得出最优添加量,指导实际生产应用。
纤维乙醇生产过程中酶法糖化工段关键是降低纤维素酶的生产成本、投加量和提高酶解效率。多酶复配技术目的是优化不同酶添加量及酶系相互协调作用来调控酶系的比例,使酶解更充分进而减小酶用量并降低成本。纤维素酶的添加量有最大值,因为纤维素酶作为一种生物催化剂,与底物的吸附作用有一定饱和度,定量的纤维素分子能与酶分子相结合的位点有限,当这些结合点全部被纤维素酶分子所占据后,再增加纤维素酶的用量,对酶解效率的提高影响不大[17, 18]。Briggs-Haldane稳态学说[19]:

秸秆汽爆后结构发生变化,含有42.21%的纤维素,少量的半纤维素和木质素,若只用纤维素酶,酶解效果较差,糖度较低;加入木聚糖酶可降低液-固异相反应的空间位阻,消除半纤维素的包覆作用,避免对酶的无效吸附,暴露更多纤维素与酶充分接触;β-葡萄糖苷酶加入能消除纤维二糖的累积对葡聚糖的反馈抑制作用,便于纤维二糖顺利转化为葡萄糖,提高酶解效率。
因为汽爆秸秆在酶降解反应中会出现产物反馈抑制影响,所以酶系各组分间的用量经优化后才能避免出现某种酶系含量较多、底物消耗过快而不能充分彻底发挥酶解作用,或者某一酶系含量较少出现底物富集,引起整个酶解过程不顺畅,降解速率降低。
4 结论玉米秸秆经蒸汽爆破处理,纤维素含量达42.21%,半纤维素分解含量为3.65%。SEM显示秸秆致密紧凑结构被破坏,变得疏松多孔隙,易被纤维素酶吸附进行酶解。
单因素分析多酶复配技术对酶解的影响。纤维素酶对酶解过程起决定性作用,β-葡萄糖苷酶能降低纤维二糖的富集而造成的反馈抑制,促进酶解的进行,木聚糖酶降解底物中的半纤维素,纤维素更多的暴露,加快纤维素酶与底物的吸附、扩散速度,增加酶解率。纤维素酶添加量40 FPU/g(绝干秸秆)时,酶解率为75.45%;木聚糖酶添加达1 500 IU/g时,酶解率最高为78.03%;β-葡萄糖苷酶加入40 IU/g时,纤维二糖0.330 4 g/100 mL,酶解率达76.45%。
正交实验结果显示三种酶影响先后顺序为:纤维素酶>木聚糖酶>β-葡萄糖苷酶。结合经济性考虑最佳组合为:纤维素酶用量30 FPU/g,木聚糖酶800 IU/g,β-葡萄糖苷酶40 IU/g。在此条件下,进行底物浓度25%(W/W)的复配实验,葡萄糖达9.3 g/100 mL,若用单一天冠纤维素酶,葡萄糖仅5.9 g/100 mL,提高了57.63%。
不同酶复配是增加生物质酶解效率的重要方法,经过复配后酶间的相互协调作用明显增强。
| [1] | 匡廷云, 白克智, 杨秀山. 我国生物质能发展战略的几点意见[J]. 化学进展, 2007, 19(7):1060-1063. |
| [2] |
Mosier N, Wyman C, Dale B, et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresource Technology, 2005, 96:673-686. |
| [3] | 余兴莲, 王丽, 徐伟民. 纤维素酶降解纤维素机理的研究进展[J]. 宁波大学学报:理工版, 2007, 20(1):78-82. |
| [4] | Nieves RA, Ehrman CI, Adney WS, et al. Survey and analysis of commercial cellulase preparations suitable for biomass conversion to ethanol[J]. World Journal of Microbiology & Biotechnology, 1998, 14(2):301-304. |
| [5] | Selig MJ, Knoshaug EP, Adney WS, et al. Synergistic enhancement of cellobiohydrolase performance on pretreated corn stover by addition of xylanase and esterase activities[J]. Bioresource Technology, 2008, 99(11):4997-5005. |
| [6] | Sun Y, Cheng J. Hydrolysis of lignocellulosic materials for ethanol production:a review[J]. Bioresource Technology, 2002, 83(1):1-11. |
| [7] | Ghose TK. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 1987, 59(2):257-268. |
| [8] | 杨付伟, 王林风, 任建伟, 等. 纤维素乙醇木聚糖酶的固体发酵工艺研究[J]. 可再生能源, 2011, 29(1):23-26. |
| [9] | Busto MD, Ortega N, Perez-mateos M. Studies of microbial β-D-glucosidase immobilized in alginate gel beads[J]. Process Biochemistry, 1995, 30(5):421-426. |
| [10] | Sluiter A, Hames B, Ruiz R, et al. Determination of Structural Carbohydrates and Lignin in Biomass[M]. National Renewable Energy Laboratory, 2008. |
| [11] | 王超, 章超桦. 酶解纤维素类物质生产燃料酒精的研究进展[J]. 纤维素科学与技术, 2003, 11(4):52-59. |
| [12] | 张森翔, 尹小燕, 龚志伟, 等. 纤维素酶降解秸秆特性及其基因工程研究进展[J]. 生物技术通报, 2015, 31(5):20-26. |
| [13] | 吕景春, 郑成辉, 李静. 纤维素酶的复配及生物抛光效果评定[J]. 染整技术, 2009, 31(4):23-26. |
| [14] | Nidetzky B, Steiner W, Claeyssens M. Synergistic interaction of cellulases from trichoderma reesei during cellulose degradation[J]. Process Biochemistry, 1995, 23:117-123. |
| [15] | Berlin A, Maximenko V, Gilkes N, et al. Optimization of enzyme complexes for lignocellulose hydrolysis[J]. Biotechnology and Bioengineering, 2007, 97(2):287-296. |
| [16] | 林增祥, 张红漫, 黄和, 等. 纤维素水解酶的复配应用研究[J]. 安徽农业科学, 2009, 37(27):13339-13341. |
| [17] | 任天宝, 张玲玲, 宋安东, 等. 稻草秸秆多酶水解条件研究[J]. 可再生能源, 2010, 28(2):67-72. |
| [18] | Walker LP, Wilson D. Enzymatic hydrolysis of cellulose:an overview[J]. Bioresource Technology, 1991, 36(1):3-14. |
| [19] | 张建安, 张小勇, 韩润林, 等. 木素对纤维素酶解的影响及纤维素酶解[J]. 化学工程, 2000, 28(1):37-39. |
| [20] | 张名佳, 苏荣欣, 齐崴, 等. 多酶复配优化木质纤维素酶解工艺研究[C]. 第五届全国化学工程与生物化工年会论文集. 西安:2008:1070. |