1930年,Tillett和Francis首次在急性大叶性肺炎患者的血清中发现了一种能够在Ca2+存在时与肺炎球菌细胞壁中的C-多糖发生特异性沉淀反应的物质,1941年,Avery等测知它是一种蛋白质,故称其为C反应蛋白(CRP)。之后,人们在非感染性疾病和感染性疾病患者的急性期血清中都测到了CRP,其中CRP是急性期蛋白中变化最为显著的一种。CRP在正常人血清中其含量极微,在组织受到损伤、炎症、感染或肿瘤破坏时CRP可以在数小时内急剧上升,CRP因此被广泛应用于临床疾病的早期预判及鉴别诊断[1]。
人源CRP蛋白为同源五聚体结构,每个单体都具有224个氨基酸,由信号肽酶切除掉位于N端的18个氨基酸后成为成熟形式,成熟的人源五聚体CRP分子量约为125 kD[2, 3]。CRP在临床疾病的诊断及预防中具有重要的作用,近年来有关人CRP蛋白临床研究已成为热点,重组人CRP蛋白的研究也有报道[4, 5]。本研究基于CRP的临床应用价值,利用多种表达载体及菌株,对重组人CRP蛋白(rhCRP)的原核表达及免疫学性能进行分析。
1 材料与方法 1.1 材料菌株:E.coli DH5α,BL21(DE3)及Rosetta gami2(DE3)pLysS;原核表达载体:pET28a(5 369 bp,His-tag),pET32a(5 900 bp,Trx-His-tags),pET41a(5 933 bp,GST-His-tags),pCold1(4 407 bp,His-tag);限制性内切酶BamH I,Hind III(TaKaRa),人源CRP蛋白(Fitzgerald);Ni-NTA树脂(GE);捕获抗体为鼠源CRP单克隆抗体mAb1及mAb2,检测抗体抗为辣根过氧化物酶标记的羊抗鼠CRP单克隆抗体。
1.2 方法 1.2.1 CRP原核表达载体的构建及鉴定利用核酸序列分析软件(DNAstar)对crp基因进行核苷酸序列的优化,并去掉信号肽序列,使其易于在大肠杆菌中进行表达[6],在优化后的crp序列两端加上合适的限制性酶切位点(BamH I,Hind III),并合成无信号肽的crp(618 bp)核苷酸序列,将其插入到原核表达载体pET28a、pET32a、pET41a及pCold1中。CRP核酸序列在3'端带有终止密码子,因此没有选取Nco I作为5'端的酶切位点,以保留5'端的His标签,为了构建的方便,其余载体也都用BamH I和Hind III作为酶切位点。为了消除蛋白质标签对复性后rhCRP活性的影响,本研究对pCold1重组表达载体进行了进一步的改造,得到无His-tag(命名为nh)的重组表达载体pCold-crp(nh),使得rhCRP(与人源CRP相比仅在N端多出两个氨基酸,即BamH I酶切位点编码的甘氨酸和丝氨酸)分子量大小接近于人体内成熟形式的CRP单体。将构建好的原核表达载体分别转化进入E.coli DH5α中,抗性筛选得到阳性克隆,提取质粒进行鉴定。
1.2.2 CRP在大肠杆菌中的诱导表达将鉴定为阳性的重组表达载体分别转化进入E.coliBL21(DE3)和Rosetta gami2(DE3)pLysS中;在不同的温度(携带有pCold1重组表达载体的菌株于20℃进行诱导表达[7],其他的菌株于20-37℃进行诱导表达)及IPTG浓度(0.25 mmol/L,0.5 mmol/L)下对各表达菌株进行培养及诱导,分析CRP重组蛋白在各个菌株之中的表达情况。其中,载体pET28a、pET32a、pET41a及pCold1对应的重组蛋白形式分别为:His-CRP(约27 kD),Trx-His-CRP(约40 kD),GST-His-CRP(约48 kD)和His-CRP(约27 kD),Trx、GST及His标签均位于重组蛋白的N端。
1.2.3 rhCRP的纯化及复性对各重组表达菌株进行诱导培养,收集菌体,超声破碎后得到各rhCRP的包涵体。对包涵体进行洗涤,用8 mol/L尿素进行溶解,利用亲和层析的原理,通过Ni柱对CRP重组蛋白进行纯化。选择合适的透析复性液对纯化后的rhCRP进行透析复性,复性的过程均在低温下进行(2-8℃)[8, 9]。
1.2.4 对复性后的rhCRP进行免疫反应性检测选用鼠源单克隆抗体及HRP标记的二抗(羊抗鼠),并分别用Western blotting和ELISA等免疫学方法对复性后的重组CRP蛋白及天然状态的人源CRP蛋白进行体外免疫反应性检测。比较免疫反应的结果,分析重组和天然CRP蛋白在免疫学活性方面的区别。
2 结果 2.1 CRP原核表达载体的构建及鉴定结果利用基因工程方法将连接产物转化进入克隆菌株DH5α中,经LB抗性板筛选,挑取并培养阳性DH5α重组菌株,提取质粒进行酶切鉴定(图 1)。由图 1可知,利用基因工程方法成功得到重组原核表达载体pCold1-crp、pET28a-crp、pET32a-crp和pET41a-crp。将这些表达载体分别转化进入E.coli BL21(DE3)及Rosetta gami2(DE3)pLysS中,经抗性筛选后得到相应的重组表达菌株。
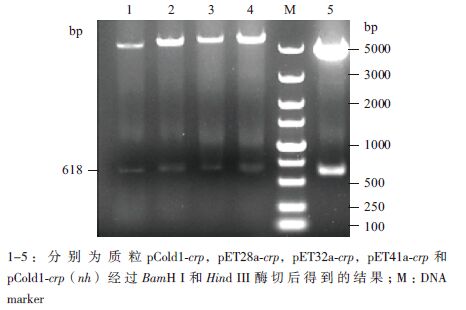
|
| 图 1 CRP 重组菌株的酶切鉴定结果 |
分别携带有重组表达质粒pCold1-crp、pET28a-crp、pET32a-crp或pET41a-crp的原核表达菌株BL21(DE3)和Rosetta gami2(DE3)pLysS在经过LB培养基及IPTG诱导后,菌体被用来进行SDS-PAGE分析(图 2-A,2-B)。从SDS-PAGE分析可知,rhCRP蛋白可以在菌株BL21 pCold1-crp,BL21(DE3)pET32a-crp及BL21 pET41a-crp中表达,而在BL21 pET28a-crp中则没有明显可见的表达;在菌株Rosetta gami 2(DE3)pLysS pCold1-crp和Rosetta gami2(DE3)pLysS pET32a-crp中有明显的表达,而在Rosetta gami2(DE3)pLysS pET28a-crp和Rosetta gami2(DE3)pLysS pET-41a-crp中则没有明显可见的表达。并且,菌株BL21(DE3)pCold1-crp和Rosetta gami2(DE3)pLysS pCold1-crp在没有诱导的情况下(图 2-A),重组CRP蛋白有微量的本底表达,这一点也通过使用HRP标记的6×His标签抗体借助Western blotting检测方法得到验证(图 2-C)。

|
| 图 2 CRP 蛋白在不同载体及菌株中表达情况的SDSPAGE分析 |
通过降低培养温度温度(37℃、25℃、20℃)及IPTG浓度(1、0.5和0.25 mmol/L)等对诱导条件进行优化,发现低温及低诱导剂浓度下,CRP重组蛋白仍以包涵体的形式存在,并且由于低温条件下菌体生长缓慢,菌体产量减少,菌株BL21(DE3)pET32a-crp及BL21 pET41a-crp中的重组CRP蛋白的表达量有所降低。
利用相同的方法将重组表达载体pCold1-crp(nh)转化进入BL21(DE3)中,LB板抗性筛选得到阳性克隆菌株BL21(DE3)pCold1-crp(nh),经诱导后成功得到无His标签的rhCRP蛋白(图 3-A)。
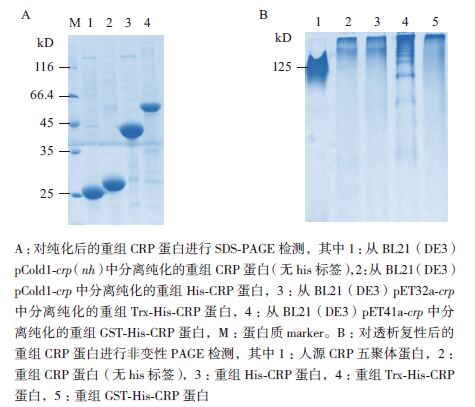
|
| 图 3 重组CRP 蛋白的纯化(A)及复性后的检测(B) |
由于重组菌株Rosetta gami2(DE3)pLysS的生长周期要长于BL21(DE3),故选取BL21(DE3)重组表达菌株进行诱导培养。收集菌体并进行超声破碎,对得到的包涵体进行洗涤(3次或以上),溶解于8 mol/L尿素后用Ni柱进行纯化。菌株BL21(DE3)pCold1-crp(nh)表达的重组CRP蛋白由于不具有His标签,故对包涵体进行多次洗涤,以便得到纯度较高的重组蛋白。用SDS-PAGE对纯化后的重组蛋白进行了分析(图 3-A)。
由图 3-A可知,纯化后得到的各种rhCRP蛋白所携带的蛋白质标签不一样,表现出不同的分子量大小。对纯化后的rhCRP进行透析复性,得到了可溶的rhCRP蛋白。利用人源CRP蛋白(五聚体结构)作为对照,对复性后的各种重组人CRP蛋白进行了非变性PAGE电泳分析(Native-PAGE,图 3-B)和免疫反应性分析。Native-PAGE 结果显示复性后的rhCRP形成多聚体结构,其聚集程度远高于天然状态的CRP五聚体结构。Western blotting结果(图 4)显示,CRP单克隆抗体(mAb1及mAb2)均不能同包括天然人源CRP蛋白在内的各种CRP重组蛋白发生免疫反应,而ELISA结果显示单克隆抗体mAb1及mAb2能够同人源CRP蛋白发生较强免疫反应,而与复性后的rhCRP蛋白几乎没有免疫反应。另外,单克隆抗体能够同ELISA中未经变性处理的人源CRP蛋白发生结合,而不能同Western blotting中经煮沸变性处理后失去高级结构的目的蛋白(人源CRP)结合,表明实验中使用的单克隆抗体所针对的CRP抗原表位是构像表位,而不是线性表位。
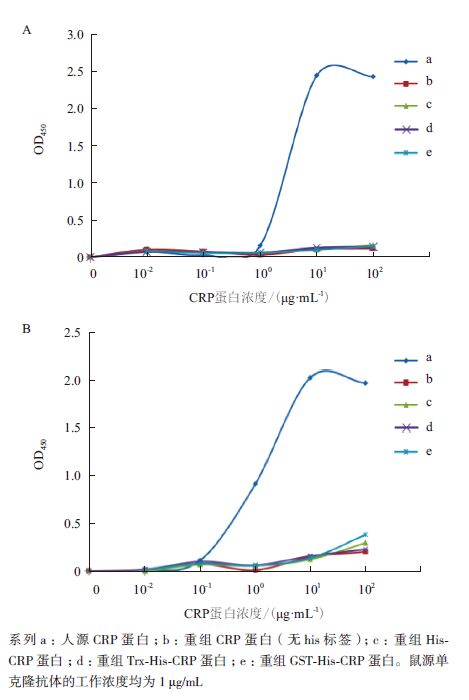
|
| 图 4 使用鼠源单克隆抗体mAb1(A)和mAb2(B)对重组CRP 蛋白复性后的ELISA 检测结果 |
本研究基于基因工程手段和原核表达的方法利用大肠杆菌BL21(DE3)和Rosetta gami2(DE3)pLysS成功表达出重组人CRP蛋白。对表达结果进行分析后发现,重组CRP蛋白在不同的表达载体和菌株中的表达情况及表达量是有差别的[10, 11]。其中,在宿主BL21(DE3)中利用pET32a作为表达载体得到的重组CRP蛋白的表达量要高于以pCold1和pET41a作为表达载体的表达量,这可能是由不同的表达载体所具有的蛋白质标签或启动子的不同所造成的[12, 13];另外,从分析结果可知当以pET41a作为表达载体时,重组CRP蛋白只能在BL21(DE3)中进行表达而不能在Rosetta gami2(DE3)pLysS菌株中进行表达,由此可知,在进行原核表达时表达菌株的选取也能影响重组蛋白的表达[14]。
在对重组CRP蛋白包涵体进行透析复性的过程中,一些有利于蛋白质保持结构稳定,促进其正确折叠的试剂被使用,如L-精氨酸、DTT、GSSG、GSH、甘油及一些盐离子等,这些试剂的使用是影响蛋白质折叠和得到可溶性CRP重组蛋白的关键因素之一。另外,合适的pH环境对于包涵体的复性也很重要[15, 16]。使用鼠源单克隆抗体mAb1和mAb2对复性后的重组CRP蛋白进行的Western blotting检测结果表明这两个抗体所针对的不是线性表位,对ELISA检测结果进行分析后发现,相对于天然人源CRP蛋白,重组CRP蛋白同样不具有免疫活性,而人源CRP蛋白则能够同鼠源单克隆抗体发生免疫反应。由此说明,单克隆抗体mAb1和mAb2针对的是CRP的构象表位,而复性后的CRP重组蛋白不能够进行正确的折叠及形成正确的五聚体结构。非变性PAGE电泳分析结果也表明,复性后CRP重组蛋白的聚集程度要高于人源CRP的五聚体结构,并且由菌株BL21(DE3)pET32a-crp分离纯化得到的重组CRP蛋白在经过复性后出现不同程度的聚集。透析复性的结果说明在体外进行类似于CRP蛋白这种多聚体蛋白的复性具有较高的难度,而其它重组CRP蛋白所具有的蛋白质标签也可能在较大程度上影响了CRP五聚体结构的正确形成。总之,重组CRP蛋白不具备免疫活性一方面主要和复性后的空间结构有关;另一方面,原核生物不具备真核生物蛋白质翻译后加工修饰的功能,这也是造重组CRP蛋白活性缺失的一个重要原因。
| [1] |
Koenig W, Sund M, et al. C-reactive protein, a sensitive marker of inflammation, predicts future risk of coronary heart disease in initia-lly healthy middle-aged men:results from the MONICA(Monitoring Trends and Reterminants in Cardiovascular Disease)Augsburg Cohort Study, 1984 to 1992[J]. Circulation, 1999, 99:237-242. |
| [2] | Szalai AJ, Agrawal A, et al. C-reactive protein[J]. Immunologic Research, 1997, 16(2):127-136. |
| [3] | Volanakis JE. Human C-reactive protein:expression, structure, and function[J]. Molecular Immunology, 2001, 38:189-197. |
| [4] | 高兰英, 刘增长. 人C-反应蛋白重组真核表达质粒的构建及其对人脐静脉内皮细胞LOX-1 和TF 表达的影响[J]. 中国生物制品学志, 2012, 25(11):1476-1481. |
| [5] | 陈腾祥, 李红梅, 胡水旺, 等. 重组人CRP的表达纯化及其内化进入HeLa细胞的观察[J]. 中国病理生理杂志, 2008, 24(6):1155-1160. |
| [6] | Burgess-Brown NA, Sharma S, Sobott F, et al. Codon optimization can improve expression of human genes in Escherichia col:a multi-gene study[J]. Protein Expr Purif, 2008, 59(1):94-102. |
| [7] | Gualerzi GO, Giuliodori AM, Pon CL, et al. Transcriptional and post-transcriptional control of cold-shock genes[J]. J Medic Biol, 2003, 3:527-539. |
| [8] | Williamson RA. Refolding of timp-2 from Escherichia col inclusion bodies[J]. Methods in Molecular Biology, 2010, 622:111-121. |
| [9] | Phan J, Yamout N, et al. Refolding your protein with a little help from REFOLD[M]. Methods Mol Biol, 2011, 752:45-57. |
| [10] | 侯鑫, 扈廷茂, 刘俊娥. 在大肠杆菌中表达有活性的人STK11蛋白[J]. 微生物学学报, 2007, 47(1):79-82. |
| [11] | 吉莉莉, 杨吉成, 等. 不同表达载体对人白细胞介素-18原核表达效率的影响[J]. 遵义医学院学报, 2003, 26(1):4-6. |
| [12] | 李红亮. 不同启动子对重组毕赤酵母高密度表达人胰岛素前体的影响[D]. 重庆:重庆理工大学, 2012. |
| [13] | 马超. 新型克隆载体和融合表达载体的构建[D]. 南京:南京师范大学, 2010. |
| [14] | 陈玉林. 不同类型幽门螺杆菌对GES-1细胞Cx32、Cx43表达及GJIC功能的影响[D]. 长沙:中南大学, 2010. |
| [15] | 余秀娟, 赵丽艳, 张晓光, 等. 体外蛋白质复性方法及小分子添加剂在复性过程中的作用[J]. 河北北方学院学报, 2013, 29(2):9-15. |
| [16] | 车婧, 韩金祥, 王世立, 等. 促进包涵体蛋白复性的几种有效添加剂[J]. 医学分子生物学杂志, 2004, 1(2):122-125. |




