2. 上海海洋大学水产与生命科学学院,上海 201306;
3. 桂林理工大学博文管理学院,桂林 541006;
4. 泗阳县水产技术指导站,泗阳 223700
2. College of Fisheries and Life Sciences,Shanghai Ocean University,Shanghai 201306;
3. Bowen College of Management,Guilin University of Technology,Guilin 541006;
4. Siyang Fisheries Technical Service Center,Siyang 223700
黄鳝(Monopterus albus),隶属硬骨鱼纲(Osteichthyes)辐鳍亚纲(Actinopterygii)合鳃目(Synbranchiformes)合鳃科(Symbranchidae)黄鳝属(Monopterus)。其整个发育史的表现是首先发育为雌性个体,待发育成熟,排卵后性逆转为雄性个体,具有典型先雌后雄的性腺发育过程[1],是研究鱼类性别调控机制的良好模式动物。黄鳝因其性腺发育的特殊性,一直以来都是科研工作者的研究热点之一。为了探知黄鳝性别调控机制,国内外学者开展了大量的研究。在内分泌调控方面,周秋白等[2]分析了产卵和未产卵黄鳝雌二醇(E2)的变化特征,结果表明E2水平对黄鳝性腺发育起重要作用,浓度的降低是黄鳝启动性逆转的前提。郭威等[3]的研究结果显示黄鳝血清E2在黄鳝间期性腺发育到雄性过程中显著下降,而T(睾酮)则显著上升,表明激素在黄鳝性腺发育中扮演重要角色。在分子调控机制方面,芳香化酶是生物体内C19雄激素转化为C18雌激素的关键条件因子[4],与大多数硬骨鱼类一样,黄鳝中芳香化酶基因(CYP19)具有两种不同的拷贝,分别为cyp19a1a和cyp19a1b,进一步分析表明这两个基因在黄鳝性逆转过程中呈现多态性表达,可能在黄鳝性逆转过程中起到一定作用[5, 6, 7]。JUK1为促丝裂原活化蛋白激酶家族成员,Xiao等[8]研究表明该基因对黄鳝性逆转起重要作用。WT1基因(wilms’tumor suppressor gene)和哺乳动物性腺发育相关,胡青等[9]克隆了黄鳝WT1基因并分析其在性腺发育过程中的表达,结果显示该基因在黄鳝雌性、间性和雄性性腺中的表达量在各时期都有先升高后降低的表达趋势。何智等[10]探究了黄鳝卵巢初次发育成熟及相关基因的表达分析,发现amh基因可能与卵巢青春期启动相关。
本实验室之前的研究成功构建了黄鳝性逆转过程中抑制差减文库[11]并对文库中的部分基因进行了克隆和表达分析[12, 13],但均未取得突破性进展,黄鳝性逆转相关机制尚未完全明确。进化史上鱼类处于较为原始的地位,其遗传力小于高等动物,因此探究黄鳝性别调控基因应从其自身的基因组中寻找。F64基因作为抑制差减文库筛选到的性别调控候选基因之一,同源性分析显示,无同源性基因视为新报道基因[14]。此外,未见其他相关报道。因此,对该基因的表达情况分析具有重要意义,将为进一步探究其功能提供重要依据。本研究以已成功克隆的性别调控相关基因F64[14]部分序列为模板,构建F64/pGM-T重组质粒并线性化,用RNA聚合酶体外转录合成正、反义地高辛标记的cRNA探针,通过原位杂交方法检测F64基因在黄鳝性腺发育过程中的表达情况,旨为明确该基因在黄鳝性逆转过程中的功能奠定基础,同时为类似研究提供参考。
1 材料与方法 1.1 材料 1.1.1 供试材料实验用黄鳝购置于农贸市场,用颈椎切断法处死黄鳝,采集性腺(50-100 mg),液氮速冻后,-80℃保存备用。
1.1.2 主要试剂Trizol Regent购自Invitrogen公司;RT-PCR Kit、RNase inhibitor、Oligo(dT)18、Taq酶、Apa I内切酶、Sac I内切酶、T7 RNA聚合酶、SP6 RNA聚合酶和DNase I 购自TaKaRa工程有限公司(日本);pGM-T载体、DH5α感受态、TIANprep Midi Plasmid Kit和TIANquick Midi Purification Kit购自天根生化科技(北京)有限公司;DIG RNA labeling mix(10×)购自Roche公司(瑞士);其他试剂为国产分析纯;所需引物均由上海生工生物工程有限公司合成。
1.1.3 F64引物上游引物:5'-AGGACAGGTTTA-CGGGTGAG-3';下游引物:5'-CCAGTATTCCCTCA-TAGACC-3'。
1.2 方法 1.2.1 性腺组织总RNA的提取取-80℃保存的性腺样本,于1.5 mL离心管,加入1 mL Trizol试剂,匀浆至无明显组织颗粒,室温静置5 min;加入200 μL氯仿,充分混匀,4℃ 12 000 r/min离心15 min;取上清500 μL于新离心管,加入600 μL异丙醇,静置10 min,4℃ 12 000 r/min离心10 min;弃上清,75%乙醇洗涤;自然干燥,加适量DEPC-H2O,室温自然溶解沉淀,检测RNA含量及完整度,-80℃保存备用。
1.2.2 逆转录及PCR扩增以上一步提取的RNA,按照RT-PCR试剂盒说明书,合成cDNA第一链;根据已经获得的F64基因序列设计一对引物,用于cRNA探针模板的合成。PCR反应体系为:cDNA第一链1 μL、上下游引物各1 μL、10×PCR buffer 2 μL、dNTP 1.6 μL、ddH2O 13.3 μL、Taq 0.1 μL。PCR反应程序为:94℃ 5 min;94℃ 30 s,58.5℃ 30 s,72℃ 30 s,30个循环;72℃ 3 min;4℃保存。
1.2.3 F64/pGM-T重组质粒的制备将PCR产物纯化后与pGM-T载体 16℃连接过夜,连接体系为:DNA 2 μL、10×T4 DNA Ligation Buffer 1 μL、T4 DNA Ligase(3 U/μL)1 µL、pGM-T 1 μL、灭菌水5 μL;转化大肠杆菌DH5α感受态细胞,在含有7 μL IPTG 和40 µL X-Gal的LB固体培养基平板培养过夜;于超净工作台上,挑取白色菌落接种于盛有约1 mL LB液体培养基(含氨苄青霉素,浓度为100 µg/mL)的2 mL离心管中,37℃,220 r/min摇床过夜培养;菌液PCR验证为目的片段后,送上海生工测序;将阳性克隆菌液10 μL加入到50 mL LB液体培养基过夜培养。
1.2.4 质粒提取及线性化根据TIANprep Midi Plasmid Kit试剂盒说明书进行质粒的提取;分别用Apa I和Sac I限制性内切酶将质粒线性化,体系为:DNA(质粒)2.5 μg、内切酶2.5 μL、buffer 5 μL、加灭菌水至50 μL,37℃中反应2 h;按照TIANquick Midi Purification Kit试剂盒将线性化的质粒纯化。
1.2.5 cRNA探针的合成向0.2 mL离心管中加入正、反义cRNA探针合成所需试剂,T7 RNA聚合酶反应体系为:模板500 ng、10×T7 buffer 2 μL、DTT 2 μL、DIG RNA labeling mix(10 mmol/L)1 μL、RNase Inhibitor 0.5 μL、T7 RNA聚合酶1 μL、加DEPC-H2O至20 μL;SP6 RNA聚合酶反应体系为:模板500 ng、10×SP6 buffer 2 μL、DTT 2 μL、0.1% BSA 2 μL、DIG RNA labeling mix(10 mmol/L)1 μL、Rnase Inhibitor 0.5 μL、SP6 RNA聚合酶1 μL、加DEPC-H2O至20 μL;将上述离心管混匀后,于37℃中哺育2 h;取1 μL进行电泳检测;具体步骤按照T7和SP6 RNA聚合酶试剂盒的说明进行。对合成成功的RNA探针进行纯化:于所合成的探针离心管中加入10 U(2 µL)的DNase I(RNase-free),37℃哺育30 min消化DNA模板;向上一步离心管中加1/10体积4 mol/L LiCl和1/4体积无水乙醇(在-20℃预冷),混合均匀,-20℃下静置2 h;4℃条件下12 000 r/min离心15 min;吸净上清,用70%乙醇(V/V,DEPC-H2O配置,-20℃预冷)清洗一次,12 000 r/min离心5 min;小心吸净上清,倒置于干净环境中至沉淀干燥;在RNA沉淀中加入30-50 µL DEPC-H2O让沉淀自行溶解,加入1 µL RNA inhibitor(20 U);电泳检测RNA的完整性,分光光度计检测浓度,分装-20℃保存备用。
1.2.6 F64原位杂交分析黄鳝各期性腺样本进行组织切片的制备并进行杂交前预处理;将地高辛标记的cRNA探针和组织切片55℃杂交过夜;杂交后进行漂洗,滴加Anti-DIG-AP于切片上,处理2 h,最后每片切片覆盖100 μL显色液,黑暗环境下显色2 h,封片,镜检分析,具体步骤参照之前研究[12]。
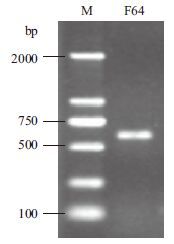
2 结果 2.1 总RNA提取及cRNA探针模板RT-PCR扩增总RNA提取电泳结果(图 1)显示,28S RNA和18S RNA条带清晰,亮度比接近2∶1,无其他DNA污染条带及明显降解条带,说明整个提取过程合理,RNA完整性较好。经RT-PCR扩增,电泳结果(图 2)显示600 bp左右的单一条带,符合预期。

|
| 图 1 黄鳝性腺总RNA 1.2% 琼脂糖凝胶电泳图 |
|
| M :DL2000 DNA Marker ;F64 :cRNA 探针模板 图 2 cRNA 探针模板PCR 扩增电泳图 |
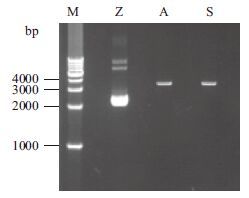
将验证正确的阳性克隆扩大培养,用于质粒的提取。结果(图 3)显示,质粒大部分为超螺旋状态,处于2 000 bp左右,说明质粒提取效果较好;限制性内切酶酶切后均为单一条带,片段长3 400 bp左右,线性化完全,结果符合预期。
|
| M :1kb DNA Marker ;Z :重组质粒;A :Apa I 单酶切;S :Sac I 单酶切 图 3 重组质粒及线性化电泳图 |
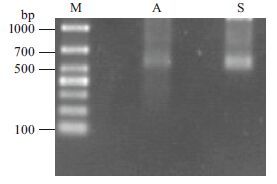
以线性化的质粒为模板,在T7和SP6 RNA聚合酶的作用下,用体外转录的方法,合成正义和反义探针;探针纯化后均为单一条带,长度在600 bp左右,符合预期大小(图 4)。
|
| M :DL1000 DNA Marker ;A :反义探针;S :正义探针 图 4 体外转录合成cRNA 电泳图 |
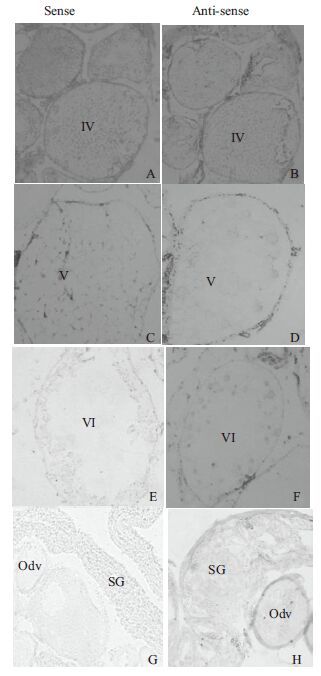
以正义探针为对照,反义探针杂交结果与前期研究结果一致[14],该基因性腺发育早期不表达,IV期卵泡和早期卵泡均未检测到阳性信号(图 5-B);排卵的V期卵巢开始表达,V期卵泡和VI期卵泡均有F64基因表达;精卵巢表达量明显高于排卵期卵巢,即随精巢组织发育表达量有增高趋势(图 5)。
|
| IV,V,VI :分别为对应各时相卵泡;SG :精原细胞;Odv :未成熟的卵泡;A,C,E,G :为各期性腺正义探针杂交结果;B,D,F,H :为各期性腺反义探针杂交结果 图 5 F64 基因原位杂交分析 |
在脊椎动物系统进化中,鱼类处于承前启后的关键地位,其性别决定研究一直是繁殖生物学领域的研究热点。然而由于鱼类的特殊生活方式,其性别决定机制十分复杂,目前为止只在少数鱼类中,如青鳉鱼(Oryzias latipes)发现了性别决定候选基因DMY[15],大多数鱼类还处于较模糊状态。黄鳝具有先雌后雄的性逆转现象,其基因组较小,只有600 Mb,是研究鱼类性别调控的良好模式动物。近些年来研究者开展了大量黄鳝性逆转相关研究,但大部分研究者都是简单的利用其他动物已知的基因去寻找鱼类性别调控基因,均未取得突破性的进展,从鱼类本身的基因组去筛选性别调控基因是最为有效的方法之一[16]。原位杂交技术是目前检测基因表达最为有效的手段之一,相比寡核苷酸探针和 DNA 探针,cRNA探针具有更强的特异性[17]。cRNA探针合成最常用的方法是体外转录法,它具有以下优点:以线性化质粒DNA为模板可反复转录生成RNA探针,合成量大;较低水平的转录,也可与超大量的mRNA形成互补稳定的杂交二聚体,探针活性高;转录起始于目的DNA上游启动子,终止于限制性内切酶酶切末端,定位精确;无需考虑外显子和内含子问题,方法简单易行[18]。
我们致力于寻找黄鳝性逆转过程中起关键作用的基因,本实验室之前成功构建了黄鳝性逆转抑制差减文库[11, 19],筛选到了部分与黄鳝性别调控相关基因。为进一步分析差异表达基因(F64)的功能,本研究体外转录合成cRNA探针,并检测其表达情况。结果显示所合成探针均为单一条带,且能有效检测基因的表达,即该方法有效可行。原位杂交结果显示F64基因于卵巢发育早期不表达,排卵的后期表达,间期性腺表达量有增高的趋势,表明该基因可能随着卵巢的败育和精巢的发育启动表达。Liu等[7]对黄鳝芳香化酶基因P45011β进行表达分析,该基因于卵巢不表达,精卵巢启功表达,精巢表达量显著提高;与之相反,P450arom基因主要于卵巢表达,精卵巢组织显著降低,精巢组织微量表达。芳香化酶是生物体内催化性激素合成的关键酶,其在硬骨鱼类的性别调控中起重要作用。而本研究显示F64基因的表达模式和芳香化酶基因具有类似情况,是否与黄鳝性腺发育激素调节相关,需要进一步分析。综上所述,F64基因具有与黄鳝精巢组织发育正相关的表达模式,与黄鳝的性别调控相关,其具体功能需进一步研究。本研究为进一步探究F64的功能奠定基础,同时为其他鱼类研究提供参考。
4 结论本研究体外转录合成了地高辛标记cRNA探针,原位杂交结果显示F64基因于卵巢发育早期不表达,后期启动表达,与黄鳝性别调控相关。
| [1] | Liu CK. Rudimentary hermaphroditism in the symbranchoid eel, Monopterus javanens is[J]. Sinensia, 1944, 15:1-8. |
| [2] | 周秋白, 吴华东, 吴红翔, 等. 产卵与黄鳝性转化关联的研究[J]. 经济动物学报, 2004, 8(2):89-91. |
| [3] | 郭威, 胡青, 高宇, 等. 黄鳝不同性腺发育期间血清甲状腺素、性激素和皮质醇水平的差异[J]. 淡水渔业, 2014, 44:13-17. |
| [4] | Simpson ER, Mahendroo MS, Means GD, et al. Aromatase cytochrome P450, the enzyme responsible for estrogen biosynthesis[J]. Endocr Rev, 1994, 15(3):342-355. |
| [5] | Zhang Y, Zhang WM, Yang HY. Two cytochrome P450 aromatase genes in the hermaphrodite rice field eel Monopterus albus:mRNA expression during ovarian development and sex change[J]. Endocrinology, 2008, 199(2):317-331. |
| [6] | Yu JH, Tang YK, Li JL. Cloning, structure, and expression pattern of the P450 aromatase gene in rice field eel(Monopterus albus)[J]. Biochem Genet, 2008, 46:267-280. |
| [7] | Liu JF, Guiguen Y, Liu SJ. Aromatase(P450arom)and 1lβ-hydrexylase(P45011β)genes are differentially expressed during the sex change process of the protogynous rice field eel, Monoptems albus[J]. Fish Physiol Biochem, 2009, 35(3):511-518. |
| [8] | Xiao YM, Chen LL, Liu J, et al. Contrast expression patterns of JNK1 during sex reversal of the rice field eel[J]. Journal of Experimental Zoology, 2010, 314B:242-256. |
| [9] | 胡青, 杨娇艳, 高宇, 等. 黄鳝WT1基因序列分析及在性腺发育过程中的表达[J]. 华中农业大学学报, 2014, 33:73-79. |
| [10] | 何智, 李依雪, 张碧鱼, 等. 黄鳝卵巢初次发育成熟及相关基因表达分析[J]. 水产学报, 2014, 37(4):536-544. |
| [11] | 曲宪成, 尚晓莉, 程翠, 等. 黄鳝性腺抑制差减文库的构建和分析[J]. 中国水产科学, 2011, 18(1):23-28. |
| [12] | 蒋骄云, 冯龙, 曲宪成. 黄鳝性逆转相关基因F4的克隆和表达分析[J]. 广西师范大学学报, 2013, 31(4):121-127. |
| [13] | 冯龙, 许世杰, 李园园, 等. 黄鳝性逆转相关基因的表达及定位分析[J]. 广东农业科学, 2014, 5:189-193. |
| [14] | 蒋骄云, 冯龙, 许世杰, 等. 黄鳝性逆转相关基因的克隆与表达[J]. 广东农业科学, 2012, 39(2):106-109. |
| [15] | Matsuda M, Nagahama Y, Shinomiya A, et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish[J]. Nature, 2002, 417:559-563. |
| [16] | 路畅, 苏利娜, 朱邦科. 鱼类性别决定及分化相关基因研究进展[J]. 湖北农业科学, 2014, 53(13):2981-2985. |
| [17] | 武晓敏, 黄静, 魏燕燕, 等. 小鼠Brd2基因探针的制备及其在荧光原位杂交实验中的应用[J]. 神经解剖学杂志, 2014, 30(3):335-339. |
| [18] | 曹玉文, 陆天才, 李锋, 等. 体外转录法制备地高辛标记cx43cRNA探针[J]. 农垦医学, 2004, 26(1):9-10. |
| [19] | Qu XC, Jiang JY, Shang XL, et al. Construction and analysis of gonad suppression subtractive hybridization libraries for the rice field eel, Monopterus albus[J]. Gene, 2014, 540(1):20-25. |




