2. 辽宁师范大学七鳃鳗研究中心,大连 116081
2. Lamprey Research Center,Liaoning Normal University,Dalian 116081
膜内在蛋白(membrane intrinsic proteins,MI-Ps),也被称为水通道蛋白(aquaporins,AQPs),是分子质量为26-35 kD的跨膜蛋白,可以促进水和小分子溶质运输,如甘油、尿素、氨、金属和二氧化碳。这些蛋白质构成了一个古老、丰富、非常复杂的蛋白质家族。AQPs具有高度保守的结构域,在细胞膜上以四聚体形式存在,每个单体由6个跨膜螺旋结构域组成,形成两个选择性孔道。一个孔道含有两个相对的NPA(Asn-Pro-Ala)模体,与水分子形成氢键和质子静电斥力,构成一个独特的沙漏形孔道;另一个选择性孔道含有ar/R(aromatic/arginine)模体,即Phe、Gly/Ser、Tyr/Ala 和Arg 4个氨基酸,位于孔道的最窄区域,控制着转运底物的专一性[1, 2, 3]。
AQPs广泛存在于动物、植物、微生物中,植物AQPs大致分为质膜内在蛋白(plasma intrinsic protein,PlPs)、液泡膜内在蛋白(tonoplast intrinsic proteins,TIPs)、类NOD26膜内在蛋白(nodulin 26-like intrinsic proteins,NIPs)、小分子碱性膜内在蛋白(small and basic intrinsic proteins,SIPs)、类GlpF膜内在蛋白(GlpF-like intrinsic proteins,GIPs)以及XIPs(X intrinsic proteins)和HIPs(hybrid intrinsic proteins)7种类型。位于生物膜上的AQPs参与水分跨膜运输,进而调节细胞内与细胞间的水分流动,维持体内水分平衡,从而使细胞正常进行各种生理活动[3, 4]。哺乳动物中AQPs的研究已十分广泛,目前发现13种AQPs(AQP0-12),分为3个亚系:水通道蛋白(AQP0、1、2、4、5、6和8),超级水通道蛋白(AQP11和12)和水甘油通道蛋白(AQP3、7、9和10)。除了在体液的分泌、吸收以及调节细胞体积过程中对水的转运,在细胞黏附、迁移、增殖和分化等过程中也发挥重要的作用,其机制可能参与由cAMP(cyclic adenosine monophosphate)、MAPK(mitogen-activated protein kinase)、PKC(protein kin-ase C)和PI3K/Akt/mTOR介导的信号转导通路[5, 6, 7]。在鱼中AQPs亚家族(AQP0-12)的序列分析也已完成,分为水通道蛋白(AQP0、1、4),水甘油转运通道蛋白(AQP3和AQP7-10),水尿素转运通道蛋白(AQP8)和两个非典型的水通道蛋白(AQP11和12)[8]。
水通道蛋白3(aquaporin 3,AQP3)通常对水以及小分子溶质,如甘油和尿素具有通透性。哺乳动物AQP3在肾集合管、表皮、肺的气道、结膜和膀胱等多种组织器官中表达;其表达水平受血管加压素、cAMP、糖皮质激素和高渗性调控;镍、铜离子或者酸性条件下可阻断AQP3的运输功能[6, 9, 10]。近来研究发现,AQP3是受Notch信号通路调控的靶基因之一,AQP3通过与Notch信号通路的相互作用,可以抑制角质形成细胞的分化[11]。AQP3还可通过激活ERK通路,进而增加基质金属蛋白酶3(matrix metalloproteinase-3,MMP-3)在前列腺细胞中的表达和分泌,从而促进前列腺癌细胞的侵袭和转移[12]。已有的研究表明,AQP3可能在细胞黏附、迁移、增殖和分化等过程中均发挥重要的作用,但其具体机制还需要进一步研究。有关鱼类AQP3的研究还较少,包括斑马鱼(Danio rerio)[8]、鳉鱼(Fundulus heteroclitus)[13]、鲮鱼(Tribolodon hakonensis)[14]、鳗鱼(Anguilla anguil-la)[15]、罗非鱼(Oreochromis mossambicus)[16]、萨罗罗非鱼(Sarotherodon melanotheron)[17]。这些研究结果表明,AQP3与鱼类的防止细胞肿胀、失水,参与尿素、甘油、氨转运及渗透压调节过程有密切关系。
在海洋生物中,七鳃鳗(Lampetra japonica)是迄今所知道的最原始的无颌类脊椎动物之一,它印记了无脊椎动物的进化历史,也为脊椎动物的起源与进化提供了丰富的遗传信息。在进化上,七鳃鳗是联系无脊椎动物和脊椎动物之间的重要阶元,具有极高的研究价值[18]。本研究首次克隆得到七鳃鳗(L. japonica)Aqp3基因cDNA全长序列,并进行序列进化和组织特异性表达水平的分析,旨在为进一步研究水通道蛋白的进化及其在七鳃鳗中的功能提供理论基础。
1 材料与方法 1.1 材料 1.1.1 实验动物成年七鳃鳗购买自黑龙江省松花江流域同江地区,体重约112.0-274.3 g,体长约36.4-58.4 cm,七鳃鳗活体驯养在实验室水族箱内(2-5℃),3-4周后进行实验。
1.1.2 试剂DNA纯化试剂盒、质粒小量提取试剂盒、RNAiso Plus、PrimeScriptTM RT reagent Kit with gDNA Eraser、TaKaRa 3'-Full RACE Core Set Ver.2.0、SYBR PrimeScriptTM RT-PCR试剂盒及DNA Marker等均购于宝生物工程(大连)公司。
1.1.3 引物合成和测序引物合成及重组质粒目的基因测序由生工生物工程(上海)股份有限公司测定。
1.2 方法 1.2.1 克隆七鳃鳗Aqp3基因cDNA全长序列从七鳃鳗血液中分离外周血白细胞[19],用RNAiso Plus试剂提取mRNA反转录合成cDNA。七鳃鳗Aqp3(LjAqp3)的EST序列来自本实验室构建的七鳃鳗白细胞cDNA文库(4.5×106 pfu/mL),设计引物见表 1。LjAqp3 RT-PCR扩增反应条件:94℃ 3 min;94℃ 1 min,56℃ 30 s,72℃ 1 min,共35个循环;最后72℃延伸10 min。提取质粒进行DNA测序,获得cDNA片段。3' RACE扩增按照TaKaRa公司的3'-Full RACE Core Set Ver.2.0试剂盒说明书进行,1st PCR 反应程序:94℃ 30 s,58℃ 30 s,72℃ 1 min,25个循环;2nd PCR 反应程序:94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环。RACE产物经纯化、克隆和测序后,用DNAman(Lynnon Biosoft)软件拼接获得七鳃鳗Aqp3基因cDNA全长序列。重新设计引物扩增ORF区,PCR反应条件:94℃ 3 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,共30个循环;最后72℃延伸10 min。
根据测序结果进行拼接得到LjAqp3的全长cDNA序列,用Bioedit 7.0软件推测其编码的氨基酸序列,开放阅读框(ORF)分析使用NCBI在线预测软件(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)。信号肽预测分析使用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)。跨膜区域预测使用TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/TMHMM/),用ClustalX 2.0软件进行多重序列比对,用MEGA 6.0软件neighbor-joining(NJ)法进行系统发育树的构建。
1.2.3 实时荧光定量PCR检测LjAqp3mRNA转录水平使用RNAiso Plus试剂分别提取3条七鳃鳗的眼、鳃、肾、肠、脑、肌肉、口腔腺、生殖腺(雄性)、卵(雌性)及白细胞的总RNA。使用gDNA Eraser对RNA样品进行纯化。LjAqp3 mRNA转录分析使用TaKaRa的PrimeScriptTM RT reagent Kit with gDNA Eraser 反转录试剂盒、SYBR® Premix Ex TaqTM II荧光染料和TaKaRa TP7500 PCR检测系统。七鳃鳗GAPDH基因作为内参(表 1)。PCR反应体系为25 μL,包含12.5 μL Master SYBR Green(TaKaRa)mix,1 mL 引物(10 mmol/L),2 mL cDNA(100 ng/mL)及水。PCR反应条件为:95℃ 30 s;95℃ 5 s,56℃ 30 s,72℃ 30 s,共40个循环。每个样品均重复3次,得到特异性的熔解曲线和扩增曲线,通过2%琼脂糖凝胶电泳确认反应是否完成。使用2-ΔΔCt方法对LjAqp3 mRNA转录水平进行计算分析[20]。
2 结果 2.1 LjAqp3基因克隆及序列分析RT-PCR扩增得到长806 bp的片段,克隆测序后经BLAST分析确认为LjAqp3基因的核心序列,3' RACE获得 224 bp的3' 末端序列,将这2部分序列拼接最终得到LjAqp3基因的全长cDNA序列1 137 bp。用LjAqp3 Forward和 LjAqp3 Reverse扩增得到900 bp的ORF区。LjAqp3完整的cDNA序列及其氨基酸序列(图 1)显示,LjAqp3 cDNA的全长序列包括13 bp 5'非翻译区(5' UTR),900 bp的阅读框ORF以及224 bp 3' 非翻译区(3' UTR),推测ORF可编码299个氨基酸,蛋白质分子质量预测为32.1 kD,理论等电点为8.86。七鳃鳗Aqp3基因的3' UTR有一个polyA加尾信号AATAAA。通过氨基酸序列分析发现,LjAQP3的-NH2和COOH-均位于膜内,含有2个形成水孔道的天冬酰胺-脯氨酸-丙氨酸(Asn-Pro-Ala,NPA)模体。信号肽和跨膜区域预测结果表示,LjAQP3的 N 端前 27 个为信号肽,含有6个跨膜螺旋结构域,即TM1-TM6(21-43,58-80,101-123,156-175,188-210,238-260),同时由5个loop环连接,即loopA-E(44-57,81-100,124-155,176-187,211-237),其中3个胞外环loopA、loopC、loopE,2个胞内环loop B和loop D,而loop B和loop E均为半螺旋环(图 1)。LjAqp3序列已被提交到NCBI数据库(KR054618)。

|
| 方框区表示起始密码子和终止密码子;黑色箭头区表示信号肽序列(1-27);灰底部分表示6 个跨膜螺旋结构域(TM1-TM6);双下划线表示胞外环loopA、C、E,单下划线表示胞内环loopB、D ;黑底部分表示2 个NPA 模体;斜体且加粗的碱基表示polyA 加尾信号(AATAAA) 图 1 LjAqp3 基因全长cDNA 及其氨基酸序列 |
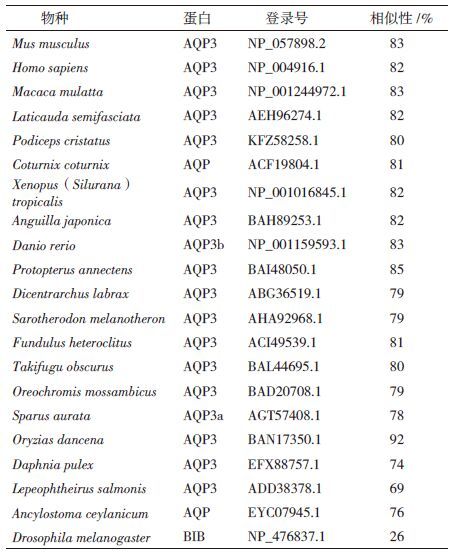
AQP3单体的6个跨膜螺旋结构域(TM1-TM-6),2个NPA模体分别位于loop B和loop E半螺旋环上,形成芳香族/精氨酸(ar/R)结构的4个氨基酸残基以及形成水孔道的5个保守残基P1-P5(Y、D、R、P和I/V)(图 2-A)。使用ClustalX 2.0软件对LjAQP3与其它11个物种AQP3进行序列比对,序列分析发现LjAQP3同其它物种有很高的保守性,含有较多的同源序列(图 2-B)。与非洲爪蟾(Xenopus(Silurana)tropicalis)、日本鳗鲡(Anguilla japonica)、斑马鱼(Danio rerio)、原鳍鱼(Protopterus annectens)、欧洲鲈(Dicentrarchus labrax)、萨罗罗非鱼(Sarotherodon melanotheron)、底鳉(Fundulus heteroclitus)、暗纹东方鲀(Takifugu obscurus)、罗非鱼(Oreochromis mossambicus)、金头雕(Sparus aurata)和恒河青鳉(Oryzias dancena)的相似性分别为82%、82%、83%、85%、79%、79%、81%、80%、79%、78%和92%。第一个高度保守的NPA前端序列为SGGH(L/I),第二个高度保守的NPA后端序列为RD,且其羧基末端的序列-KKXX几乎都包含2个赖氨酸残基。苯丙氨酸(F63)、甘氨酸(G199)、酪氨酸(Y208)、精氨酸(R214)4种氨基酸残基形成1个ar/R结构。

|
| 图 2 LjAQP3 同源序列多重比对 |
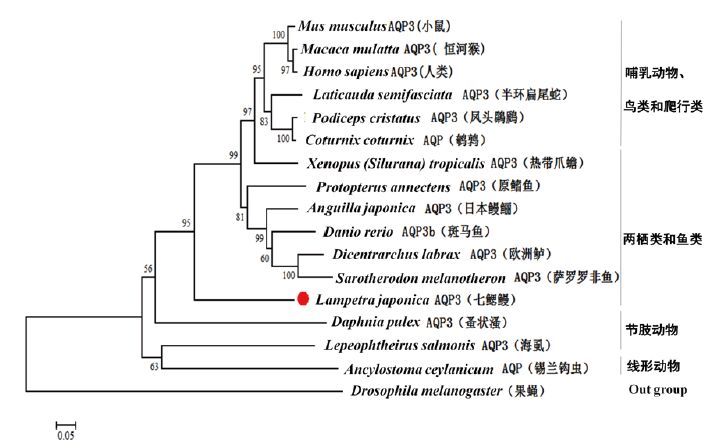
使用MEGA 6.0软件中neighbor-joining建树方法对LjAQP3与其它16个物种AQP3/AQP进行系统发育树构建(图 3),相似性见表 2。系统发育树主要包括4个集群:(1)哺乳动物、鸟类和爬行动物(小鼠、人、恒河猴、半环扁尾蛇、凤头鸊鷉、鹌鹑);(2)两栖动物和鱼类(非洲爪蟾、日本鳗鲡、斑马鱼、原鳍鱼、欧洲鲈、萨罗罗非鱼);(3)节肢动物(蚤水溞、海虱);(4)线形动物(锡兰钩虫);果蝇为Out group。LjAQP3处于“两栖动物和鱼类”分支。
|
| 图 3 邻接法构建LjAQP3 的系统发育树 |
对七鳃鳗各个组织中LjAqp3的转录水平进行测定。设LjAqp3基因在脑中表达量为1,根据LjAqp3在各组织中的相对表达量作图。结果(图 4)表明,LjAqp3在七鳃鳗上述10种组织中均有表达,其中在鳃中表达量最高;其次是肌肉、口腔腺、肠、肾、卵、生殖腺、白细胞;而在眼中表达量较少。

|
| 图 4 实时荧光定量PCR 检测正常七鳃鳗各组织中LjAqp3 mRNA 表达 |
水通道蛋白是一个古老、丰富、非常复杂的跨膜转运蛋白家族,其可运输水分或小分子溶质,如甘油、CO2、尿素等。至今,哺乳动物中已发现13个成员;植物中已发现7种类型;两栖类、鱼类、昆虫、菌类中也相继发现不同成员[2, 3, 4]。水通道蛋白3属于水甘油转运蛋白,其分布广泛,与多种体内代谢活动相关。
七鳃鳗以其独特的进化地位和独有的免疫系统成为研究脊椎动物免疫系统起源和进化的重要物种[21]。本研究首次从七鳃鳗中克隆得到AQP3基因。其氨基酸序列显示,LjAQP3含有两个典型的NPA(T)基序和1个ar/R结构域,并保留了较多高度保守的残基(Y123、D215、R219、P242和V243/I243)和氨基酸序列(GT、ILV、FGCG、AFGF、SGGHLNPA、VIF、IGT、AL、NNPXP、IG、SMGXN、VNPARD、GPR和GWG)[8]。LjAQP3的2个NPA模体和1个ar/R结构对水或溶质分子(如甘油和尿素等)孔道的形成非常关键[2, 22, 23]。在与非洲爪蟾、日本鳗鲡、斑马鱼等11个物种的AQP3进行序列比对时发现,这些物种的AQP3的B环上均有半胱氨酸(Cys91),该半胱氨酸为汞的抑制位点,AQP3也因此被称为汞敏感水通道蛋白[9, 10, 11, 12, 13]。而七鳃鳗AQP3的序列中该位点已被丙氨酸(Gla91)取代,表明七鳃鳗AQP3有其结构和功能的独特性,其具体结构与功能还有待进一步研究。
氨基酸序列比对分析表明本研究获得的水通道蛋白3的序列与其它物种的AQP3具有较高的同源性,与恒河青鳉(Oryzias dancena)AQP3序列最为相似,氨基酸酸同源性高达92%。七鳃鳗是目前存在的最古老的脊椎动物之一。系统发育树分析表明,LjAQP3可能是AQP3较原始的形式,相较于节肢动物,其结构上与高等动物AQP3更加接近,位于高等脊椎动物AQP3的“鱼类”分支,这也与目前研究的七鳃鳗的进化地位相一致。
哺乳动物AQP3在肾集合管、表皮、肺的气道、结膜和膀胱等多种组织器官中表达[9]。七鳃鳗AQP3在检测的眼、鳃、肾、肠、脑、肌肉、口腔腺、生殖腺(雄性)、卵(雌性)、白细胞组织及细胞中均有表达,表明其作为细胞膜重要的水通道蛋白,在水和非离子型的溶质运输及维持机体体液稳态中起着至关重要的作用。其中,在鳃中表达量最高,可能与鳃作为渗透压调节的主要器官,是体内与体外环境进行离子和水交换的主要场所有关[17]。七鳃鳗AQP类型分布是否有着组织细胞部位的选择性,其在体内受到哪些因素的调节,将是下一步深入研究的问题。
4 结论本研究首次从七鳃鳗中克隆了LjAqp3基因,基因全长1 137 bp,由900 bp的开放阅读框组成,可编码299个氨基酸,含有6个跨膜螺旋结构域和一个信号肽;有2个NPA模体和1个ar/R结构;其序列具有较高的保守性;LjAqp3在七鳃鳗中分布广泛,在多种组织器官中表达。
| [1] | Fujiyoshi Y, Mitsuoka K, de Groot BL, et al. Structure and function of water channels[J]. Curr Opin Struct Biol, 2002, 12(4):509-515. |
| [2] | Chauvigné F, Lubzens E, Cerdà J. Design and characterization of genetically engineered zebrafish aquaporin-3 mutants highly permeable to the cryoprotectant ethylene glycol[J]. BMC Biotechnol, 2011, 11:34. |
| [3] | Abascal F, Irisarri I, Zardoya R. Diversity and evolution of membrane intrinsic proteins[J]. Biochim Biophys Acta, 2014, 1840(5):1468-1481. |
| [4] | 王芳, 董乐, 戴聪杰, 等. 甘草质膜水通道蛋白GuPIPl对甘油的转运[J]. 生物技术通报, 2011(5):172-177. |
| [5] | Zhu C, Jiang Z, Bazer FW, et al. Aquaporins in the female reproductive system of mammals[J]. Front Biosci(Landmark Ed), 2015, 20:838-871. |
| [6] |
Cutler CP, Martinez AS, Cramb G. The role of aquaporin 3 in teleost fish[J]. Comp Biochem Physiol A Mol Integr Physiol, 2007, 148 (1):82-91. |
| [7] | 苏维恒. 水通道蛋白的结构与功能研究[D]. 长春:东北师范大学, 2013:1-8. |
| [8] | Tingaud-Sequeira A, Calusinska M, Finn RN, et al. The zebrafish genome encodes the largest vertebrate repertoire of functional aquaporins with dual paralogy and substrate specificities similar to mammals[J]. BMC Evol Biol, 2010, 10:38. |
| [9] | 陈利琼, 朱雪琼. 水通道蛋白3的研究进展[J]. 医学研究杂志, 2012, 41(6):8-10. |
| [10] | 熊正方, 刘慧妹. 水通道蛋白3功能的研究动态[J]. 中华生物医学工程杂志, 2008, 14(5):391-393. |
| [11] | Guo L, Chen H, Li Y, et al. An aquaporin 3-notch1 axis in keratinocyte differentiation and inflammation[J]. PLoS One, 2013, 8(11):e80179. |
| [12] | Chen J, Wang Z, Xu D, et al. Aquaporin 3 promotes prostate cancer cell motility and invasion via extracellular signal-regulated kinase 1/2-mediated matrix metalloproteinase-3 secretion[J]. Mol Med Rep, 2015, 11(4):2882-2888. |
| [13] | Jung D, Adamo MA, Lehman RM, et al. A novel variant of aquaporin 3 is expressed in killifish(Fundulus heteroclitus)intestine[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2015, 171:1-7. |
| [14] | Hirata T, Kaneko T, Ono T, et al. Mechanism of acid adaptation of a fish living in a pH 3. 5 lake[J]. Am J Physiol Regul Integr Comp Physiol, 2003, 284(5):R1199-R2212. |
| [15] | Cutler CP, Cramb G. Branchial expression of an aquaporin 3(AQP-3)homologue is downregulated in the European eel Anguilla anguilla following seawater acclimation[J]. J Exp Biol, 2002, 205(Pt 17):2643-2651. |
| [16] | Watanabe S, Kaneko T, Aida K. Aquaporin-3 expressed in the basolateral membrane of gill chloride cells in Mozambique tilapia Oreochromis mossambicus adapted to freshwater and seawater[J]. J Exp Biol, 2005, 208(Pt 14):2673-2682. |
| [17] | 甘远迪, 赵金良, Jeerawat Thammaratsuntorn, 等. 萨罗罗非鱼AQP3 cDNA序列克隆及盐度胁迫下组织表达特征[J]. 动物学杂志, 2014, 49(4):560-569. |
| [18] | Amemiya CT, Saha NR, Zapata A. Evolution and development of immunological structures in the lamprey[J]. Curr Opin Immunol, 2007, 19(5):535-541. |
| [19] | Wu F, Zhao J, Chen L, et al. A novel BTK-like protein involved in immune response in Lethenteron japonicum[J]. Immunol Lett, 2012, 146(1-2):57-63. |
| [20] | Arocho A, Chen B, Ladanyi M, et al. Validation of the 2- DeltaDeltaCt calculation as an alternate method of data analysis for quantitative PCR of BCR-ABL P210 transcripts[J]. Diagn Mol Pathol, 2006, 15(1):56-61. |
| [21] | Pancer Z, Amemiya CT, Ehrhardt GR, et al. Somatic diversi-fication of variable lymphocyte receptors in the agnathan sea lamprey[J]. Nature, 2004, 430(6996):174-180. |
| [22] | Ishibashi K. Aquaporin subfamily with unusual NPA boxes[J]. Biochim Biophys Acta, 2006, 1758(8):989-993. |
| [23] | Verma RK, Prabh ND, Sankararamakrishnan R. Intra-helical salt-bridge and helix destabilizing residues within the same helical turn:Role of functionally important loop E half-helix in channel regulation of major intrinsic proteins[J]. Biochim Biophys Acta, 2015, 1848(6):1436-1449. |