2. 江西省农业科学院农业应用微生物研究所,南昌 330200;
3. 江西省科学院微生物研究所,南昌 330029
2. Institute of Agricultural Applied Microbiology,Jiangxi Agricultural Academy of Sciences,Nanchang 330200;
3. Institute of Microbiology,Jiangxi Academy of Sciences, Nanchang 330029
昆虫质型多角体病毒(cypovirus,CPV)属于呼肠孤病毒科,质型多角体病毒属。根据病毒基因组dsRNA片段在聚丙烯酰胺或琼脂糖凝胶中电泳图谱的差异,目前CPV已被分为20个电泳型[1, 2]。马尾松毛虫质型多角体病毒(dendrolimus punctatus cytoplasmic polyhedrosis Virus 1,DpCPV 1)属于1型,该病毒基因组S8片段编码一个由390个氨基酸组成、分子量为43.78 kD的非结构蛋白(p44),是我国的特有种类,于1973年首次分离得到[3]。
随着结构生物学与信息处理等新技术的运用与发展,包括X射线晶体衍射、低温电镜与三维重构技术,质型多角体病毒结构学研究方面已取得突破性进展[4]。Yu等[5]利用低温电子显微镜技术在分辨率上研究了衣壳蛋白的三维结构,在与基因组直接作用的区域中观察到螺旋与β发卡结构之间的构象改变,同时发现了特有的加帽结构和释放通道。Cheng等[6]通过低温电子显微镜研究发现,CPV的五聚体塔状蛋白的酶区域是拓扑结构高度保守并且有5个连接着鸟苷酰基转移酶和甲基转移酶区域的独特的通道;通过氨基酸序列推理,LPP是由S7片段编码P50蛋白修饰后得到的。Yang等[7]研究发现:当CPV病毒粒子进行转录时,衣壳蛋白VP1A、VP1B和塔状蛋白VP3构象发生变化,衣壳空间扩大和塔状蛋白周围通道的加宽,使得基因组RNA从紧凑的病毒粒子衣壳更加灵活的转录和输出。
相对CPV结构蛋白的深入研究,CPV非结构蛋白的研究相对缓慢。文力[8]、张万菊[9]等对DpCPV 1基因组中的第9片段(S9)的编码序列进行了cDNA克隆和序列测定,并对NS5蛋白的表达和功能进行了初步分析。汪洋等[10]研究发现由DpCPV基因组第9片段编码的非结构蛋白NS5蛋白在感染昆虫细胞时,定位在昆虫细胞的细胞膜上。段兵[11]和胡建芳等[12]对马尾松毛虫CPV基因组第8片段进行序列分析和原核表达。凝胶迁移阻抑分析(EMSA)显示,由CPV基因组第8片段编码的p44蛋白具有序列非特异性的ssRNA结合活性,不与dsRNA、ssDNA、dsDNA结合;进一步研究发现p44氨基酸序列116-197 aa之间的区域(富含谷氨酸区域)为单一的RNA结合区域[13]。
目前,质型多角体病毒S8片段编码的非结构蛋白p44蛋白的真核表达和昆虫细胞上定位研究还未见报道。本研究利用Bac-to-Bac杆状病毒表达系统,构建重组Bacmid-S8-eGFP和Bacmid-S8,将DpCPV 1 S8片段和绿色荧光蛋白基因(eGFP)以C端融合的方式在昆虫Sf9细胞中进行融合表达及细胞定位,旨在为下一步非结构蛋白p44在CPV复制过程中的功能研究提供基础数据。
1 材料与方法 1.1 材料 1.1.1 细胞系、菌种及质粒草地贪夜蛾(Spodoptera frugiperda)细胞系Sf9由中国科学院武汉病毒所昆虫病毒基因工程学科组提供,于27℃培养,生长培养基为Grace’s昆虫细胞培养基(10%胎牛血清)。大肠杆菌(Escherichia coli)DH5α、BL21和DH10B菌株均为本实验室保存;载体pMD18-T vector系统、T4 DNA Ligase及其buffer购自宝生物工程(大连)有限公司,载体pET-28a、pFastBacDual、pFastBacDual-eGFP(GFP片段插入在PstⅠ和Hind Ⅲ酶切为点之间)和DpCPV 1基因序列S8片段为本实验室保存。
1.1.2 主要试剂DM2000 DNA Marker 购自康为世纪生物科技有限公司;DNA MarkerⅢ购自东盛生物科技有限公司产;预染蛋白Marker购自南京生兴生物技术公司;异丙基-β-D硫代半乳糖苷(IPTG)购自武汉贝特生物公司;Ni-NTA His.BindTM Resins购自Novagen公司;其余药品均为国产分析纯以上。转染试剂lipofectin 购自Invitrogen公司(美国);荧光染料 Hoechst 33258 购自 Biosharp公司(美国);PVDF膜购自Millipore公司(美国);PCR纯化试剂盒购自Promega公司(上海);质粒提取试剂盒购自Promega公司(上海)。
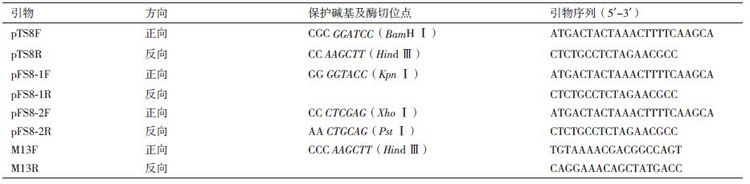
1.1.3 引物合成根据DpCPV 1基因组S8片段的核苷酸序列,设计引物;除通用引物M13F 和M13R(Cat. No. N530-02,Invitrogen公司,美国)外,其余引物均由上海生工生物工程技术服务有限公司合成。引物列表,见表 1。
以实验室保存的DpCPV病毒基因组S8为模板,以pTS8F、pTS8R为引物,利用两步法进行RT-PCR扩增[14]。PCR扩增的片段通过相应的酶切位点酶切,连接到原核表达载体pET-28a(pET28a-S8)。将阳性重组质粒转化大肠杆菌感受态细胞BL21,1 mmol/L的IPTG于37℃诱导表达4 h。收集菌体,经超声破碎后离心,获得包涵体蛋白。用8 mol/L的尿素溶液溶解包涵体蛋白,然后通过Ni-NTA树脂柱进行蛋白纯化。将收集的洗脱流出液装入透析袋,对含适量甘油的0.01 mol/L PBS pH8.0透析48 h,每4-8 h更换一次PBS溶液。然后,将上述透析袋包埋在聚乙二醇粉末中,对蛋白溶液进行浓缩。并为下一步制备抗体做准备。
1.2.2 抗体制备纯化的目的蛋白常规方法(淋巴加皮下注射)免疫家兔,制备抗血清。实验兔、鼠饲养,抗原注射及最终采血均委托武汉爱博泰克生物科技有限公司进行。
1.2.3 重组Bacmid病毒的构建及PCR检测以pFS8-1F、pFS8-1R和pFS8-2F、pFS8-2R为引物,以pET28a-S8载体为模板进行PCR扩增。将上述胶回收的S8片段分别连接到pFastBacDual和pFastBa-cDual-eGFP载体上。依照质粒提取试剂盒说明书中介绍的方法,分别提取质粒。酶切鉴定阳性克隆子,分别命名为pFastBac-S8和pFastBac-S8-eGFP。
将pFastBac-S8、pFastBac-S8-GFP和pFastBac-Dual空载体(用作对照)分别转座到含有AcBacmid和helper质粒的DH10B感受态细胞,涂布于LA培养基平板[含50 μg/mL卡那霉素(kanamycin,Ka-na),7 μg/mL庆大霉素(gentamicin,Gm),10 μg/mL四环素(tetracycline,Tetra),100 μg/mL 5溴-4-氯-3-吲哚-β-D-乳糖苷(5-bromo-4-chloro-3-indolyl- β-D-galactoside,X-gal)和40 μg/mL异丙-β-D-硫代吡喃半乳糖苷(thiogalactopyranoside,IPTG)],于37℃培养24-48 h。检查平板上的蓝白斑,白斑即重组Bacmid的菌落。挑取白色单菌落,接种于5 mL LB培养基,37℃振荡培养14 h。取出3 mL于10 000×g 离心10 min,抽提重组Bacmid质粒。抽提Bacmid质粒的具体方法参考Bac-to-Bac® Baculovirus Expression Systems手册的3.5节。
以上述提取的重组Bacmid为模板,以通用引物M13F和M13R以及目的片段上两端的引物(表 1)进行PCR检测。鉴定正确的重组Bacmid分别命名为Bacmid-p44、Bacmid-p44-eGFP和Bacmid-Dual,于4℃冰箱中保存。
1.2.4 重组病毒转染昆虫细胞Sf9在35 mm的培养皿中接种5×105的Sf9 细胞,27℃培养过夜。在生物安全柜中弃去上层培养基,加入2 mL无血清的培养基室温放置1 h。取5 μg重组Bacmid质粒以及6 μL脂质体(Invitrogen,美国),分别用无血清培养基稀释至100 μL,将两者混合。静置15-40 min 后,向脂质体和DNA的混合液中加入800 μL培养基,混匀,移入35 mm培养皿中,培养6 h。移去转染液,添加2 mL含10%血清的培养基,混匀,培养72 h后倒置荧光显微镜下观察是否有荧光信号。离心回收上清,即为P1病毒贮液,4℃避光保存。
按照2×106个细胞/孔的量将Sf9细胞转入35 mm的培养皿中,贴壁生长至少1 h。每孔加入适量的上述P1病毒贮液,27℃湿盒孵育72 h。500×g离心5 min取上清,即为P2病毒贮液。重复上述方法扩增P3病毒贮液,用于重组Bacmid的高效表达。
1.2.5 Westernblot 检测 取P3病毒贮液感染Sf9细胞,72 h后将细胞吹起,500×g离心5 min,取适量细胞沉淀,加50 μL的SDS-PAGE上样buffer,进行SDS-PAGE电泳后转膜,以p44蛋白多克隆抗体为一抗,辣根过氧化酶标记的羊抗兔的血清(武汉博士德生物工程有限公司)为二抗,用Western blot法检测p44蛋白的表达。
1.2.6 p44的亚细胞定位用P2病毒贮液感染贴壁生长24 h的Sf9细胞(覆盖玻底培养皿50%),27℃培养24 h,移除细胞培养基,用PBS(137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH7.4)将细胞洗1遍,加入4%多聚甲醛(北京赛驰生物科技有限公司)(过滤除菌)室温静置固定15 min,再用PBS(pH7.4)将细胞洗1遍;加入透化液[0.25% TritonX-100(上海索莱宝生物科技有限公司)],室温静置10 min;用PBS(pH7.4)洗涤细胞,加荧光染料hoechst 33258染核5-10 min,然后用PBS洗3遍,再加入1 mL PBS。激光共聚焦显微镜(TCS SP2,Leica,德国)观察绿色荧光分布情况。
1.2.7 序列统计分析与系统发育树构建将DpCPV 1基因组S8片段,放入NCBI上进行Blast序列比对(http://www.ncbi.nlm.nih.gov/BLAST/)。根据已经公开的CPV的S8片段进行比对,利用Mega4.0分析软件进行聚类分析,并采用软件 ClustalW和PHYLIP3.67的邻近法构建系统发育树,其核酸和氨基酸序列比对的bootstrapping数值分别为0.01和0.2。
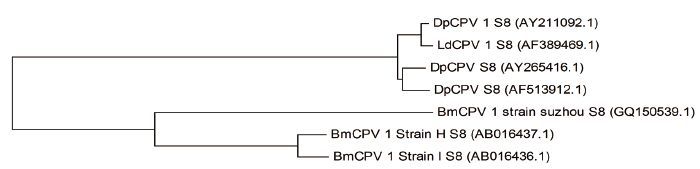
2 结果 2.1 DpCPV 1基因组S8片段和其编码非结构蛋白p44的系统发育分析通过系统发育树分析,DpCPV 1 基因组S8片段与舞毒蛾质型多角体病毒(LdCPV 1)基因组S8片段具有最高的序列同源性(99%),与另外两株DPCPV(AY211092.1和AF389469.1)序列同源性均为98%;分别与3株家蚕质型多角体病毒(BmCPV 1)Strain H、Strain I和Strain suzhou 对应片段的同源性为84%、83%和81%(图 1)。
|
| 图 1 DpCPV1 基因组S8 片段的核酸系统发育树 |
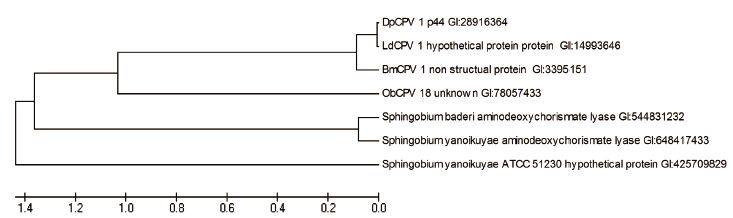
DpCPV 1 S8片段编码非结构蛋白p44的系统发育树分析显示:p44蛋白与LdCPV 1、BmCPV 1 strain H和冬尺蠖蛾质型多角体病毒(ObCPV 18)的相应非结构蛋白氨基酸序列同源性分别为99%、85%和 35%。另外,我们检测到了p44蛋白与3株鞘脂菌属(Sphingobium)细菌的氨基脱氧分枝酸裂解酶(aminodeoxychorismate lyase)有27%的氨基酸序列同源性(图 2)。
|
| 图 2 DpCPV 1 非结构蛋白p44 的系统发育树 |
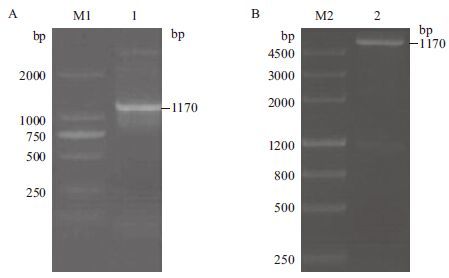
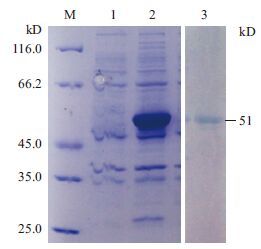
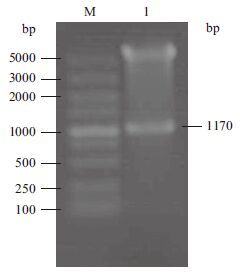
以pTS8F和pTS8R为正反向引物,以DpCPV 1基因组S8片段为模板进行RT-PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳检测,扩增片段大小约为1 170 bp(图 3-A)。将S8连接至pET28a载体上,构建表达质粒。用BamHⅠ和Hind III双酶切验证正确后(图 3-B),命名为pET28a-S8。经测序,将鉴定正确的克隆质粒pET28a-S8转化大肠杆菌BL21,加IPTG诱导后离心收集菌体,进行SDS-PAGE分析。结果(图 4)显示,检测到插入的S8片段的载体有相应蛋白的表达,蛋白大小约为51 kD。因插入的S8片段后面携带了一个His纯化标签(大小约7 kD),所以实际插入S8片段表达的蛋白大小为44 kD,与p44蛋白大小相符。
|
| M1 :DL2000 DNA Marker ;1 :S8 片段RFPCR 产物;M2 :Marker Ⅲ ;2 :pET28a-S8 的酶切产物 图 3 S8 原核表达载体的构建 |
|
| M :蛋白Marker ;1 :BL21-pET28a-S8 ;2 :经IPTG 诱导的BL21-pET28a-S8 ;3 :纯化后的目的蛋白 图 4 SDS-PAGE 检测p44 诱导表达结果 |
通过His纯化标签经Ni-NTA纯化树脂纯化包涵体的目的蛋白后,所得纯化蛋白免疫家兔,制备p44蛋白的多克隆抗体 anti-p44。
2.3 重组病毒载体构建将S8片段克隆至pFastBac-eGFP和pFastBac-Dual质粒上,构建载体。用XhoⅠ和KpnⅠ双酶切验证后,分别命名为pFast-S8和pFast-S8-eGFP(图 5)。分别将pFast-S8、pFast-S8-eGFP和pFastBacDual(空载对照)转座到DH10B感受态细胞,经培养后提取并鉴定正确的Bacmid DNA(图 6)。
|
| M :DNA Marker 5000 ;1 :pFast-S8 的双酶切 图 5 酶切验证pFast-S8 |

|
| M :DNA Marker10000 ;1 :Bac-S8 的PCR 结果 图 6 Bac-S8 的PCR 验证 |
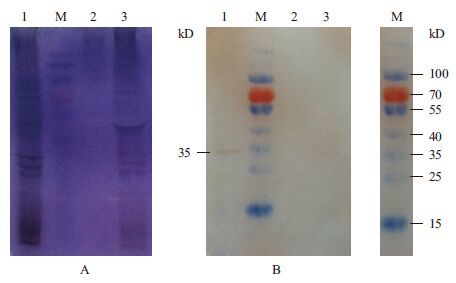
用构建的重组Bacmid-S8病毒转染Sf9 细胞,经SDS-PAGE检测蛋白的表达情况(图 7-A)。然后以anti-p44为一抗,HRP标记的羊抗兔血清抗体为二抗,经Western blot检测DpCPV 1 S8编码蛋白p44在昆虫细胞Sf9内表达情况。结果(图 7-B)显示,Bacmid-S8感染的Sf9细胞(第1泳道)在35 kD处有明显条带,而空白的Sf9细胞(第3泳道)和经Bacmid-S7感染的Sf9细胞(第2泳道)作为阴性对照,未检测出条带。第1泳道检测到的条带是p44蛋白的真核表达蛋白,大小为35 kD,但是比原核表达的p44蛋白小了9 kD。
|
| A :Sf9 细胞碎片的SDS-PAGE 检测;B :S8 抗体的Western blot 检测;1 :Bacmid-S8 感染Sf9 细胞收获P2 后的细胞碎片;M :蛋白Marker ;2 :Bacmid-S7 感染Sf9 细胞的细胞碎片;3 :Sf9 细胞 图 7 p44 蛋白的真核表达SDS-PAGE(A)及Western blot(B)检测 |
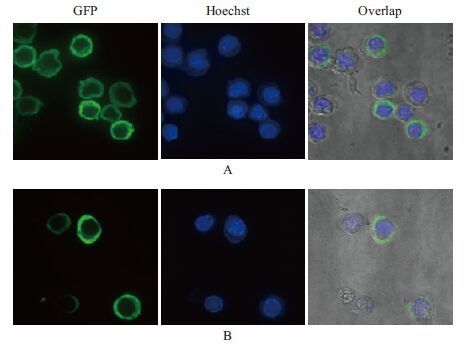
用P3代病毒感染昆虫细胞Sf9后24 h,用激光共聚焦显微镜观察蛋白的亚细胞定位情况。结果表明,昆虫细胞Sf9被杆状病毒感染后,细胞核明显增大,经荧光染料 Hoechst 33258染洗后,紫色部位为细胞核。融合了p44的eGFP的蛋白则主要聚集在细胞质中(图 8-A),而未融合p44的EGFP均匀地分布于整个细胞中(图 8-B),说明S8片段编码的非结构蛋白p44主要定位于细胞质中。
|
| A :融合p44 的eGFP 的Sf9 细胞;B :未融合p44 的eGFP 的Sf9 细胞 图 8 融合了EGFP 的p44 在昆虫细胞中的定位 |
本研究通过克隆 DpCPV 1基因组S8片段到原核表达载体BL21内,原核表达p44蛋白。经SDS-PAGE电泳检测到诱导表达的蛋白大小约51 kD,这是因为在构建表达S8片段的后面添加了一个His纯化标签,纯化标签的蛋白大小约7 kD,因此DpCPV 1基因组S8片段原核表达蛋白的大小约44 kD,与p44的蛋白大小相符。将DpCPV 1 S8片段原核表达蛋白免疫家兔,制备了p44的多克隆抗体。Western blot结果显示DpCPV 1 S8片段编码的非结构蛋白p44实际大小为44 kD,与推测的蛋白分子量大小结果一致。
采用Bac-to-Bac杆状病毒表达系统,将DpCPV 1基因组 S8片段单独插入以及S8片段与绿色荧光蛋白基因(egfp)以C端融合的方式插入苜蓿银纹夜蛾核多角体病毒(Autographa californica multiple nucleocapsid NPV,AcMNPV)基因组中,获得重组的杆状病毒质粒(Bac-S8和Bac-S8-eGFP),转染昆虫细胞Sf9后进行Western blot检测和蛋白的亚细胞定位的观察。Western blot检测结果显示,Bac-S8在昆虫细胞Sf9中获得高效表达,但表达的p44蛋白的大小为35 kD,比原核表达的p44蛋白(44 kD)略小。推测DpCPV 1 S8片段表达的蛋白p44在昆虫细胞内发生了切割修饰,这种蛋白切割现象此前也在DpCPV 1的其它片段表达的蛋白中发现过。如Jin等[15]将DpCPV 1感染甜菜夜蛾幼虫,取中肠样品经Western blot检测发现,DpCPV 1 S7片段编码的蛋白p50在感染的第3天表达的蛋白大小为50 kD,在感染的第5天发现该蛋白发生切割修饰,修饰后的蛋白大小为31 kD,上述数据证实了DpCPV S7片段在真核细胞内表达的蛋白发生了切割。因此,我们推测p44蛋白在真核细胞内发生了降解或者被昆虫细胞的某些酶切割或修饰。
用激光共聚焦显微镜观察Bac-S8-eGFP的融合蛋白的亚细胞定位发现,融合p44的绿色荧光蛋白(eGFP)主要聚集在细胞质中,没有融合eGFP的分布于整个细胞,说明 DpCPV 1的非结构蛋白p44定位于细胞质中。类似的情况也发生在DpCPV 1 S7片段编码的结构蛋白p50,Jin等[15]研究发现p50-eGFP同样定位于细胞的细胞质中。而DpCPV 1的S9片段编码的非结构蛋白NS5,免疫荧光实验发现NS5蛋白定位于细胞的细胞质膜上并且跨膜结构域位于蛋白质N端的57-71 aa[16]。相关蛋白的定位研究发现,为研究病毒的生命周期具有重要作用。
4 结论本研究利用Bac-to-Bac系统首次对DpCPV 1 S8片段进行了真核表达和昆虫细胞的亚细胞定位,发现S8片段能够定位到细胞的细胞质。
| [1] | Shapriro A, Green T, Rao S, et al. Mrophological and molecular characterization of a cypvirus from the mosquito Uranotaenia sapphirina(Diptera:Culicidae)[J]. J Virol, 2005, 79(15):9430-9438. |
| [2] | King AMQ, Adams MJ, Lefkowitz EJ, Carstens EB. Virus taxonomy:classification and nomenclature of viruses. Ninth report of the International Committee on Taxonomy of Viruses[M]. Elsevier Academic Press, 2012:537-536. |
| [3] | 广东省林业科学研究所. 马尾松毛虫多角体病毒研究初报[J]. 林业科技通讯, 1974, 10:13. |
| [4] | 贺倩, 刘小侠, 张青文. 昆虫质型多角体病毒的研究进展[J]. 昆虫知识, 2010, 47(5):834-840. |
| [5] | Yu XK, Jin L, Zhou ZH. 3.88 Å structure of cytoplasmic polyhedrosis virus by cryoelectron microscopy[J]. Nature, 2008, 453:415-419. |
| [6] | Cheng L, Sun JC, Zhang K, et al. Atomic model of a cypovirus built from cryo-EM structure provides insight into the mechanism of mRNA capping[J]. PNAS, 2011, 108:1373-1378. |
| [7] | Yang CW, Gang J, Liu HR, et al. Cryo-EM structure of a transcribing cypovirus[J]. PNAS, 2012, 109(16):6118-6123. |
| [8] | 文力, 张珈敏. 马尾松毛虫质型多角体病毒NS5蛋白基因的cDNA克隆及序列分析[J]. 中国病毒学, 2003(1):49-53. |
| [9] | 张万菊, 赵淑玲, 张小霞, 等. 马尾松毛虫质多角体病毒NS5蛋白的表达和功能初步分析[J]. 中国病毒学(英文版), 2006(4):401-404. |
| [10] | 汪洋, 张珈敏, 李杨, 等. 马尾松毛虫CPV基因组第7片段的cDNA克隆及序列分析[J]. 武汉大学学报:理学版, 2004(2):216-222. |
| [11] | 段兵, 赵淑玲, 张海元, 等. 文山松毛虫质型多角体病毒S8片段cDNA克隆与原核表达[J]. 中国病毒学, 2004(6):627-631. |
| [12] | 胡建芳, 张珈敏, 杨娟, 等. 单引物法扩增马尾松毛虫CPV基因组第8片段及其序列分析[J]. 中国病毒学, 2003, 18(1):39-43. |
| [13] | Zhao SL, Liang CY, Zhang WJ, et al. Characterization of the RNA-binding domain in the Dendrolimus punctatus cytoplasmic polyhedrosis virus nonstructural protein p44[J]. Virus Research, 2005, 114(1):80-88. |
| [14] | Paul RL, Susan JC, Owen EC, et al. Cloning of noncultivatable human rotavirus by single primer amplification[J]. Journal of Virology, 1992, 66(3):1817-1822. |
| [15] | Jin L, Dai CW, Qin TC, et al. Molecular characterization of protein p50 of Dendrolimus punctatus cytoplasmic polyhedrosis virus[J]. Journal of Basic Microbiology, 2013, 53(1):37-44. |
| [16] | Chen WG, Zhang, JM, Dong CJ, et al. Identification of transmemb-rane domain of a membrane associated protein NS5 of Dendrolimus punctatus cytoplasmic polyhedrosis virus[J]. J Biochem Mol Biol, 2006, 39:412-417. |