分子伴侣蛋白是由多个亚基环腔折叠形成的一种蛋白质,是细胞必不可少的成分,能协助新生的多肽链折叠并组装成稳定的有生物活性的结构[1],蛋白质跨膜转运,以及降解错误折叠和聚集蛋白的复性[2, 3],但自身并不发生任何变化[4]。分子伴侣蛋白一般具有特异性、功能赘余性及高度保守性等特点,参与肌动蛋白、微管蛋白的正确折叠与组装,促进细胞骨架的形成[5, 6]。CCTδ属于类分子伴侣超家族,可行使热休克蛋白的功能,在进化上高度保守,广泛存在于真核生物中。热休克蛋白是具有重要生理功能的蛋白质家族,在维持机体蛋白正常结构与功能方面起着重要作用[7]。
家蝇(Musca domestica)是一种世界性分布的卫生昆虫,其幼虫到成虫生活环境恶劣,但自身却很少染病。研究显示,家蝇虽不具有高等生物所具有的获得性免疫系统,却能对病原生物感染做出快速有效的免疫应答,这与其强大的先天性免疫系统密切相关。本课题组前期已经对家蝇的伴侣蛋白TCPⅠ基因进行了序列分析并建立了原核表达体系[8, 9]。本研究克隆家蝇的另一个伴侣蛋白CCTδ基因,并初步探讨其时空表达模式,旨在为进一步研究该基因的功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料家蝇由贵州医科大学病原生物学实验室饲养,饲养温度28℃,相对湿度65%,光照周期10 L∶14 D,3龄幼虫均重26.5 mg。
1.1.2 主要试剂总RNA提取试剂盒(RNAiso PLUS)、逆转录试剂盒、DNA标志物(DL2000 DNA Marker)、琼脂糖等购置于TaKaRa公司;其余试剂购于Invitrogen上海生工生物公司。
引物合成:基因扩增引物合成由Invitrogen上海生物技术有限公司完成。
1.2 方法 1.2.1 家蝇CCTδ基因的识别及序列测定对测定得到的家蝇3 龄幼虫EST序列进行Blastx 分析,从中筛选获得编码家蝇CCTδ基因的文库质粒,命名为家蝇CCTδ。
1.2.2 CCTδ基因的生物信息学分析 1.2.2.1 理化性质分析用DNASTAR5.0 软件分析cDNA序列和开放阅读框;利用瑞士生物信息学研究所的蛋白分析专家系统(Expert Protein Analysis System,ExPASy)提供的生物信息学工具Protparam,分析预测蛋白质的氨基酸残基性质、分子量及理论等电点等;ProtScale 分析蛋白质的疏水性质。采用Signal P分析信号肽序列。利用丹麦科技大学(DTU)的CBS服务器上的TMHMM Server v. 2.0程序进行蛋白序列跨膜区分析。
1.2.2.2 结构及功能预测运用PBIL LYON-GERLAND信息库对蛋白质序列进行二级结构预测,主要用Hopfield神经网络(HNN)预测。
1.2.2.3 CCTδ基因系统进化分析采用邻接法构建了系统进化树。该树比对来自BLAST分析得到不同物种的CCT的氨基酸序列,并计算了它们之间序列的相似性,利用MEGA6.0软件对这些CCT分子进行了分子系统学分析,在构建系统发生树的基础上研究了CCTδ的分类归属及其与其它昆虫CCT基因之间的进化关系。
1.2.3 CCTδ基因的扩增 根据已获得的CCTδ编码序列,利用DNA Club和Primer5.0设计引物。上游引物:5'-ATGGCACCGAAAGCAGGAAACGTT-3',下游引物:5'-TTAAGAAATAGTATTGACAATATCGTCG-3'。以筛选到的家蝇3龄幼虫cDNA文库中CCTδ基因的质粒为模板,PCR扩增程序为:94℃预变性5 min;94℃ 30 s,60℃ 1 min,72℃ 1 min,共30个循环;最后72℃延伸10 min。PCR产物1%琼脂糖凝胶电泳鉴定。
1.2.4 实时荧光定量PCR分析CCTδ基因表达模式提取家蝇不同发育时期(卵,1、2、3龄幼虫,蛹,雄成虫以及雌成虫),以及不同组织(3龄幼虫体壁、气管、唾液腺、脂肪体、马氏管及中肠)的总RNA,逆转录以获得总cDNA,根据扩增得到的CCTδ基因的cDNA序列在其保守序列区设计特异引物,上游引物序列为5'-CCTCGGTTGTTGTTATTGC-3'。下游引物序列为5'-AGATGGCTGTGGGATGG-3'。内参根据家蝇GAPDH序列设计,上游引物为5'-CATCATCTCCGCTCCATC-3'。下游引物为5'-AAGCCATACCAGTGAGTTTACC-3'。实时荧光定量PCR按照RealMasterMIX(SYBR Green)试剂盒说明书进行操作,同时设置无模板阴性对照,每个反应设3个重复。采取两步PCR法:95℃预变性10 s;95℃变性10 s,58℃退火1 min,40个循环。反应在ABI 7500 fast定量PCR仪上进行,数据采用2-△△Ct方法分析。
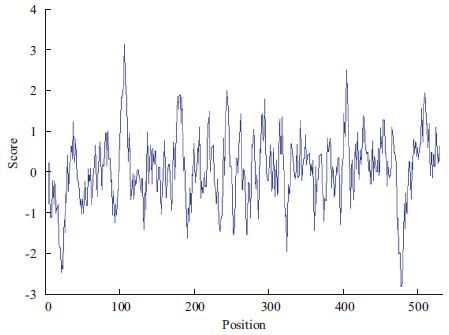
2 结果 2.1 CCTδ基因编码蛋白的理化性质CCTδ基因编码的蛋白与家蝇TCP-1蛋白的相似性为99%,从比对的高同源性判断该基因是家蝇的CCTδ蛋白。ORF全长1 602 bp,编码533个氨基酸(图 1),预测分子量为57.16 kD,理论等电点(pI 值)7.50;Signal P 4.1预测该蛋白N端无信号肽,属于非分泌蛋白。蛋白序列跨膜区分析显示无明显跨膜区,不可能是膜上的受体或定位于膜上。根据氨基酸分值越低亲水性越强和分值越高疏水性越强的规律可知,该基因编码的蛋白多肽链第478位具有最低的分值-2.800(最强的亲水性),第106位具有最高的分值3.100(最强的疏水性),整个多肽链表现为亲水性(图 2)。该蛋白的533个氨基酸中强碱性氨基酸(K、R)有64个,强酸性氨基酸(D、E)有63个,疏水氨基酸(A、I、L、F、W、V)有218个,不带电荷的极性氨基酸有(N、C、Q、S、T、Y)123个。属于亲水性的碱性蛋白。

|
| 图 1 CCTδ 蛋白开放阅读框cDNA 序列及对应编码的氨基酸序列 |
|
| 图 2 CCTδ 基因编码蛋白疏水性分析 |
二级结构主要以α-螺旋和不规则卷曲为主(图 3),α-螺旋占53.85%,不规则卷曲占31.14%,延伸链占15.01%。

|
| 图 3 CCTδ 基因二级结构分析 |
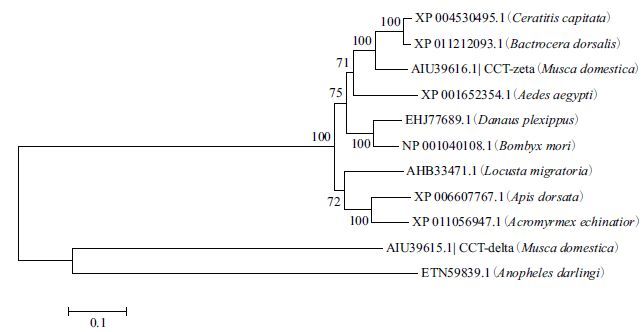
利用GenBank 数据库已有的昆虫CCT蛋白的氨基酸序列:XP004530495(地中海实蝇,Ceratitis ca-pitata)、XP011212093.1(桔小实蝇,Bactrocera dor-salis)、ETN59839.1(中华按蚊,Anopheles darlingi)、XP001652354.1(埃及伊蚊,Aedes aegypti)、AHB3-3471.1(东亚飞蝗,Locusta migratoria)、XP006607-767.1(大蜜蜂,Apis dorsata)、XP011056947.1(巴拿巴切叶蚁,Acromyrmex echinatior)、EHJ77689.1(大红斑蝶,Danaus plexippus)、NP001040108.1(家蚕,Bombyx mori),采用NJ法构建分子系统进化树。结果(图 4)显示,昆虫CCTδ在进化上具有较好的保守性,相比其他物种而言,家蝇CCTδ在进化上与同属于双翅目的中华按蚊的遗传距离较近。
|
| 图 4 CCTδ 蛋白进化树分析 |
CCTδ基因经PCR扩增后,获得了1 602 bp左右的特异条带(图 5)。

|
| M :DNA Marker DL2000 ;1 :CCTδPCR 扩增产物 图 5 家蝇CCTδ 基因cDNA 片段的扩增 |
在家蝇的卵、1龄幼虫、2龄幼虫、3龄幼虫、蛹和雌雄蝇各生长阶段中,CCTδ基因均有不同程度表达,但在蛹期及雌虫中的表达量高,在2龄幼虫及雄虫中的表达量最低(图 6)。

|
| 图 6 CCTδ 基因在不同时期的相对表达分析 |
家蝇CCTδ基因在不同组织中亦有表达,以气管表达量最高,唾液腺次之,在脂肪体和体壁中表达量均较低(图 7)。

|
| 图 7 CCTδ 基因在不同组织中的相对表达分析 |
CCT 蛋白属于Hsp60家族II类亚族,是由8个亚基组成的聚合体,存在于古细菌[10]和真核细胞质[11, 12, 13]。它能确保一些参与细胞生存及生长的蛋白正确折叠,包括微管蛋白、肌动蛋白[14]、细胞周期调节蛋白、POLO样激酶1、细胞周期素E和VHL肿瘤抑制蛋白等。相关研究表明,CCT除了在细胞正常生理活动发挥作用外,还与一些疾病的病理过程有关,如神经系统疾病、分子病、肿瘤及免疫系统疾病等,具有较好的应用前景[15]。然而,关于家蝇CCT蛋白的研究很少。
本研究克隆了CCTδ基因完整编码序列,对其进行生物信息学分析,并初步探索其时空表达模式。CCTδ基因编码的蛋白与家蝇TCP-1蛋白的相似性为99%,从比对的高同源性判断该基因是家蝇的CCTδ蛋白。通过分子进化分析该基因与同属于双翅目的中华按蚊的遗传距离较近。实时荧光定量PCR分析CCTδ基因在不同时期均有表达,以蛹期表达量最高,提示CCTδ基因参与了家蝇的个体发育。相关研究表明,鸡的CCT基因在性未成熟及成熟阶段均在卵巢组织中有表达[16, 17, 18],分子伴侣蛋白可激活信号通路,进而调控细胞周期,促进细胞由G1期快速过渡,最终促进细胞增殖[19]。CCTδ基因在雌成虫期表达量高,提示该基因在卵泡的发育过程中起重要作用。3龄幼虫的不同组织中以气管表达量最高,唾液腺次之,这可能是因为气管的黏膜有许多排列整齐的微绒毛,分子伴侣蛋白CCT是肌动蛋白及微管蛋白生物合成的特异性底物,也是上皮组织微绒毛所必需[20]。唾液腺可分泌唾液及消化酶消化食物,大量消化酶的合成需要大量CCTδ协助消化酶前体正确折叠和运输。因此,推测CCTδ基因在家蝇发育过程中发挥重要作用。
4 结论本研究以CCTδ基因的cDNA文库质粒为模板,通过PCR的方法进行扩增,得到了特异性家蝇CCTδ基因片段。运用生物信息学方法分析了该基因及其编码蛋白的结构与功能,构建系统进化树。采用实时荧光定量PCR分析了CCTδ基因在家蝇不同发育阶段和组织部位的表达情况。
| [1] | Min W, Angileri F, Luo H, Lauria A. A human CCT5 gene mutation causing distal neuropathy impairs hexadecamer assembly in an archaeal model[J]. Scientific Reports, 2014, 4:6688. |
| [2] | Kim YE, Hipp MS, Bracher A, et al. Molecular chaperone functions in protein folding and proteostasis[J]. Annu Rev Biochem, 2013, 82:323-355. |
| [3] | Nie ZQ, Wu YG, Meng JZ. The function and application of molecular chaperonin[J]. Chinese Bull Life Sci, 2006, 18(1):84-89. |
| [4] | 吴成龙, 张文兵, 麦康森, 等. 皱纹盘鲍伴侣蛋白CCTζ的分子克隆及其在不同锌含量日粮处理下的表达分析[J]. 水生生物学报, 2012, 36(3):393-402. |
| [5] | Roobol A, Roobol J, Carden MJ, et al. The chaperonin CCT interacts with and mediates the correct folding and activity of three subunits of translation factor elF3:b, i and h[J]. Biochem J, 2014, 458(2):213-224. |
| [6] | 段芳蕾, 孙兴旺, 曹灵. 真核细胞伴侣素CCT 及其与细胞骨架的关系[J]. 中国细胞生物学学报, 2011, 33:822-825. |
| [7] | 王芳, 陈炯, 史雨红, 等. 梅氏新贝尼登虫热休克蛋白60 基因的克隆、序列分析及应激表达分析[J]. 动物学研究, 2012, 33(6):603-608. |
| [8] | 赵学军, 国果, 修江帆, 等. 家蝇伴侣蛋白CCTη基因序列分析与表达模式[J]. 中国公共卫生, 2015, 31(8):1043-1046. |
| [9] | 赵学军, 国果, 吴沁怡, 等. 家蝇伴侣蛋白TCP-1基因的序列分析、克隆及诱导表达[J]. 生物技术通报, 2014(10):151-155. |
| [10] | Chen HY, Zhang CX, Ma XK, et al. Heat shock proteins of the hyperthermophilic archaea[J]. Chinese Journal of Biotechnology, 2008, 24(12):2011-2021. |
| [11] | Feder ME, Hofmann GE. Heat-shock proteins, molecular chaperones, and the stress response:evolutionary and ecological physiology[J]. Annual Review of Physiology, 1999, 61:243-282. |
| [12] | Wang W, Vinocur B, Shoseyov O, et al. Role of plant heatshock proteins and molecular chaperones in the abiotic stress response[J]. Trends in Plant Science, 2004, 9(5):244-252. |
| [13] | Hartl FU. Molecular chaperones in cellular protein folding[J]. Nature, 1996, 381(13):571-579. |
| [14] | McCallum CD, Do H, Johns AE, et, al. The Interaction of the Chaperonin Tailless Complex Polypeptide 1(TCP1)Ring Complex(TRiC)with ribosome-bound nascent chains examined using photo-cross-linking[J]. The Journal of Cell Biology, 2000, 149(3):591-601. |
| [15] | Mansilla MJ, Montalban X, Espejo C. Heat shock protein70:Roles in multiple sclerosis[J]. Molecular Medicine, 2012, 18:1018-1028. |
| [16] | Wei Q, Zhu G, Cui X, et al. Expression of CCT6A mRNA in chicken granulosa cells is regulated by progesterone[J]. Gen Comp Endocrinol, 2013, 189:15-23. |
| [17] | 李楠, 王丽丽, 曹嫦妤, 等. 鸡内质网分子伴侣Calnexin基因的生物信息学与组织表达谱分析[J]. 中国兽医学报, 2014, 34(8):1304-1313. |
| [18] | 王丽丽, 李楠, 曹嫦妤, 等. 鸡钙离子结合分子伴侣Calreticulin 的结构与功能预测及组织表达特性[J]. 中国农业科学, 2014, 47(19):3875-3882. |
| [19] | 胡莹莹, 韩艳艳, 赵佳维, 等. 上调分子伴侣mortalin经由MAPK-ERK 信号转导通路促进卵巢癌细胞增殖[J]. 解剖学报, 2014, 45(3):338-343. |
| [20] | Saegusa K, Sato M, Sato K, et al. C. elegans chaperonin CCT/TRiC is required for actin and tubulin biogenesis and microvillus formation in intestinal epithelial cells[J]. Mol Biol Cell, 2014, 20, E13-09-0530. |




