2. 新疆生产建设兵团塔里木畜牧科技重点实验室,阿拉尔 843300;
3. 中国农业大学动物科技学院,北京100193
2. Key Laboratory of Tarim Animal Husbandry Science & Technology, Xinjiang Production & Construction Group,Alar 843300;
3. College of Animal Science and Technology, China Agricultural University, Beijing 100193
鹿茸是哺乳动物唯一能够割后再生的器官,其割后再生与快速生长类似肿瘤的特性,吸引了国内外众多科学家的兴趣。鹿茸间充质干细胞位于茸皮的真皮层下,是一类新的干细胞。在鹿茸不同生长期,间充质细胞层的厚度不断变化,从生长早期到后期即骨化期,逐渐变薄。一系列研究[1, 2, 3, 4, 5]发现鹿茸的间充质细胞层(MSCs)来源于位于鹿额外脊的骨膜干细胞,由间充质细胞分化成集落生成单位成纤维细胞,然后分化成软骨细胞进而形成骨细胞,是维持鹿茸的生长发育的源泉之一。在鹿茸整个生长过程中,不断发生着这样的变化,来实现鹿茸的生长[6, 7]。但该理论的分子生物学证据国内外很少有相关报道。
原癌基因c-myc对干细胞的增殖分化起着关键的作用。对塔里木马鹿茸c-myc基因的研究发现,不同生长期鹿茸不同组织中的c-myc基因有明显时空表达变化[8],说明c-myc基因与鹿茸的组织分化和细胞生长密切关联。但c-myc在MSCs软骨分化过程行使何种功能,其表达是分化的结果还是原因均无相关报道。
转化生长因子(TGF-β1)是MSCs软骨分化不可缺少的作用因子[9, 10]。Kocamaz等[11]利用10 ng/μL TGF-β1成功诱导了20日龄鸡的骨髓间充质干细胞(hMSCs)向软骨分化。Christopher等[12]用相同剂量的TGF-β1刺激山羊MSCs,3周后RT-PCR检测II型胶原蛋白(COL2)和聚集蛋白聚糖的表达显著高于非诱导组。Mueller等[13]在人hMSCs软骨分化的研究中发现,10 ng/μL TGF-β1及其不同配体不但能诱导软骨形成,同时还能促使软骨肥大化。
本研究利用10 ng/mL TGF-β1诱导塔里木马鹿茸MSCs软骨分化,确定体外诱导的最佳条件;并在此过程中研究c-myc基因的表达变化,一方面探讨马鹿茸MSCs体外软骨的发育模式;另一方面研究c-myc对马鹿茸软骨分化机制的影响作用,以期为茸MSCs软骨分化提供分子依据。
1 材料与方法 1.1 材料 1.1.1 实验材料生长60 d的塔里木马鹿茸体外培养第2代MSCs和软骨细胞(P2),由塔里木畜牧科技重点实验室胚胎工程实验室提供,HeLa细胞由华中农业大学武军元老师提供。
1.1.2 试剂和仪器胎牛血清FBS、细胞培养液DMEM、Ⅱ型胶原酶、胰蛋白酶、TGF-β1均为Sigma公司产品,TRIZOL(Invitrogen);反转录试剂盒(ThermoFisher),定量PCR试剂盒(Roche),DMSO;CO2加湿培养箱(MCO-15A),eppendorplex荧光定量PCR仪,倒置相差显微镜(Nikon);低温高速离心机(Jouan);生物显微镜(舜宇);血细胞计数板;无菌操作台等。阿利新蓝染色试剂盒,羊Col II一抗和免疫组化试剂盒(北京博奥)。
1.2 方法 1.2.1 诱导培养及诱导结果鉴定选择5个6孔板,每个孔中加入1 mL 10% FBS-DMEM,约含细胞1×105个。设置其中15孔为对照组,另15孔为诱导组。诱导组每孔于接种P2细胞后第3天,细胞生长至70%融合时,换用软骨诱导培养基,即含10 ng/mL TGF-β1的10% FBS-DMEM及1×10-7mol/L地塞米松。每2 d半量换液。换液时在倒置显微镜下观察拍照记录细胞生长情况。在培养至第7、14、21、28和35天时,每个时间点分别收集3个孔的细胞,每孔细胞数约为4.5×105个,在倒置显微镜下观察细胞生长情况,用II型胶原蛋白免疫组化和阿尔新蓝染色鉴定软骨诱导结果。
1.2.2 c-myc基因的定量检测对每个时间点收集的细胞,用Invitrogen公司的TRIZOL Reagent® RNA提取试剂盒方法提取RNA,使用ThermoFisher公司的反转录试剂盒合成cDNA,1∶10稀释后待用。根据GenBank数据库提供的鹿c-myc基因序列和内参基因牛GAPDH基因序列,用Primer 5.0软件设计PCR的引物(表 1)。qPCR反应条件为:95℃ 5 min;95℃ 10 s,60℃ 30 s,40个循环。熔解曲线程序:55-95℃;半定量PCR反应条件:95℃,5 min;95℃ 10 s,65℃ 30 s,72℃ 2 min,28个循环。
为比较c-myc软骨分化过程的基因表达,提取培养至第7天的P2代软骨细胞和HeLa细胞的RNA,反转录后备用。
1.2.3 统计学处理基因表达倍增值用2-△△Ct法计算,利用SPSS17.0 软件包对对照组和诱导组的基因表达差异进行显著性检验,P <0.05有统计学意义。
2 结果 2.1 诱导结果倒置显微镜下观察:诱导组培养至第9天后开始出现细胞形态变化。一些细胞的形态开始从梭形变成圆形、多角形,随培养时间的延长,更多的细胞形态发生类似变化。原本菊花状的细胞分布逐渐向铺路石状变化。至14 d可观察到软骨陷窝,培养至21 d软骨细胞基质明显,同时发现凋亡细胞。空白组培养至28 d细胞出现凋亡,细胞内发现空泡。35 d两组细胞凋亡明显,凋亡细胞体积缩小,形态近似圆形,凸起,中心呈空泡状,细胞折光性变差,间隙变大(图 1)。
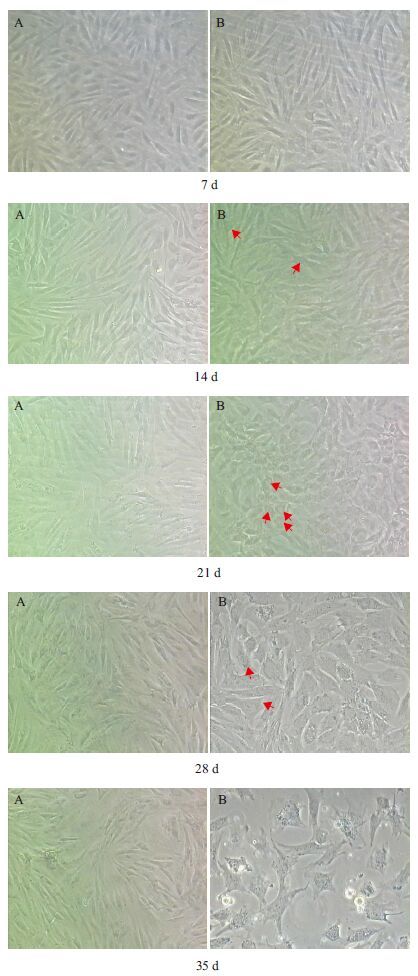
|
| A :对照组;B :诱导组。黑色箭头指示的是圆形软骨细胞;红色箭头为细胞基质 图 1 诱导组MSCs 软骨分化不同时间点细胞形态变化 (100×) |
阿利新蓝染色发现,诱导至第14天细胞基质中出现大量蓝色阳性染色,即聚集蛋白聚糖的软骨细胞表面标志,随培养时间延长着色面积加大(图 2)。免疫组化实验发现诱导至21 d,细胞基质出现棕色Col II阳性反应物,随培养时间颜色加深集中分布在细胞内及其周围基质中(图 3)。对照组细胞无相应反应变化。
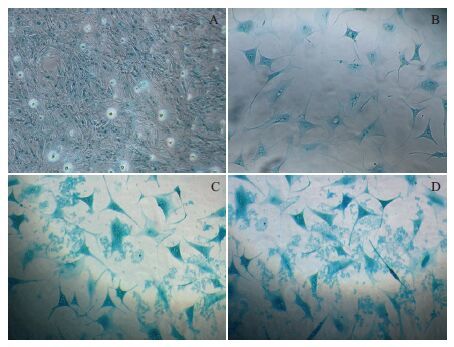
|
| A-D :分别表示诱导14、21、28 和35 d 图 2 诱导组MSCs 软骨分化阿利新蓝染色结果(100×) |

|
| A-D :分别表示诱导14、21、28 和35 d 图 3 诱导组MSCs 软骨分化免疫组化检测结果(100×) |
通过qPCR定量检测诱导不同时间点c-myc基因的表达结果(图 4)发现,第14、21和28天,诱导组c-myc基因的相对表达量(倍增值)分别为0.323、0.224和0.319,而对照组的分别为0.574、0.72和0.457,两组间差异显著(P<0.05);但35 d两组间没有显著差异(P>0.05)。第14-35天4个时间点诱导组的基因表达量与P2代软骨细胞中的表达量(倍增值为0.222)比较没有显著差异(P>0.05),但与第7天对照组的表达量相比均有显著差异(P<0.05)。对照组中,第7、14和21天3个时间点的基因表达量无显著差异(P>0.05),但显著高于第28和35天的表达量(P<0.05)。

|
| 图 4 qPCR 检测MSCs 软骨分化不同时间点c-myc 表达量 |
定量PCR未检测到HeLa细胞的c-myc的表达量,尽管通过半定量PCR结果,HeLa细胞的内参基因与目的基因均有表达,且表达量相似(图 5)。

|
| M :DNA Marker ;1,3,5,7,9 :诱导组第7、14、21、28 和35 天;2,4,6,8,10 :空白组第7、14、21、28 和35 天;11 :HeLa 细胞cDNA 图 5 半定量PCR 检测MSCs 软骨分化不同时间点c-myc表达变化 |
Wang等[13]通过在人MSCs软骨分化的培养基质中添加血清和TGF-β1诱导剂对培养细胞凋亡的影响实验,发现培养基中加入血清组在培养的第7天细胞数与细胞活力均明显下降,用TUNEL法染色检测培养21 d的细胞,确定加血清培养组细胞凋亡比对照组显著。而加10 ng/mL TGF-β1诱导剂组则未发现TUNEL阳性染色细胞,认为血清培养可诱导细胞凋亡而TGF-β1可阻止分化过程的细胞凋亡。Walenda等[14]2013年研究了不同浓度TGF-β1对hMSCs软骨分化过程细胞增殖分化的影响,认为1 ng/mL TGF-β1不影响细胞早衰,但因为TGF-β1能刺激细胞快速分裂而使细胞提早进入复制抑制。本实验结果发现诱导组细胞衰亡(第21天)早于空白组(第28天),这与Walenda的实验结果相似。但体外培养细胞早衰与培养时间有一定关系[15],因此,关于马鹿茸MSCs的体外扩增与分化生长特性还需进一步研究。
鹿茸MSCs是鹿茸软骨及骨细胞的细胞库,对比不同生长期鹿茸间充质细胞层发现,从30-60 d,即生长高峰,该组织层的厚度逐渐增加,而生长高峰过后,其厚度逐渐变薄。这一形态的变化,可证实茸MSCs不断向软骨分化以维持鹿茸的快速生长。C-myc基因上调表达时细胞处于增殖状态,但细胞处于分化状态时c-myc基因则下调表达[16]。
现已证实,TGF-β1蛋白主要通过影响其信号通路下游基因SMAD4/SMAD3蛋白复合物来诱导干细胞软骨分化。TGF-β1蛋白促使该复合物表达加强,刺激细胞基质分泌,诱导软骨分化调控因子SRY-related gene 9(sox9)的转录,以加强软骨的表面标志collagen II蛋白的表达[17, 18];另一方面TGF-β1蛋白能够阻止该复合物与Wnt信号通路中LEF/TCF作用元件结合,抑制c-myc基因的激活[17, 19],表现为分化过程c-myc基因的表达下调。本实验结果显示,TGF-β1诱导P2鹿茸MSCs的软骨分化过程中,软骨分化的早期,空白组即非TGF-β1处理的间充质细胞c-myc基因的表达量显著高于诱导组基因的表达量。说明c-myc下调表达时鹿茸干细胞处于分化阶段。
但c-myc基因下调表达也诱导细胞凋亡。该机制可通过抑癌基因P53完成。P53绑定在c-myc基因启动子区,通过其组氨酸H4乙酰化阻止c-myc基因启动,诱导细胞生长停滞进而凋亡。在一些细胞中c-myc介导的细胞凋亡不需要P53参与也能发生[20]。该理论解释了鹿茸MSCs诱导组与空白组28 d后c-myc表达下调与细胞凋亡的因果关系。
C-myc 作为大多数恶性肿瘤的标志性基因,在很多肿瘤组织中上调表达。本实验用HeLa细胞作为实验材料之一,目的是比较鹿茸MSCs与肿瘤细胞在c-myc基因表达量上的差异。当cDNA以1∶10稀释后,定量PCR结果未检测到HeLa细胞c-myc基因的表达值,该结果表明鹿茸MSCs的基因表达量高于HeLa细胞。但原癌基因c-myc在HeLa细胞中是否像其它肿瘤细胞上调表达无相关文献报道。
Liu等[21]在鼠MSCs软骨分化过程,超表达Wnt11基因,结果发现MSCs G0/G1细胞周期停滞;聚集蛋白聚糖与Collagen II的表达量显著高于对照组,同时sox9也大量表达。因此认为除了TGF-β信号通路,非经典的Wnt信号也参与了MSCs的软骨分化进程。
本实验以TGF-β1为诱导剂诱导鹿茸MSCs软骨分化的过程,c-myc基因呈下调表达。这与体内软骨分化的结果是一致的[22, 23, 24]。但c-myc基因对鹿茸生长再生的调控作用机制还需要对其信号通路做进一步的研究。
4 结论在TGF-β1刺激下,塔里木马鹿茸MSCs可以分化成软骨;原癌基因c-myc下调表达诱导鹿茸MSCs分化;诱导分化软骨细胞与MSCs进入凋亡状态。
| [1] | Li CY, Colin GM, Shirley K, et al. Clark. Identification of key tissue type for antler regeneration through pedicle periosteum deletion[J]. Cell Tissue Res, 2007, 328:65-75. |
| [2] | Li CY, James MS, Dawn EC. Histological examination of antler regeneration in red deer(Cervus elaphus)[J]. The Anatomical Record Part A, 2005, 282A:163-174. |
| [3] | Debra KB, Li CY, Geoff A, et al. Red deer cloned from antler stem cells and their differentiated progeny[J]. Biology of Reproduction, 2007, 77:384-394. |
| [4] | Li CY, James MS. Deer antlerogenic periosteum:a piece of postnatally retained embryonic tissue?[J]. Anat Embryol, 2001, 204:375-388. |
| [5] | Gao XH, Yang FH, Zhao HP, et al. Antler transformation is advanced by inversion of antlerogenic periosteum implants in sika deer(Cervus nippon)[J]. The Anatomical Record, 2010, 293:1787-1796. |
| [6] | Andrea M, Istvan G, Ena K. Identification of differentially expressed genes in the developing antler of red deer Cereus alphas[J]. Mol Genet Genomics, 2007(277):237-248. |
| [7] | Kierdorf U, Kierdorf H. Deer antlers-a model of mammalian appendage regeneration:An extensive review[J]. Gerontology, 2011, 57:53-65. |
| [8] | 韩春梅, 高庆华, 李世军, 等. 原癌基因c-myc在塔里木马鹿茸不同生长期的表达[J]. 中国兽医学报, 2012, 32(10):1536-1542. |
| [9] | Goessler UR, Bugert P, Bieback K, et al. In vitro analysis of the expression of TGF-β- superfamily members during chondrogenic differentiation of mesenchymal stem cells and chondrocytes during differentiation in cell culture[J]. Cell Mol Biol Lett, 2005, 10(2):345-362. |
| [10] | Martin F, Lehmann M, Schläger P, et al. Differentiation capacity of chondrocytes in microtissues depends on TGF-β subtype[J]. J Biochip Tissue Chip, 2012, S2:002. doi:10. 4172/2153-0777. S2-002. |
| [11] | Erdogan K, Duygu G, Ayse C. Implication of C-type natriuretic peptide-3 signaling in glycosaminoglycan synthesis and chondrocyte hypertrophy during TGF-β1 induced chondrogenic differentiation of chicken bone marrow-derived mesenchymal stem cells[J]. J Mol Hist, 2012, 43:497-508. |
| [12] | Christopher GW, Tae KK, Anya T, et al. In vitro chondrogenesis of bone marrow-derived mesenchymal stem cells in a photopolymeriz-ing hydrogel[J]. Tissue Engineering, 2003, 9(4):679-688. |
| [13] | Wang CY, Chen LL, Kuo PY, et al. Apoptosis in chondrogenesis of human mesenchymal stem cells:Effect of serum and medium supplements[J]. Apoptosis, 2010, 15:439-449. |
| [14] | Walenda G, Abnaof K, Joussen S, et al. TGF-beta1 Does Not induce senescence of multipotent mesenchymal stromal cells and has similar effects in early and late passages[J]. PLoS One, 2013, 8(10):e77656. doi:10. 1371/journal. pone. 0077656. |
| [15] | Fu RG, Wu JJ, Xue RL, et al. Premature senescence and cellular phenotype transformation of mesangial cells induced by TGF-B1[J]. Renal Failure, 2013, 35(8):1142-1145. |
| [16] | Laura S, Gerard IE. The ups and down of myc biology[J]. Curr Opin Genet, 2010, 20(1):91-99. |
| [17] | Michael BM, Maria F, Johannes Z, et al. Hypertrophy in mesenchy-mal stem cell chondrogenesis:Effect of TGF-β isoforms and chondrogenic conditioning[J]. Cells Tissues Organs, 2010, 192:158-166. |
| [18] | Furumatsu T, Tsuda M, Taniquchi N, et al. The Smad3 induces chondrogenesis through the activation of SOX9 via CREB-binding Protein/p300 recruitment[J]. Journal of Biological Chemistry, 2010, 280:8343-8350. |
| [21] | Liu S, Zhang E, Yang M, et al. Overexpression of Wnt11 promotes chondrogenic differentiation of bone marrow-derived mesenchymal stem cells in synergism with TGF-β[J]. Mol Cell Biochem, 2014, 390:123-131. |
| [19] | Lim SK, Hoffmann FM. Smad4 cooperates with lymphoid enhancer-binding factor 1/T cell-specific factor to increase c-myc expression in the absence of TGF-β signaling[J]. PNAS, 2006, 103(49):18580-18585. |
| [20] | Hoffman B, Liebermann DA. c-MYC in apoptosis and cancer[J]. Oncogene, 2008, 27:6462-6472. |
| [22] | Chen WH, Lai MT, Wu AT, et al. In vitro stage-specific chondrogenesis of mesenchymal stem cells committed to chondrocytes[J]. Arthritis Rheum, 2009, 60(2):450-459. |
| [23] | Gurusinghe S, Strappe P. Gene modification of mesenchymal stem cells and articular chondrocytes to enhance chondrogenesis[J]. BioMed Research International, 2014, Article ID 369528. http://dx. doi. org/10. 1155/2014/369528. |
| [24] | Paula AC, Martins TM, Zonari A, et al. Human adipose tissue-derived stem cells cultured in xeno-free culture condition enhance C-MYC expression increasing proliferation but bypassing spontaneous cell transformation[J]. Stem Cell Res Ther, 2015, 6(1):76. |





