miRNA表达分析和功能探索在转基因生物领域中已成为热点问题。microRNA(miRNA)是一类内源性的21-25 nt大小的单链非编码小分子RNA,在生物体内广泛存在,能够在转录后水平调控基因的表达,与机体的生长、发育、繁殖、疾病等活动相关[1]。miRNA在不改变基因结构的基础上影响基因的表达,成为表观遗传学的重要组成部分。目前对于miRNA 在生殖发育中的研究已逐步展开,包括对miRNA 高通量分析,特异性的组织或细胞中特定 miRNA 的表达、调控靶基因和功能研究[2]。fat-1基因来源于秀丽线虫(Caenorhabditis elegans,C. elegans),又名ω-3多聚不饱和脂肪酸脱氢酶基因。其产物ω-3多聚不饱和脂肪酸脱氢酶以ω-6多聚不饱和脂肪酸(Omega-6 polyunsaturated fatty acids,ω-6 PUFAs)为底物,将其脱氢转化为ω-3多聚不饱和脂肪酸(Omega-3 polyunsaturated fatty acids,ω-3 PUFAs)[3],ω-3 PUFAs作为重要生物活性物质,对人体健康尤其在预防和治疗心脑血管、癌症等多种疾病方面有着重要作用。增加膳食中ω-3 PUFAs的含量,能够显著减少冠心病发病率与死亡率,并且能延缓动脉粥样硬化进展[4]。本研究利用荧光定量PCR分析转fat-1鲁西黄牛、克隆牛和正常受精牛主要器官组织中miR-483和miR-486的表达情况,旨在探讨miR-483和miR-486可能的作用。
1 材料与方法 1.1 材料转fat-1基因鲁西黄牛的制备:构建fat-1基因pST200表达载体,转染牛胎儿成纤维细胞,G418筛选后挑选转基因单克隆,核移植获得供体细胞,得到转基因克隆胚胎,通过胚胎移植到代孕鲁西黄牛体内,出生后经鉴定为转fat-1基因牛。采集3例正常受精、2例克隆、2例转基因鲁西黄牛心脏、肝脏、脾脏、肺脏、肾脏、胎盘、子叶、子宫内膜组织,迅速放入液氮保存。动物实验经内蒙古大学动物实验伦理委员会批准。
1.2 方法 1.2.1 各组织总RNA的提取将组织从-80℃取出后,用RNAiso for small RNA kit(TaKaRa)提取组织RNA,取2 μL在1%琼脂糖凝胶电泳上检测总RNA的质量并利用Nanodrop测量浓度并测定总RNA的A260/A280的值在1.8-2.1之间。
1.2.2 合成cDNA利用Primer 5.0引物设计软件分别根据miRBase提供的miR-483和miR-486,以及内参U6的序列设计microRNA定量引物(表 1),根据One Step PrimeScript® miRNA cDNA Synthesis Kit(TaKaRa)反转录试剂盒说明书合成cDNA。反应结束后产物保存于-20℃条件下备用。
使用 SYBR® premix Ex TaqTMⅡ(TaKaRa)检测miR-483和miR-486在牛心脏、肝脏、脾脏、肺脏、肾脏、胎盘、子叶和子宫内膜组织的表达水平,美国Bio-Rad 7300公司进行定量PCR反应参数为:95℃预变性30 s;95℃ 5 s,60℃ 31 s荧光检测1次,共40循环。记录每个反应管中的荧光信号到达所设定的阈值时所经历的循环数Ct值,反应结束后根据熔解曲线分析产物特异度,每组均设3个复孔,分析 miR-483 和 miR-486 的相对表达量。
1.2.4 统计学分析以U6 作为内参,miRNA的相对表达水平的数值通过2-ΔΔCt法进行计算。运用统计学软件 SPSS16.0 进行单因素方差分析。
2 结果 2.1 miR-483在正常受精、克隆、转基因鲁西黄牛不同组织中的表达miR-483在心脏中表达量最高,约为在肺脏中表达量的10倍,其次在肾脏中的表达量是肺脏中的6倍左右,在肺脏中的表达量最低(图 1)。
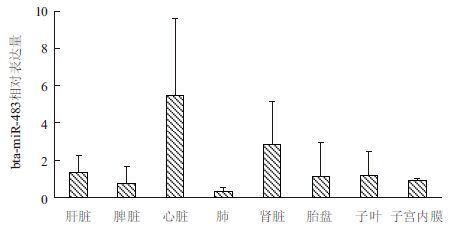
|
| 图 1 miR-483 在牛不同组织中的表达 |
miR-486在心脏中表达量最高,约为在肝脏中表达量的13倍(P=0.021,具有显著差异);其次在肺脏中表达量是肝脏中表达量的2倍左右;在肝脏和子叶中表达量最低(图 2)。

|
| 图 2 miR-486 在牛不同组织中的表达(a 代表P<0.05) |
miR-483和miR-486在克隆牛、转基因牛心脏中的表达要低于正常受精牛的心脏(图 3)。

|
| 图 3 miR-483(A)和miR-486(B)在正常受精、克隆和 转基因鲁西黄牛心脏表达(a 代表P<0.05) |
ω-3 PUFAS能提高心肌细胞的电稳定性,而心肌细胞的电稳定性的提高能防治心率不齐[5],对体内ω-6/ω-3 PUFAS比值的改变和对体内脂代谢的调节,能有效的降低血压、血脂[6]。武珅等[7]发现增加fat-1基因在体内的表达是预防心血管硬化的有效方法。miRNA 的表达具有时序性和空间特异性,王家骥等[8]通过对靶基因进行调节从而实现对动物发育的调控。随着研究的不断深入,人们逐渐认识到miRNA在进化过程中的保守性以及在生物进化和疾病发展过程中起着重要的调控作用,通过抑制靶基因的表达产生基因沉默的效应。
近年来研究发现,miRNA参与调控心脏病理生理过程,推测 miRNA 在心肌肥大、心肌梗死中扮演重要角色[9, 10, 11]。目前,在生物体内已鉴定出超过6 000个miRNA 分子,而在人类基因组中约30% 的基因受 miRNA调控[12],其在心脏、肝脏及脑等不同组织中都具有特异性表达,有研究通过分析6个心衰胎儿和4个正常胎儿心脏microRNA芯片[13],获得110个显著差异microRNA,其中miR-483和miR-486表达量显著下调,推测与胎儿心衰有关。Sucharov等[14]通过对6个非心衰、5个缺血性扩张型心脏病和5个特发性扩张型心脏病的病人的microRNA芯片分析,也得出miR-483和miR-486在非心衰病人组中表达量显著下调的结论,证明microRNA可能调控心肌疾病中关键性重编程重塑基因的表达,参与到心肌疾病中。郝艳坤等[15]筛查肥胖大鼠心脏microRNA的表达变化,寻找与肥胖诱发心肌损伤及心律失常相关的miRNA,发现在肥胖模型组的 miRNA 表达谱中明显差异表达的miRNA 共有 7个,其中miR-483表达下调,提示miRNA可能参与肥胖诱发心肌损伤和心律失常的调节作用。Zhang等[16]研究发现miR-483在怀孕和哺乳期喂养母体高脂肪(HF)饮食的子代中表达显著降低。
miRNA的差异表达及对基因的调控机制已成为当前科学研究的热点之一。miRNA可能参与调控多个靶基因,而一个基因也可能受多个miRNA调控。从miRBase数据库中预测出人源的miR-483 定位于胰岛素样生长因子2(insulin-like growth factor 2,IGF2)的第2内含子[17]。Zhang等[16]的研究结果提示miR-483在喂养高脂肪饮食的小鼠后代中表达量显著降低,同时伴随着IGF2 mRNA表达水平显著提高,预示着IGF2可能是miR-483的靶基因。小鼠胎儿体重可能受IGF2基因上的多态性的影响[18],低浓度IGF2可能涉及增重和肥胖[19]。
miR-486在哺乳动物中是保守的,富集于心肌、骨骼肌和平滑肌中,肌肉生长抑制素(Myostatin)是骨骼肌生长的负调控因子,可降低肌肉中蛋白合成,Hitachi等[20]在敲除myostatin小鼠后发现miR-486表达水平显著提高,证实miR-486可能是连接肌肉生长抑制素信号和调控骨骼肌通路中的调控分子。Small等[21]证明同源性磷酸酶-张力蛋白(PTEN)可能是miR-486靶位点,PTEN是磷酸肌醇3激酶/ Akt信号通路的负调控基因,后者是胰岛素受体下游的主要通路,推测miR-486能在骨骼肌中调节胰岛素依赖的葡萄糖摄取。本研究结果表明,miR-483和miR-486在正常受精和转fat-1基因牛心脏中差异表达,提示其表达变化可能与fat-1表达有关。
4 结论通过检测miR-483和miR-486在正常受精、克隆、转fat-1基因鲁西黄牛不同组织中的相对表达水平,发现miR-483和miR-486在正常受精牛、克隆牛和转fat-1基因牛的组织中均有表达,其中在心脏中表达量显著高于其他组织。而转基因牛心脏中miR-483和miR-486表达量均低于正常受精牛。
| [1] | Sun K, Lai EC. Adult-specific functions of animal microRNAs[J]. Nature Reviews Genetics, 2013, 14(8):535-548. |
| [2] | Dhahbi JM, Atamna H, Boffelli D, et al. Deep sequencing reveals novel microRNAs and regulation of microRNA expression during cell senescence[J]. PLoS One, 2011, 6(5):e20509. |
| [3] | Spychalla JP, Kinney AJ, Browse J. Identification of an animal omega-3 fatty acid desaturase by heterologous expression in Arabidopsis[J]. Proc Nat Acad Sci USA, 1997, 94:1142-1147. |
| [4] | Wu Y, Zhang C, Dong Y, et al. Activation of the AMP-activated pro-tein kinase by eicosapentaenoic acid(EPA, 20:5 n-3)improves endothelial function in vivo[J]. PLoS One, 2012, 7(4):e35508. |
| [5] | Kang JX, Leaf A. Antiarrhythmic effects of polyunsaturated fatty acids:Recent studies[J]. Circulation, 1996, 94:1774-1780. |
| [6] | Howe PR. Dietary fats and hypertension. Focus on fish oil[J]. Ann N Y Acad Sci, 1997, 827:339-352. |
| [7] | 武珅, 杜卫华, 等. Fat-1基因在n-3多不饱和脂肪酸功能研究中的应用[J]. 中国生物工程杂志, 2008, 28(8):136-141. |
| [8] | 王家骥, 贾竹青, 周春燕. microRNA在心脏发育和心脏疾病中的作用[J]. 中国科学:生命科学, 2012, 42(12):957-966. |
| [9] | van Rooij E, Marshall WS, Olson EN. Toward microRNA- based therapeutics for heart disease:the sense in antisense[J]. Circulation Research, 2008, 103(9):919-928. |
| [10] | Care A, Catalucci D, Felicetti F, et al. MicroRNA-133 controls cardiac hypertrophy[J]. Nat Med, 2007, 13(5):613-618. |
| [11] | van Rooij E, Sutherland LB, et al. Dysregulation of microRNAs after myocardial infarction reveals a role of miR- 29 in cardiac fibrosis[J]. Proc Natl Acad Sci USA, 2008, 105:13027-13032. |
| [12] | Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120:15-20. |
| [13] | Thum T, Galuppo P, Wolf C, et al. MicroRNAs in the human heart:a clue to fetal gene reprogramming in heart failure[J]. Circulation, 2007, 116:258-267. |
| [14] | Sucharov C, Bristow MR, Port JD. miRNA expression in the failing human heart:functional correlates[J]. Journal of Molecular and Cellular Cardiology, 2008, 45:185-192. |
| [15] | 郝艳坤, 姜兴, 郎临川, 等. microRNA在大鼠肥胖模型心肌中的变化[J]. 哈尔滨医科大学学报, 2008, 42(6):568-570. |
| [16] | Zhang J, Zhang F, Didelot X, et al. Maternal high fat diet during pregnancy and lactation alters hepatic expression of insulin like growth factor-2 and key microRNAs in the adult offspring[J]. BMC Genomics, 2009, 10:478. |
| [17] | Veronese A, Lupini L, et al. Oncogenic role of miR-483-3p at the IGF2/483 locus[J]. Cancer Res, 2010, 70(8):3140-3149. |
| [18] | Gaunt TR, Cooper JA, Miller GJ, et al. Positive associations between single nucleotide polymorphisms in the IGF2 gene region and body mass index in adult males[J]. Human Molecular Genetics, 2001, 10:1491-1501. |
| [19] | Sandhu MS, Gibson JM, Heald AH, et al. Low circulating IGF-II concentrations predict weight gain and obesity in humans[J]. Diabetes. 2003, 52:1403-1408. |
| [20] | Hitachi K, Nakatani M, Tsuchida K. Myostatin signaling regulates Akt activity via the regulation of miR-486 expression[J]. Int J Biochem Cell Biol, 2014, 47:93-103. |
| [21] | Small EM, O’Rourke JR, Moresi V. et al. Regulation of PI3-kinase/Akt signaling by muscle-enriched microRNA-486[J]. Proc Nat Acad Sci USA, 2010, 107:4218-4223. |





