2.杭州师范大学衰老研究所,杭州 310036
2. Institute of Aging Research of Hangzhou Normal University,Hangzhou 310036
白细胞介素24(IL-24)是近年来发现的一种肿瘤细胞抑制因子。IL-24基因最初是在1995 年由美国哥伦比亚大学的Jiang等[1]生物学家通过差示杂交的方法从人类黑色素瘤细胞中克隆得到的。因它可以诱导黑色素瘤细胞分化,故又名为黑色素瘤分化相关基因-7(mda-7)[2]。人mda-7基因为单拷贝基因,包含7个外显子和6个内含子,与IL-10家族的IL-10、IL-20等共同定位于人一号染色体的lq32,其cDNA全长为1 718 bp,mRNA长约2 kb,编码由206个氨基酸组成、相对分子质量约为23.8 kD的蛋白质[3, 4, 5]。IL-24蛋白N端含有一个包含49个氨基酸的信号肽,此信号肽与蛋白的分泌和切割密切相关[6]。IL-24蛋白能抑制包括肝癌、肺癌、胰腺癌、卵巢癌、结肠癌、前列腺癌等大多数肿瘤细胞的生长,具有广谱的抗肿瘤效应,且对正常细胞的生长没有影响[7, 8]。IL-24是目前发现的唯一一种既具有肿瘤抑制特性又能刺激免疫功能的细胞因子,其II期临床研究证实IL-24蛋白的有效性与安全性[9]。因此IL-24在肿瘤的临床治疗方面具有广阔的应用前景。本研究拟构建人不包含信号肽的IL-24基因的原核表达载体,通过Banki等[10]建立的ELP-Intein表达纯化系统进行IL-24蛋白的原核表达和纯化,为IL-24在肿瘤临床治疗的应用奠定基础。
1 材料与方法 1.1 材料E.coli DH5α、E.coli BLR(DE3)、hepG2细胞为本实验室保存;原核表达载体pET-ELP-Intein为杭州师范大学李建峰老师赠送;Taq DNA聚合酶、限制性内切酶BsrG I和HindⅢ、T4 DNA ligase购自NEB公司、DNA Marker、蛋白Marker、Annexin V-FITC/PI细胞凋亡检测试剂盒购自TaKaRa公司;兔抗IL-24抗体和荧光标记的羊抗兔IgG二抗购自Abcam公司;质粒小量提取试剂盒、PCR产物回收试剂盒购自AxyGEN公司;氨苄青霉素、IPTG、Tris-HCl、十二烷基硫酸钠(SDS)、30%丙烯酰胺、过硫酸铵、甘氨酸、叠氮化钠、考马斯亮蓝R-250等试剂购自Solarbio公司;引物合成服务由上海捷瑞生物技术有限公司完成;基因测序服务由上海美吉生物技术有限公司完成。
1.2 方法 1.2.1 引物设计及基因扩增根据GenBank中不含信号肽的人IL-24基因序列,设计引物IL-24-F:5'- GCGTGTACAATGGGGGCCCAGGGCCAAGAGTTTC-ACT 3'(划线部分为BsrG I酶切位点,前面3个为保护碱基),IL-24-R:5'-CCCAAGCTTTCAGAGCTTG-TAGAATTTCTGCATC-3'(划线部分为Hind III酶切位点,前面3个为保护碱基),以肝癌细胞hepG2的cDNA为模板,扩增不含信号肽的人IL-24基因(480 bp)。PCR反应条件为:95℃预变性2 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min,循环30次;72℃再延伸5 min。PCR产物以1%的琼脂糖凝胶电泳进行检测,切下胶上的目的条带后使用DNA回收试剂盒回收纯化。
1.2.2 重组质粒pET-ELP-Intein-IL-24的构建将回收的PCR产物和pET-ELP-Intein质粒用限制性内切酶BsrG I和Hind III双酶切,回收酶切产物,利用T4 DNA连接酶将双酶切后的IL-24基因和pET-ELP-Intein质粒进行连接,连接产物转化至E.coli DH5α感受态细胞,在含有氨苄青霉素抗性的LB平板中筛选阳性转化子。挑出单克隆接种LB液体培养基培养,提取质粒,将质粒用BsrG I和Hind III双酶切鉴定,鉴定正确后送至上海美吉生物公司进行性DNA测序。
1.2.3 ELP-Intein-IL-24融合蛋白的诱导表达将测序正确的重组质粒pET-ELP-Intein-IL-24转化至E.coli BLR(DE3)感受态细胞,在含有氨苄青霉素抗性的LB平板中筛选阳性转化子。挑出单克隆接种LB液体培养基培养,提取质粒,将质粒用BsrG I和Hind III双酶切鉴定。将鉴定正确的单菌落接种于含氨苄青霉素的LB液体培养基中,37℃,200 r/min振荡培养过夜。按1∶100将培养过夜的菌液转接于LB液体培养基中,37℃,200 r/min振荡培养至OD600达到0.5左右,加入IPTG至终浓度为0.5 mmol/L,20℃,150 r/min诱导培养12 h。离心收集菌体,超声破碎,菌液破碎后将上清和沉淀中的蛋白进行12% SDS-PAGE电泳检测。
1.2.4 ELP-Intein-IL-24融合蛋白的纯化菌液超声破碎后,收集上清,加入等体积的0.8 mol/L(NH4)2SO4溶液(降低融合蛋白的Tt),轻轻混匀,放入37℃恒温水浴锅静置20 min,使融合蛋白发生相变反应(此时由于溶液温度高于Tt,融合蛋白是以固体形式存在于沉淀中,但杂蛋白却不会发生相变反应,所以杂蛋白会随着上清一起被除去);37℃,16 000×g离心10 min,弃上清;用预冷的PBS缓冲液重新悬浮含有融合蛋白的沉淀,使融合蛋白重新溶解(此时由于溶液温度低于Tt,融合蛋白会重新变为可融状态,溶解在PBS缓冲液中);4℃,16 000×g离心10 min,弃沉淀,将上清收集在干净的EP管中;重复上述步骤进行第2轮相变反应,提高融合蛋白的纯度。纯化后的蛋白进行12% SDS-PAGE电泳检测。
1.2.5 ELP-Intein-IL-24融合蛋白的自切割反应In-tein蛋白在25℃左右,pH6.5的条件下能在巯基化合物的作用下发生自我切割反应,将Intein蛋白N端或C端的目的蛋白切割下来。
按0.585 g/L EDTA、8.368 g/L Bis-Tris、1%巯基乙醇溶解于PBS缓冲液中,调整pH值至6.5,配制成Intein自切割缓冲液。将溶解于Intein自切割缓冲液的融合蛋白置于25℃水浴中,进行Intein蛋白自我切割反应,以释放目的蛋白。15 h后自动切割过程结束,向溶液中加入等体积的0.8 mol/L(NH4)2SO4溶液,37℃水浴静置20 min,使ELP-Intein标签发生相变。切割下的ELP-Intein标签和未切割完全的融合蛋白将转变为沉淀,失去标签的目的蛋白则保持可溶状态存在于上清中。切割下来的目的蛋白进行12% SDS-PAGE电泳检测。
1.2.6 IL-24蛋白的Westernblot鉴定 取适量切割下来的IL-24蛋白,100℃加热变性处理后,进行SDS-PAGE电泳实验,然后将目的蛋白条带点转移至聚偏二氟乙烯(PVDF)膜上,用抗体封闭液室温振荡封闭1 h后,依次加入兔抗IL-24抗体和荧光标记的羊抗兔IgG二抗,在红外荧光扫描成像仪观察实验结果。
1.2.7 IL-24蛋白诱导肝癌细胞hepG2凋亡的检测于12孔细胞培养板中将hepG2细胞在含10%胎牛血清的DMEM培养基中培养传代4次至对数生长期,将原核表达的IL-24蛋白过滤除菌后加入细胞培养孔中,使终浓度为20 mg/L,另外一个细胞培养孔中不加IL-24蛋白作为对照组,置于37℃ CO2细胞培养箱中培养24 h后,分别收集并洗涤实验组和对照组细胞,将细胞用Sigma凋亡检测试剂盒内的1×Binding Buffer均匀悬浮;吸取500 μL细胞悬浮液于1.5 mL EP管中,加入5 μL Annexin V-FITC和10 μL PI轻轻混匀后于4℃避光反应15 min;用200目滤膜过细胞悬液,1 h内用流式细胞仪检测细胞凋亡率。
2 结果 2.1 IL-24基因扩增如图 1所示,以肝癌细胞hepG2的cDNA为模板进行IL-24基因的PCR扩增,产物经1%琼脂糖凝胶电泳检测,能得到一条480 bp左右的条带,与目的基因大小相符。

|
| 图 1 IL-24基因的PCR扩增 |
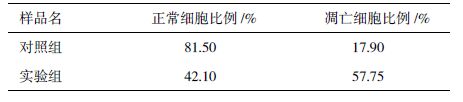
如图 2所示,将重组质粒pET-ELP-Intein-IL-24用BsrG I和Hind III双酶切后,获得一条480 bp左右的条带,此条带大小与IL-24基因大小相符。将双酶切鉴定正确的质粒进行基因测序,测序结果表明连入pET-ELP-Intein质粒中的IL-24基因与GenBank中IL-24基因的碱基序列完全一致,说明重组质粒pET-ELP-Intein-IL-24构建成功。
|
| 图 2 重组质粒PET-ELP-Intein-IL-24双酶切鉴定 |
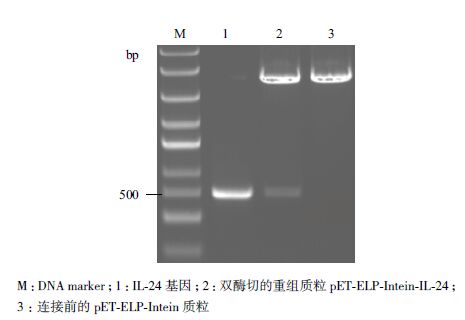
将重组PET-ELP-Intein-IL-24质粒转化到宿主菌株BLR(DE3)中并筛选出阳性重组子,重组菌株在LB培养基中培养至OD600达到0.5左右,加入IPTG至终浓度为0.5 mmol/L,20℃,150 r/min诱导培养12 h。离心收集菌体,超声破碎,对上清和沉淀分别进行12% SDS-PAGE电泳检测。如图 3所示,上清中明显有一条50 kD左右的蛋白条带,与ELP-Intein-IL-24融合蛋白的大小相符,沉淀中在50 kD处的条带并不明显,没有转化pET-ELP-Intein-IL-24质粒的BLR(DE3)菌株表达产物在50 kD处也无明显条带。说明ELP-Intein-IL-24融合蛋白诱导表达成功,且表达出的融合蛋白是可溶的。
|
| 图 3 ELP-Intein-IL-24融合蛋白的SDS-PAGE电泳检测 |
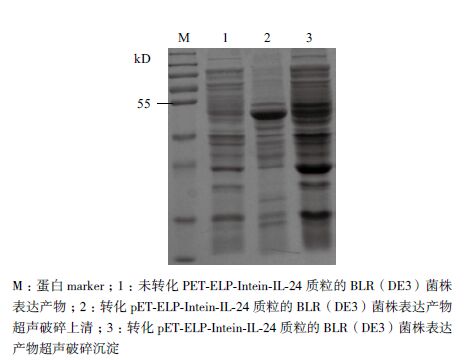
如图 4所示,加入(NH4)2SO4溶液降低ELP-Intein-IL-24融合蛋白的Tt后,经过两轮相变反应,能去除绝大多数杂蛋白,得到高纯度的ELP-Intein-IL-24融合蛋白。
|
| 图 4 ELP-Intein-IL-24融合蛋白纯化后的SDS-PAGE电泳检测 |
如图 5所示,ELP-Intein-IL-24融合蛋白25℃下在自切割缓冲液中进行自切割反应20 h后,能成功切割掉ELP-Intein标签,得到18 kD左右大小的蛋白,与人IL-24蛋白大小相符。

|
| 图 5 自切割后的IL-24蛋白SDS-PAGE电泳检测 |
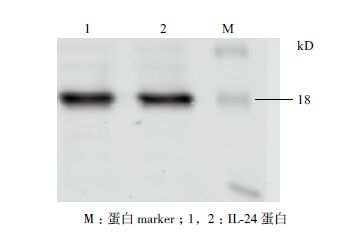
将去掉标签的IL-24蛋白进行Western blot实验(图 6),在荧光成像仪下观察到在18 kD处明显有一条带,说明此蛋白为IL-24蛋白。
|
| 图 6 IL-24蛋白的Western blot鉴定 |
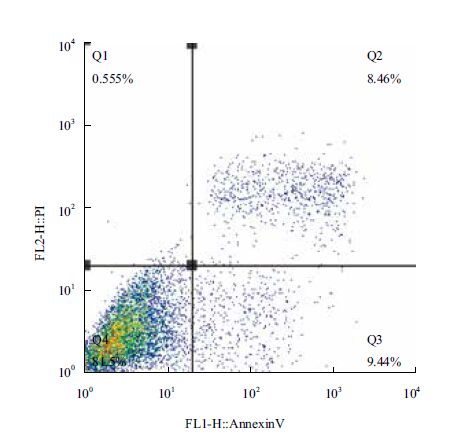
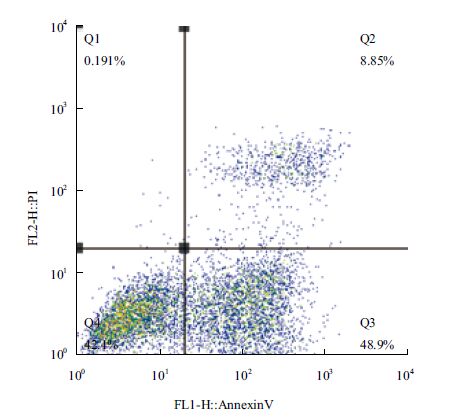
图 7和图 8分别为细胞凋亡的流式检测结果,将流式数据制作成表格,如表 1所示。培养24 h后,不加IL-24蛋白处理的对照组中hepG2细胞的中凋亡率只有17.90%,加入IL-24蛋白处理后,hepG2细胞的凋亡率明显升高,达到了57.75%,说明原核表达的IL-24蛋白具有明显的诱导肝癌细胞hepG2凋亡的生物学活性。
|
| 图 7 对照组细胞凋亡检测 |
|
| 图 8 实验组细胞凋亡检测 |
IL-24具有明显的抗肿瘤效果,在恶性肿瘤的临床治疗方面具有极大的应用前景。人体内IL-24的表达主要集中在具有免疫功能的一些细胞,如外周血单核细胞、巨噬细胞、NK细胞和正常的黑色素瘤细胞[11, 12, 13]。IL-24的对肿瘤的抑制作用不依赖于p21和p53等抑癌基因的活性来实现[14]。此外,IL-24还可以抑制肿瘤的转移、抑制肿瘤血管的形成以及提高恶性肿瘤对化疗和放疗的敏感性[15, 16, 17]。Pan等[18]将腺病毒介导的IL-24基因(Ad-IL-24)导入胰腺癌细胞后,实验发现Ad-IL-24可以通过显著上调Bax、Caspase和下调VEGF、CD34和bcl-2的表达来诱导胰腺癌细胞发生凋亡,并且对正常细胞没有明显影响。
传统的原核表达方法虽然能表达IL-24蛋白,但产物往往是存在于包涵体之中[19],要经过包涵体溶解、变性、复性等过程后才能进行IL-24蛋白的层析柱纯化[20]。然而经过变复性的蛋白很难保持原有的生物学活性,而且用层析柱进行蛋白纯化不仅操作繁琐,而且成本高。本研究使用ELP-Intein系统进行IL-24蛋白的原核表达,利用类弹性蛋白ELP在不同温度下的可逆相变特性和内含肽Intein的自切割反应进行IL-24蛋白的纯化[21]。成功表达并纯化出了可溶且有抗肿瘤生物学活性的IL-24蛋白,为进一步研究IL-24蛋白的功能及其在肿瘤临床治疗上的应用奠定了基础。
4 结论本研究成功构建了重组质粒pET-ELP-Intein-IL-24,利用ELP-Intein表达系统表达并纯化了具有生物学活性的IL-24蛋白,通过原核表达获得了可溶并具有生物学活性的IL-24蛋白。
| [1] | Jiang H, Lin JJ, Su ZZ, et al. Subtraction hybridization identifies a novel melanoma differentiation associated gene, mda-7, modulated during human melanoma differentiation, growth and progression[J]. Oncogene, 1995, 11(12):2477-2486. |
| [2] | Dent P, Yacoub A, Hamed HA, et al. The development of MDA-7/IL-24 as a cancer therapeutic[J]. Pharmacol Ther, 2010, 128(2):375-384. |
| [3] | 兰观华, 邵增务. 癌特异性的细胞凋亡诱导因子MDA-7/IL-24的研究进展[J]. 中国骨肿瘤疾病, 2008, 7(1):50-53. |
| [4] | 王少慧, 郑锐青, 孙万邦. mda-7/IL-24及其抗肿瘤机理研究进展[J]. 国际免疫学杂志, 2013, 36(1):36-39. |
| [5] | Panneerselvam J, Munshi A, Ramesh R. Molecular targets and signaling pathways regulated by interleukin(IL)-24 in mediating its antitumor activities[J]. Journal of Molecular Signaling, 2013, 8(15):1-14. |
| [6] | Lee KM, Kang HA, Park M, et al. Interleukin-24 attenuates beta-glycerophosphate-induced calcification of vascular smooth muscle cells by inhibiting apoptosis, the expression of calcification and osteoblastic markers, and the Wnt/beta-catenin pathway[J]. Biochemical and Biophysical Research Communications, 2012, 428(6):50-52. |
| [7] | Bhutia SK, Das SK, Azab B, et al. Targeting breast cancer-initiating/stem cells with melanoma differentiation-associated gene-7/interleu-kin-24[J]. International Journal of Cancer, 2013, 133(11):2726-2736. |
| [8] | 梁光辉, 赵军. 白细胞介素24抗肿瘤治疗的研究进展[J]. 中国血液流变学杂志, 2011, 21(2):375-377. |
| [9] | Whitaker EL, Filippov VA, Duerksen-Huqhes PJ. Interleukin 24:Mechanisms and therapeutic potential of an anti-cancer gene[J]. Cytokine & Growth Factor Reviews, 2012, 23(6):323-331. |
| [10] | Banki MR, Feng LA, Wood DW. Simple bioseparations using self-cleaving elastin-like polypeptide tags[J]. Nature Methods, 2005, 2(9):659-661. |
| [11] | Cheng H, Zou L. IL-24 expression at maternal-fetal interface and its roles in trophoblast invasion[J]. Huazhong Univ Sci Technolog Med Sci, 2008, 28(4):456-459. |
| [12] | 卫裴, 梁杰. IL-24抗肿瘤机制及其对瘫痕疙瘩作用研究进展[J]. 齐齐哈尔医学院报, 2013, 34(1):83-85. |
| [13] | 包红, 崔逢德. 白细胞介素24及其抗肿瘤特性的研究进展[J]. 延边大学医学学报, 2010, 33(2):148-151. |
| [14] | Gupta P, Walter MR, Su ZZ, et al. Bip/GRP78 is an intracellular target for MDA-7/IL-24 induction of cancer-specific apoptosis[J]. Cancer Res, 2006, 66(16):8187-8189. |
| [15] | Wang Z, Lv J, Zhang T. Combination of IL-24 and cisplatin inhibits angiogenesis and lymphangiogenesis of cervical cancer xenografts in a nude mouse model by inhibiting VEGF, VEGF-C and PDGF-B[J]. Oncol Rep, 2015, 33(5):2468-2476. |
| [16] | Emdad L, Lebedeva IV, Su ZZ, et al. Melanoma differentiation associated gene-7/interleukin-24 reverses multidrug resistance in human colorectal cancer cells[J]. Mol Cancer Ther, 2007, 6(11):2985-2994. |
| [17] | Inoue S, Branch CD, Gallick GE, et al. Inhibition of Src kinase activity by Ad-mda7 suppresses vascular endothelial growth factor expression in prostate carcinoma cells[J]. Mol Ther, 2005, 12(4):707-715. |
| [18] | Pan XT, Zhu QY, Li DC, et al. Effect of recombinant adenovirus vector mediated human interleukin-24 gene transfection on pancreatic carcinoma growth[J]. Chin Med J(Engl), 2008, 121(20):2031-2036. |
| [19] | 刘朝阳, 高丹, 徐帆洪. TRAIL114~281-IL-24融合蛋白的原核表达及其体外抗肿瘤细胞活性[J]. 中国生物制品学杂志, 2010, 23(9):1-4. |
| [20] | 刘志刚, 朱健琦, 黄海珍, 等. 真核表达与原核表达的德国小蠊变应原Blag2蛋白结构的光谱学研究[J]. 光谱学与光谱分析, 2006, 26(5):879-881. |
| [21] | 林衡, 许崇波, 孙利慧, 等. 类弹性蛋白标签在重组蛋白分离纯化中的应用[J]. 生物技术通报, 2012(12):40-44. |