2 北京市植物保护站,北京 100029
2. Beijing Plant Protection Station,Beijing 100029z
黄瓜细菌性角斑病是世界范围内的黄瓜的主要病害之一,是为黄瓜由丁香假单胞菌黄瓜致病型(Pseudomonas syringae pv. lachrymans)引起,是一种重要的细菌性病害,于 20 世纪初首次被Carsener等[1]报道。20世纪80年代,日本、加拿大和美国等地因为细菌性角斑病遭受了严重的经济损失[2, 3, 4]。我国在20世纪50年代时对黄瓜细菌性角斑病也有初步报道,但由于病害并不严重,所以没有引起广泛重视,直到80年代,该病害在华北、东北和内蒙古等黄瓜的主要产区逐渐肆虐,已成为黄瓜种植中的严重灾害,才引起了人们的重视。该病散布快,传播范围广,如果黄瓜遭遇此病害,严重时可导致绝产,造成严重经济损失[5, 6]。近几年来,该病已散布到全国的黄瓜保护地。此外,丁香假单胞菌的寄主非常广泛,1988年,孙福在等[7]证明该病原菌除了可侵染黄瓜外,还可以侵染葫芦、西葫芦和丝瓜等葫芦科植物。
传统的检测方法如生理生化指标鉴定,细菌的分离培养等都是依靠表型来鉴定致病菌,耗时长,灵敏度很低,并且不准确[8]。ELISA等血清学鉴定致病菌,快速而灵敏,近来也有过一些报道[9]。但丁香假单胞菌有50多个致病型[10],因此对抗体的筛选也增加了很多困难,综上原因,构建一个重复性好,灵敏度高的致病菌的分子检测方法对于农业生产中预防和控制该疾病有着很重要的意义。普通的qPCR虽然能够对病原菌进行定量,但不能区分病原菌的死活[11, 12]。有研究表明病菌在死亡后数天甚至数周内DNA都能够保持完整[13],因此如何区分病原菌的死活就成为分子检测手段的巨大挑战。叠氮溴化丙锭(ą)是一种能与DNA高度亲和的荧光染料,它能穿过受损细胞膜内,在可见光的照射下能与其DNA共价交联,从而达到阻碍受损细胞中的DNA进行PCR扩增的作用[14, 15]。在农业生产中针对于患病植株有很多处理方法的建立可以成为判断各处理方法有效性的一种手段[16]。因此将ą染料与实时定量PCR结合可以准确、快速的鉴定致病菌并准确对活菌数进行定量。
gap1基因是甘油醛-3-磷酸脱氢酶基因,作为参与新陈代谢的基因,丁香假单胞菌的gap1基因具有高度的保守性,因此gap1基因可以用于检测该致病菌。本研究将GenBank中丁香假单胞菌黄瓜致病型的gap1基因序列进行比对,根据其保守区设计特异性引物,构建针对于gap1基因的ą-qPCR检测方法。并将该方法应用于实际样品的检测,旨为快速鉴定、测取单位患病叶片中活菌含量提供一种检测手段。
1 材料与方法 1.1 材料 1.1.1 供试菌株及实际样本丁香假单胞菌黄瓜致病型菌株(Pseudomonas syringae pv. lachrymans);水稻白叶枯病病原菌(Xanthomonas oryzae);番茄溃疡病病原菌(Clavibacter michiganensis subsp. michigan-ensis);黑腐病病原菌(Xanthomonas campestris);青枯病病原菌(Ralstonia solanacearum),黄瓜缘枯病致病菌(Pseudomonas marginalis pv. marginalis)和大肠杆菌(E.coli)、金黄色葡萄球菌(Staphylococcus aureus);患细菌性角斑病黄瓜叶片(采自房山区)。
1.1.2 主要试剂及设备ą 染料(Biotium,美国),RNase-free ddH20(TIANGEN,北京),ExTaq DNA 聚合酶(TaKaRa,大连),100 mmol/L dNTP(TIAN-GEN,北京),Marker I,50×TAE Buffer,质粒提取试剂盒,pGM-T载体构建试剂盒,细菌基因组提取试剂盒,DNA产物纯化回收试剂盒,TRIZOL试剂(TIANGEN,北京)Goldview(Biodee,北京)。SuperReal PreMix Plus(TIANGEN,北京)Qubit核酸/蛋白定量仪(Invitrogen,美国),H2O3程控金属浴(GingkoBio,北京),电泳仪(Bio-Rad,美国),凝胶成像仪(Bio-Rad,美国),MX3000P 荧光定量 PCR 仪(Stratagene,美国)。
1.2 方法 1.2.1 丁香假单胞菌黄瓜致病型gap1基因片段的扩增取Pseudomonas syringae pv. lachrymans甘油保存液10 μL于液体LB培养基中在28℃过夜培养,取5 mL菌液提取基因组,以提取的基因组为模板进行PCR扩增,用primer5根据GenBank上Pseudomonas syringae pv. lachrymans gap1基因保守区设计引物 Xf1 Xf2,引物序列见表 1。PCR反应体系为 2 μL模板,10×PCR buffer 5 μL 2.5 mmol/L dNTPs 4 μL,Ex Taq酶 0.5 μL,上下游引物各1 μL,加ddH2O补足至50 μL。反应程序:94℃ 5 min;94℃ 45 s,51℃ 45 s,72℃ 2 min,共30个循环;72℃ 10 min。对PCR产物进行1%琼脂糖凝胶电泳,回收扩增产物保存并测序(北京瑞博兴科)。与GenBank上Pseudomonas syringae pv. lachrymans gap1基因 91%同源,可知此菌为丁香假单胞菌黄瓜治病型中的其中一种。
荧光定量PCR引物的长度要求为80-200 bp间最好,最长不能超过300 bp,根据primer5根据上一步扩增并回收的636 bp产物序列进行引物设计,得到扩增产物为126 bp的一对引物Dxr1和Dxf1,序列见表 1。为验证引物特异性,以丁香假单胞菌黄瓜致病型基因组为模板进行荧光定量PCR验证,常见的植物病原细菌,包括水稻白叶枯病病原菌;番茄溃疡病病原菌;黑腐病病原菌;青枯病病原菌,黄瓜缘枯病致病菌和大肠杆菌、金黄色葡萄球菌两种模式细菌基因组为对照。qPCR体系为SuperReal PreMix Plus 12.5 μL引物各0.4 μL模板 2 μL加水补足至25 μL。扩增程序为:95℃ 10 min;95℃ 1 min,60℃ 30 s,72℃1 min,共40个循环。
1.2.3 构建重组质粒使用pGM-T载体与636 bp的PCR产物连接,并转化到DH5α感受态细胞。进行蓝白斑筛选,挑单个白斑于20 mL LB培养基中过夜培养,提取质粒(天根质粒提取试剂盒)进行PCR鉴定和测序鉴定。
1.2.4 Real-time PCR 标准曲线的建立用Qubit测得质粒浓度,根据质粒拷贝数计算公式算出质粒拷贝数,公式为(6.02×1023)×(ng/μL×10-9)/(DNA length× 660)= copies/μL。将标准质粒稀释成5×101-5×107 7个体度在MX3000P 荧光定量 PCR 仪上进行扩增,条件体系参见1.2.2。总反应结束后自动获得标准曲线和熔解曲线。
1.2.5 黄瓜细菌性角斑病实际样本的检测 1.2.5.1 ą-qPCR的技术原理ą-qPCR技术以细胞膜的完整性作为评判细菌死活的标准,主要是由于当细胞的细胞膜不完整时,ą能够进入细胞与细胞内的DNA结合,而细胞膜完整时ą则会被阻隔在细胞外面,当强光照射时,与DNA结合的ą会形成叠氮基团使之结合的更紧密,从而阻止其之后的qPCR扩增,而未与DNA结合的ą在强光照射下会与水反应而被消除,所以细胞膜完整的细胞,也就是活菌内的DNA可以扩增,而细胞膜不完整的死亡细菌内的DNA则不会扩增[17]。根据ą的技术原理可知ą染料是在DNA提取时起作用。
1.2.5.2 ą的预处理及DNA的提取根据李聪聪等[18]的方法,将ą用20%DMSO配制成1 μg/μL的工作液,-20℃避光保存。称取患细菌性角斑病的黄瓜叶片100 mg迅速放进研钵用液氮研磨,将粉末转移至2 mL的EP管中。向EP管内加995 μL PBS,涡旋震荡。将EP管用铝箔纸包住,向EP管中加5 μL ą工作液,使ą的终浓度为5 μg/mL。将加完ą染料的EP管放入摇床150 r/min震荡5 min后,将所有管置于冰上,距离500 W氯素灯下照射5 min,期间隔30 s转动EP管,使其照射均匀[19]。ą处理后将EP管10 000 r/min离心5 min,将液体吸干保留固体,再用Trizol法提取DNA。
1.2.5.3 样品DNA的QPCR检测将上步提取的DNA为模板,条件体系参照1.2.2,使用MX3000P 荧光定量 PCR 仪进行实时荧光定量PCR检测,将测得的Ct值代入标准曲线公式中算出样本中丁香假单胞菌的拷贝数。
2 结果 2.1 丁香假单胞菌黄瓜治病型gap1基因的扩增将产物回收测序后得到的片段长度为636 bp,与GenBank上Pseudomonas syringae pv lachrymans gap1基因 91%同源,可知此菌为丁香假单胞菌黄瓜致病型中的其中一种。
2.2 荧光定量引物的特异性验证经过荧光定量PCR扩增后,只有丁香假单胞菌黄瓜致病型有扩增,Ct值为14.66,其他的植物病原细菌,黄瓜病原细菌,模式细菌都没有Ct值(表 2)。证明该引物可以区分黄瓜细菌性角斑病致病菌和其他病原细菌。
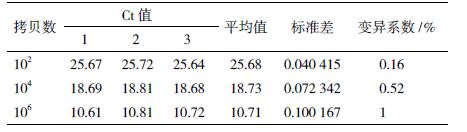
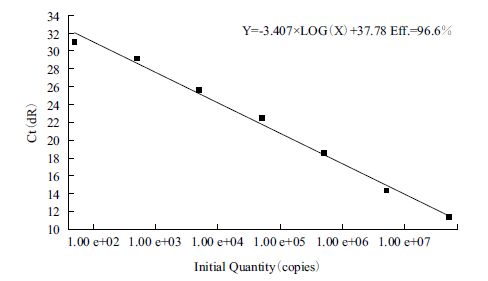
重组质粒经测序表明插入的gap1基因片段与预期的片段序列100%同源。稀释的5×101-5×107 7个梯度的质粒经实时定量PCR扩增后自动生成基线、阈值和熔解曲线。以质粒的拷贝数为横坐标,反应的Ct值为纵坐标,绘制丁香假单胞菌gap1基因检测的标准曲线,可得初始模板数与Ct值之间的线性关系公式,为Ct=-3.407×log 拷贝数+ 37.78,扩增效率为96.6%(图 1)。根据样本的Ct值通过此公式可以计算出对应的初始拷贝数。另外熔解曲线为单一峰,Tm值为88.2℃(图 2),证明引物特异性极好,无引物二聚体和非特异性扩增。
|
| 图 1 gap1基因标准曲线 |
选择102、104、106三个梯度的质粒进行组内和组间的重复性分析,结果(表 3和表 4)显示,组内变异系数均小于1%。组间变异系数均小于2%。
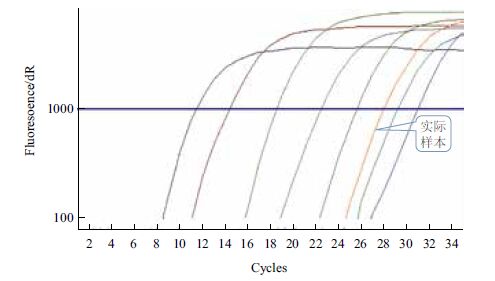
将实验建立的ą-qPCR方法应用于检测将黄瓜细菌性角斑病叶片,ą预处理后提取基因组实时荧光定量PCR进行检测(图 3),测得实际样品的Ct值为27.99,将实验测出的Ct值带入模板数与Ct之间的线性关系公式得出gap1基因的拷贝数为7.69×102。
|
| 图 3 实际样品和标准品扩增曲线 |
实时荧光定量PCR主要有两种方法,Taqman探针法和SYBR Green荧光染料法[20],后者能与所有双链DNA结合,因此对DNA模板没有选择性,因此,采用SYBR Green荧光染料法时对引物的特异性要求高,应避免发卡结构,非特异性扩增,引物二聚体生成。Taqman法虽然针对特定的DNA模板,但合成探针费用较高。本研究根据丁香假单胞菌黄瓜致病型gap1基因设计的引物熔解曲线Tm值单一,因此适用于SYBR Green荧光染料法,可以省去Taqman探针合成的费用。
黄瓜细菌性角斑病与黄瓜霜霉病的早期性状十分相似,单凭患病表征难以判定,在农业生产中容易导致霜霉病和细菌性角斑病的混淆,引起误诊,造成很严重的经济损失。近来也不乏有许多针对于黄瓜细菌性角斑病的分子检测的研究,王哲等[21]针对丁香假单胞菌的gap1基因设计一对特异性引物,对不同来源的12株丁香假单胞菌进行PCR扩增,均扩增出179 bp的条带,其他参试菌株都没有扩增出条带,该方法的灵敏度为7. 5×103 CFU/mL,利用该方法可从接种后的黄瓜叶片中检测到特异条带。王平等[22]针对丁香假单胞菌的ITS序列设计特异性引物,扩增出473 bp的条带,利用该方法可直接对黄瓜叶片汁液进行病原菌检测,并且可在接种后病症发生前72 h内检测到病原。此外,Fogliano等[8]也建立了血清学的检测方法,在每克鲜植株中可以检测出近 0.1 mg 的 syringpeptins。这些方法都可以快速地检测丁香假单胞菌,但灵敏度不够。用于检测该致病菌的荧光定量PCR检测方法也未见报道。本研究构建的实时荧光定量的方法不仅可以快速鉴定致病菌,还能准确的对其进行定量,可以检测5×101 copies/μL。
将ą与qPCR联合应用可以对有活性的致病菌准确定量。ą-qPCR方法联合应用此前也有很多文献[23, 24, 25, 26]报道过,但基本都是应用于水体中致病菌的检测,很少应用于植物中病原体的检测。长期以来,农业上也有很多种预防和处理黄瓜细菌性角斑病的方法[27, 28],但由于细菌有活的不可培养这一状态[29],所以常规的平板技术法并不能准确的验证这些处理技术的杀菌效果,结合本研究的ą-qPCR方法,可以对实际样本中活菌的数量进行准确的定量,筛选出最有效的杀菌技术,为黄瓜细菌性角斑病的防治提供有力的保证。
4 结论本研究将ą与qPCR技术结合,设计了一对特异性引物Dxf1、Dxr1,可以对活的黄瓜细菌性角斑病致病菌进行准确定量,qPCR体系为SuperReal PreMix Plus 12.5 μL引物各0.4 μL模板 2 μL加水补足至25 μL。程序为:95℃ 10 min;95℃ 1 min,60℃ 30 s,72℃ 1 min,共40个循环。灵敏度为5×101 copies/μL。此外,以黄瓜细菌性角斑病病原菌为实验组,其他植物细菌性病原菌和模式细菌为对照组,进行荧光定量PCR扩增,验证引物特异性。结果表明只有黄瓜细菌性角斑病致病菌有扩增。证明该引物可以特异检测黄瓜细菌性角斑病病原菌。
| [1] | Carsner E. Angular-leafspot of cucumber:dissemination, overwintering, and control:Cooperative investigations between the University of Wisconsin and the Bureau of Plant Industry, United States Department of Agriculture[M]. Government Printing Office, 1918. |
| [2] | Dessert J, Baker L, Fobes J. Inheritance of reaction to Pseudomonas lachrymans in pickling cucumber[J]. Euphytica, 1982, 31(3):847-855. |
| [3] | Kennedy BW, Alcorn S. Estimates of US crop losses to procaryote plant pathogens[J]. Plant Disease, 1980, 64(7):674-676. |
| [4] | Watanabe Y, Ohuchi A. Angular leaf spot of cucumber in Japan[J]. JARQ-Japan Agricultural Research Quarterly, 1983, 17(2):112-119. |
| [5] | Olczak-Woltman H, Schollenberger M, Mądry W, et al. Evaluation of cucumber(Cucumis sativus)cultivars grown in Eastern Europe and progress in breeding for resistance to angular leaf spot(Pseud-omonas syringae pv. lachrymans)[J]. European Journal of Plant Pathology, 2008, 122(3):385-393. |
| [6] | Zhao XL, Sun JD, Cheng HT. Isolation of antagonistic bacteria ageinst angular leaf spot disease on cucumber[J]. Journal-Shenyang Agricultural University, 2005, 36(3):349. |
| [7] | 孙福在, 何礼远. 黄瓜细菌性角斑病病原菌与寄主范围鉴定[J]. 植物病理学报, 1988, 18(1):23-28. |
| [8] | Fogliano V, Gallo M, Vinale F, et al. Immunological detection of syringopeptins produced by Pseudomonas syringae pv. lachrymans[J]. Physiol Mol Plant Pathol, 1999, 55(5):255-261. |
| [9] | 陈爱华, 杨坚. 酶联免疫吸附(ELISA)法在食品微生物检测中的应用[J]. 中国食品添加剂, 2004, 4:109-111. |
| [10] | Olczak-Woltman H, Masny A, Bartoszewski G, et al. Genetic diversity of Pseudomonas syringae pv. lachrymans strains isolated from cucumber leaves collected in Poland[J]. Plant Pathology, 2007, 56(3):373-382. |
| [11] | 陈旭, 齐凤坤, 康立功, 等. 实时荧光定量 PCR 技术研究进展及其应用[J]. 东北农业大学学报, 2010, (8):148-155. |
| [12] | 付春华, 陈孝平, 余龙江. 实时荧光定量 PCR 的应用和进展[J]. 激光生物学报, 2006, 14(6):466-471. |
| [13] | Josephson K, Gerba C, Pepper I. Polymerase chain reaction detection of nonviable bacterial pathogens[J]. Applied and Environmental Microbiology, 1993, 59(10):3513-3515. |
| [14] | Nocker A, Cheung CY, Camper AK. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells[J]. Journal of Microbiological Methods, 2006, 67(2):310-320. |
| [15] | Nocker A, Sossa-Fernandez P, Burr MD, et al. Use of propidium monoazide for live/dead distinction in microbial ecology[J]. Appl Environ Microbiol, 2007, 73(16):5111-5117. |
| [16] | 张振家, 郁继华, 王喜林. 黄瓜细菌性角斑病防治试验初报[J]. 甘肃农业大学学报, 1989, 4:63-66. |
| [17] | 仝铁铮, 吴舒旭, 李丹, 等. 基于 PMA-定量 PCR 选择性检测技术的病原菌消毒特性研究[J]. 环境科学, 2011, 32(4):1120-1126. |
| [18] | 李聪聪, 余以刚, 邱杨, 等. PMA-qPCR 方法用于监测超声波灭菌效率的适用性及其应用[J]. 现代食品科技, 2012, 28(4):409-411. |
| [19] | Wang LJ, Tan QL, Zhu J, et al. Development of PMA-qPCR assay for rapid and accurate detection of viable Lactobacillus para-casei in fermented dairy products[J]. Chinese Journal of Microecology, 2013, 25(1):1-4. |
| [20] | Matsenko N, Rijikova V, Kovalenko S. Comparison of SYBR Green I and TaqMan real-time PCR formats for the analysis of her2 gene dose in human breast tumors[J]. Bulletin of Experimental Biology and Medicine, 2008, 145(2):240-244. |
| [21] | Zhe W, Qing C, Qian T, et al. Using PCR for rapid detection of Pseudomonas syringae pv. lachrymans[J]. Plant Quarantine, 2011, 6:012. |
| [22] | 王平, 樊金娟, 刘长远, 等. 黄瓜细菌性角斑病的分子检测[J]. 中国农学通报, 2012, 28(25):150-153. |
| [23] | Fujimoto J, Watanabe K. Quantitative detection of viable bifidobacterium bifidum BF-1 cells in human feces by using propidium monoazide and strain-specific primers[J]. Applied and Environmental Microbiology, 2013, 79(7):2182-2188. |
| [24] | Van Frankenhuyzen JK, Trevors JT, Flemming CA, et al. Optimization, validation, and application of a real-time PCR protocol for quantification of viable bacterial cells in municipal sewage sludge and biosolids using reporter genes and Escherichia coli[J]. J Ind Microbiol Biotechnol, 2013, 4011:1251-1261. |
| [25] | Salam KW, El-Fadel M, Barbour EK, et al. A propidium monoazide-quantitative PCR method for the detection and quantification of viable Enterococcus faecalis in large-volume samples of marine waters[J]. Appl Microbiol Biotechnol, 2014, 9820:8707-8718. |
| [26] | Kim S, Ko G. Using propidium monoazide to distinguish between viable and nonviable bacteria, MS2 and murine norovirus[J]. Letters in Applied Microbiology, 2012, 55(3):182-188. |
| [27] | 孙艳秋, 赵奎华, 曹远银, 等. 黄瓜细菌性角斑病免疫胶体金检测试纸条的研制[J]. 植物病理学报, 2011, 412:131-138. |
| [28] | 孙艳秋, 刘长远, 曹远银, 等. 黄瓜细菌性白枯病病菌检测试纸条的研制[J]. 中国植保导刊, 2014, 34(10):8-11. |
| [29] | Dinu LD, Bach S. Detection of viable but non-culturable Escherichia coli O157:H7 from vegetable samples using quantitative PCR with propidium monoazide and immunological assays[J]. Food Control, 2013, 31(2):268-273. |