2.中节能六合天融环保科技有限公司,北京 100082
2. CECEP Liuhe Talroad Environment Technology Co.,Ltd,Beijing 100082
作为常温常压下唯一一种呈液态的金属,汞在环境中分布十分广泛。汞可以通过干湿沉降等方式进行长距离迁移,进而被输送到偏远地区,因此汞作为一种全球性污染物受到广泛关注[1]。近年来,土壤汞污染问题日益恶化,仅在我国,被汞污染的农耕土地就达32 000 hm2。土壤汞污染主要来源于矿山开采、金属冶炼等人为源,在有些矿区,随着矿山的不断开发,土壤中汞含量有升高的趋势,甚至每千克高达数万毫克[1]。
土壤汞污染问题引起全球关注,各国政府和研究人员陆续开展针对土壤汞污染修复的研究,并形成多种修复技术。与物理修复技术、化学修复技术不同,生物修复技术作为一种原位修复技术,具有修复成本低、二次污染小、绿色环保、潜在经济效益巨大等优点,在土壤汞污染修复领域中兴起,并逐渐占据重要作用。当前,该领域许多研究往往着重于汞在土壤中的形态转化、生物有效性及钝化过程,对植物体内微界面、根际微界面过程研究较少。本文对近年来土壤汞污染生物修复技术研究现状进行评述,重点偏重于汞在植物、微生物体内生物过程的概述,最后对生物修复技术存在的问题进行总结,并对该技术发展趋势和研究方向进行展望,以期为后续进行该类研究提供思路与参考。
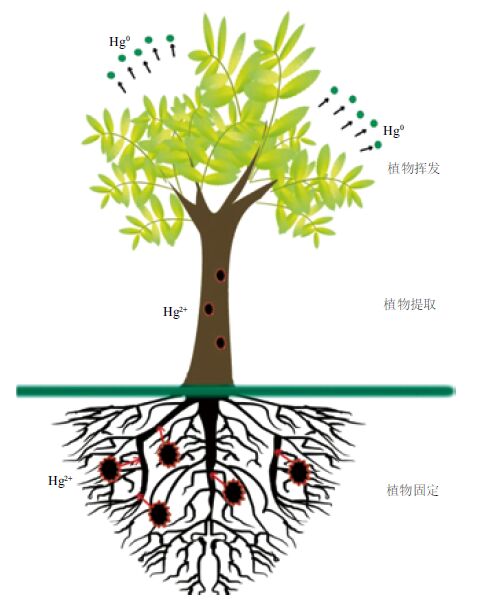
1 植物修复技术(Phytoremediation)自1977年新西兰梅西大学Brooks等[2]首次提出“超积累植物(hyperaccumulator)”概念以来,植物修复技术在土壤重金属污染修复领域已经得到快速发展。植物修复指利用植物及根际微生物减少、去除土壤中重金属浓度及毒性的一种修复技术[3]。Hg2+在植物体内的运输与分配过程需经过植物根细胞壁、细胞膜、液泡膜等跨膜传输和木质部、韧皮部装载来完成[4]。按照修复机理的不同,土壤汞污染植物修复分为植物固化修复、植物挥发修复、植物提取修复(图 1)。基因工程和化学调控技术能有效提高植物生物量、增强土壤中汞活性,在植物修复领域得到广泛使用。
|
| 图 1 植物修复机理 |
有些植物根系发达,叶芽密集,对汞具有较好的耐性,其根系分泌有机酸等物质来吸收、沉淀土壤中的汞,茂盛的叶芽能促进植物蒸腾作用的不断进行,阻止重金属对地下水侵蚀,植物提取的汞大部分被富集在植物根部,从而达到固化土壤中汞污染物的目的。
植物固化修复土壤汞污染包括根际土壤中汞的活化、汞在根部细胞壁固定、在液泡中隔离、汞在根部木质部装载等过程。植物根围分泌的碳水化合物、氨基酸等物质能活化土壤中的汞,增大根部汞的可吸收量。大量研究表明,植物根系细胞壁是植物去除汞毒害的第一道屏障:Hg2+除了易于与细胞壁上碳酸盐、硫酸盐、磷酸盐等阴离子化合物结合,形成不溶性沉淀外[5],还能与壁上纤维素、半纤维素、木质素、果胶等物质富含含氧配体结合,形成稳定化合物[6]。只有当土壤中汞污染物浓度过高时,多余的汞才会进入细胞,该过程与植物体内IRT1对Hg2+具有一定亲和度的吸收转运能力有关[7]。此外,P-type ATPase与水通道蛋白在Hg2+的跨细胞膜运输过程中也起一定作用[8]。Hg2+进入细胞质后,诱导植物络合素合酶形成一种富含Cys的多肽化合物——植物络合素(phytochelatins,PCs),PCs在汞的细胞解毒过程中起重要作用:PCs以Cys巯基与Hg2+在细胞质络合生成Hg-PC复合物,该复合物通过液泡膜运输进入液泡[9],由于液泡在植物细胞中占据较大体积,其代谢活性低,且Hg-PC复合物较Hg2+毒性低[10],所以液泡成为根部隔离植物汞污染物主要重要场所。
土壤中其他化学物质的加入对植物固化效果也有影响。As的吸收能够提高水稻根表面阴离子的量,进而提高根部对汞的吸收,增加水稻根处汞的富集[11]。土壤中硒(Se)的添加能抑制植物地上部分对汞的提取,这可能是因为Se与Hg在植物根围处生成了难溶物质HgSe[12]。土壤中的汞多以HgS的形式存在,生物有效性低,为了提高植物根部对汞的吸收,常常使用化学螯合剂来强化植物对汞的固化。Lomonte等[13]对KI、(NH4)2S2O3强化香根草富集汞现象进行研究。研究表明,螯合剂加入前后汞均富集于香根草根部,但KI、(NH4)2S2O3的加入明显提高了植物根部维管束汞的富集量,这一方面因为香根草生物量大,根系长,根系很容易进入深层土壤;另一方面,Hg与Hg-S2O3、Hg-I复合物在植物中运输机理可能不同:加入螯合剂前,汞在植物根表皮与外皮层会与Cys残基络合,阻碍复合物在植物体内运输;加入螯合剂后,Hg-S2O3、Hg-I复合物与Cys残基络合的可能性大大降低,从而有利于植物对汞的提取。作为另一种重要螯合剂,EDTA能脱附土中汞,提高汞在土壤溶液中浓度,促进植物根部对汞的吸收;Hg-EDTA复合物为中性电荷,不会被根被皮细胞表面的羧基或多糖物质吸附,能够使Hg直接进入植物根部[14]。
植物固化技术要求植物根系发达,生物量大,且固化植物不应用于动物饲料使用。草类由于根系发达,能够有效减少风蚀和地表径流,树木在减少地表径流方面效果更佳,因此寻求草类与树木联合用于植物固化修复能有效提高固化效果。此外,使用植物固化修复应要求污染土壤质地粘重,有机质含量高,这一修复技术常常应用于矿山污染场地修复,在城市土壤污染中应用较少。
1.2 植物提取修复(phytoextraction)许多研究表明,相比植物地上部分,汞更易于富集在植物根部。Hg2+能穿过细胞膜进入细胞共质体,然后转运至中柱,进入木质部,进而到达植物地上部分[15]。但由于根部内皮层上凯氏带作用,使得Hg2+必须进入共质体后才能进入木质部参与运输,这也抑制了Hg2+向地上部的运输[16]。与植物固化修复相类似,Hg在植物地上部分室化也包括Hg2+在细胞壁上沉积、液泡内隔离等过程,且汞在液泡内隔离在此过程中扮演着更为重要的作用。研究发现,谷胱甘肽(glutathione,GSH)作为一种强抗氧化剂,可同时作为PCs合成底物参与PCs的合成,且GSH的合成主要发生在植物地上部,然后再转运到植物根部[9]。此外,通过基因工程方法可以发现金属硫蛋白基因(metallothioneins,MTs)[17]、谷胱甘肽巯基转移酶(glutathione-S-transferase)[18]基因可以调节植物氧化应激效应,降低汞在植物中的活性,进而提高植物对汞的富集能力。
由于汞的生物有效性较低,可以通过添加螯合剂、植物激素、表面活性剂等化学物质强化植物对汞的吸收,提高修复效率,有关硫代硫酸盐等螯合剂强化植物提取修复土壤汞污染的研究最为多见。硫代硫酸盐在活化土壤中汞的同时,还能促使S2O32-与Hg2+反应生成Hgx(S2O3)y,植物根部细胞膜处可能存在一些特定转运子将Hgx(S2O3)y提取并优先转运至植物地上部[19]。由于细胞膜内pH值偏小,Hgx(S2O3)y会分解成Hg2+与硫酸盐,硫酸盐会在细胞内同化生成腺苷酰硫酸(adenosine-5'-phosphosulfate,APS)、SO32-、S2-、Cys,Hg2+与S2-在细胞内生产HgS沉淀,大大降低汞的生物毒性[20]。实际上,S主要位于Cys与甲硫氨酸残基等植物蛋白巯基中,影响蛋白质结构、形成与功能[21];S2-可增强Hg-PCs复合物的稳定性及Hg2+结合能力[22]。EDTA、(NH4)2S2O3等螯合物能提高根部汞通过根外体进入维管束的流量,使得汞的提取主要由共质体途径变为质外体途径[23, 24],大大提高了植物富集效果。近年来,由于螯合剂的添加导致地下水污染问题得到更多重视。氮肥能在一定程度上阻止根部氧化应激效应,提高植物根的生长与汞的提取量[25]。柠檬酸作为一种自然界中广泛存在的有机酸,能降低土壤pH值,促进汞在土壤中活性,与汞形成复合物,且易降解,不会对地下水造成威胁,在强化植物修复领域逐渐得到重视[26]。
由于目前并没有筛选出汞超富集植物,因此往往选用高生物量的树木、灌木类植物研究其汞提取能力,并能取得较为理想结果。但不可否认,相比植物的高生物量,植物具有超富集能力和较好抗性更为重要,超富集植物虽然生物量低,但更易于重金属的回收、处理;而非超富集植物在重金属后续处理中更为繁琐,耗资也会更大,因此现阶段研究重点还是应该寻找对汞有较高富集能力的植物。
1.3 植物挥发修复(phytovolatilization)与植物固化和植物提取修复技术相比,植物挥发修复技术去除土壤汞污染往往受到限制:Hg0从植物叶部挥发受到光照和温度的影响较大,且Hg0挥发到大气中会对大气造成污染,因此植物挥发技术应用并不多,目前多处于实验室研究阶段[27]。
随着分子生物学的快速发展,基因工程在Hg0的去除过程中发挥着越来越大的作用。其机理就是从汞抗性细菌中提取抗性基因,导入目标植物进行表达,从而达到去除土壤中汞污染目的。大量研究表明,格兰阴性菌和格兰阳性菌的mer操纵子对汞具有良好的耐性和转化性能,细菌中的merA、merB、merR、merD、merT、merP、merC、merF、merG、merE及merH基因在汞抗性细菌中功能各异:merB基因编码有机汞裂解酶,将有机汞降解为Hg2+(公式1),而merA编码的汞离子还原酶能在NADPH提供电子供体时将Hg2+还原为Hg0(公式2)[28],此过程中merT、merC、merF、merE及merH等转运蛋白[29, 30]与merR、merD等调控蛋白[31]的作用也十分明显。将细菌中merB基因导入ppk/merT转基因烟草中,merB先将有机汞还原为Hg2+,Hg2+再与ployP螯合生成低毒性的Hg-ployP复合物,增强了植物的汞耐性[32]。
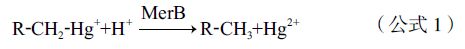
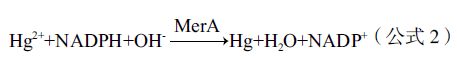
在各种土壤汞污染植物修复技术中,植物挥发修复是最具争议的一种技术。这种技术往往只是将土壤中的汞转移到空气中,并不能对污染场地汞污染物进行有效的去除,且植物提取的Hg0往往量较小,通常需要借助基因工程方法进行强化,而基因工程在目前属于比较有争议的话题;加上植物通过叶脉也会吸收空气中的Hg0,故该修复技术的实际修复效果并不明确。从组织和细胞水平来看,汞在植物叶片中转化机制并不清楚,这些因素都制约了该技术的应用。
2 微生物修复技术(bioremediation)土壤中的细菌、真菌具有独特的生理特性,可以利用它们这些特性达到去除土壤中汞污染物的目的。当前,比较普遍的一种研究方法是利用mer操纵子编码蛋白,通过去甲基化过程,将有机汞转化为成Hg0,而Wiatrowski等[33]发现厌氧细菌Shewanella oneidensis MR-1可以在细胞表面结构的作用下还原Hg2+,而无需merA的调节作用,从而拓宽了人们对微生物还原Hg2+机理的认识范围。
在植物的根系周围1 mm范围内,微域土区的生物化学过程与土体差别较大,这部分土区被称为根际(包括根表面)[34]。植物将光合作用产物转移至根际处,促进土壤微生物的新陈代谢;土壤中的微生物(主要是细菌和真菌)也能将土壤中有机物转化成无机物被植物吸收,同时微生物分泌有机酸等提高重金属生物有效性(10-100倍)[35]。研究发现,丛枝菌根(Arbuscular mycorrhizae,AM)真菌是土壤中分布最为广泛的菌根,它通过改变植物根际土壤pH值和Eh、根际微生物群落结构,使得重金属迁移性和生物有效性增强,提高植物对重金属的耐性[36]。厌氧细菌Geobacter sulfurreducens PCA通过与Hg直接接触,能同时还原和结合Hg2+,当细胞/Hg2+较小时,此时还原占据优势,细胞上Hg2+能被SnCl2还原为Hg0[37]。通过对酵母菌株研究可发现,AtABCC1与AtABCC2基因能诱导菌株体内产生PCs,形成Hg-PCs复合物,降低汞的毒性[10],说明巯基的存在能促进微生物汞的解毒过程。
与无机汞相比较,有机汞(甲基汞)毒性更强,因此利用微生物去甲基化研究尤为重要。汞的微生物去甲基化按照反应机理主要分为还原性去甲基化与氧化性去甲基化[1],其中还原性去甲基化多与mer操纵子有关,还原产物为Hg0、CH4,在汞的去甲基化过程占据主导地位[38]。氧化性去甲基化过程中多发生在厌氧环境中,细菌利用甲醇、单甲基胺等有机物代谢产生的能量将甲基汞裂解,生成Hg2+,期间不需要mer操纵子的调控[4]。目前,有关产甲烷菌[39]、硫酸盐还原菌(sulfate-reducing bacteria,SRB)[40]的氧化去甲基化研究最为广泛,其反应方程如公式3所示[40]。有些情况下,细菌产生硫化物能与甲基汞反应生成中间产物——(MeHg)2S,中间产物再分解为(CH3)2Hg与HgS,(CH3)2Hg降解为甲基汞与甲烷,从而实现将部分甲基汞转变成生物毒性较低的HgS[39]。

微生物修复法前景广阔,但其缺点也较为明显:土壤中的汞并不能完全被去除;微生物对环境变化感知强烈,而且微生物对汞吸附、沉淀机理研究较为薄弱。目前,尚未有有关微生物修复土壤汞污染田间中试的报道。
3 动物修复技术(animal remediation)土壤中的某些低等动物能够通过进食、消化、排泄、分泌、挖掘洞穴等活动改善土壤质量、提高土壤中汞的活性、促进动物/植物/微生物对汞的吸收,从而达到修复土壤污染的目的[41, 42]。蚯蚓对土壤中的汞具有良好的耐性,土壤中汞浓度为每千克数百毫克时,蚯蚓存活率仍高达50%[43]。蚯蚓通过分泌-COOH、-NH2、-C=O等活性基团黏胶物质,螯合土壤中的重金属,激活土壤中重金属的活性;优化结构群落,促进土壤中微生物的活性;分泌植物激素,提高植物对重金属的富集能力,因此蚯蚓被称为“土壤的肠道”、“生态系统工程师”,在动物修复重金属污染领域占据主导地位[44, 45]。
目前,有关蚯蚓对Cd、Pb、Zn、Cu等重金属富集作用的报道较为常见,但有关蚯蚓富集汞的文献极少,国内相关研究文献更是少见。蚯蚓对汞的富集与土壤中汞的形态有关。虽然土壤中无机汞的浓度远远大于有机汞浓度,且长期暴露于汞污染场地的蚯蚓体内无机汞含量远高于有机汞,但蚯蚓对甲基汞富集能力却是无机汞的数百倍[46],这可能是因为甲基汞类脂可溶特性,更易于被蚯蚓吸收[47]。对于森林土壤,蚯蚓体内汞含量还与土壤和地面落叶中汞的含量、土壤pH值、土壤阳离子交换能力等因素有关[48]。虽然目前蚯蚓对汞的耐性机理不是十分清楚,但已有研究证实了长期生长在高汞浓度土壤中的蚯蚓其体内GSH与MT的含量明显增高,这也许是因为GSH与MT在其中充当了抗氧化应激的角色[49]。但也有报道指出,由于蚯蚓肠道处呈缺氧状态,在硫酸盐还原菌SRB作用下,无机汞能发生甲基化反应,使其体内甲基汞量增加[46, 50]。
和其他生物修复技术一样,动物修复汞污染也有自己的局限性:(1)修复效率低;(2)蚯蚓对外界环境变化感知剧烈,其对汞的富集能力易受到外界环境影响;(3)蚯蚓作为外来物种,对当地生态系统会造成破坏。此外,除蚯蚓外,尚未见有关其他动物用于汞污染的文献报道,由于陆生无脊椎动物分布区域广,繁殖能力强,对重金属有一定富集作用,因此应加大对此类生物汞富集特性的研究,寻找更多适合动物修复的候选物种。
4 结语作为经济发展的副产物,土壤汞污染这一问题受到政府与公众越来越多的重视,而一种新兴修复技术——生物修复技术也被更多地应用到土壤汞污染修复上来。通过对比近年来国内外学者对该问题的研究发现,该研究多集中于以下各方面:考察某种植物汞提取、富集特性;通过基因工程和添加土壤改良剂(主要为螯合剂)强化植物汞提取、富集性能;研究处于汞污染土壤中植物、动物体内不同组织部位PCs、GSH及与重金属复合物的含量变化,试图对其吸收、转运、富集机制进行合理的解释。
虽然各国研究人员已经对生物技术修复土壤汞污染研究取得一定成果,但我们应同时看到该领域的研究还存在几大问题:土壤中汞的生物有效性低,螯合剂等物质虽然能有效活化土壤中汞,但却容易造成地下水污染;植物生长周期漫长,植物修复一般只对表土层和心土层有效,并不能完全去除土壤中的汞,动物、微生物生物活性容易受当地环境的影响;有关植物提取汞的机理性研究匮乏,土壤—根际、根际—植物根部、根部—茎部、茎部—叶片处汞的转运、富集生理生化机理不清楚,其分子水平研究尚待加强;基因工程有一定的风险,公众对转基因技术存在疑虑;多轮种植高富集植物会面临土壤中汞浓度逐轮减小、BF系数逐轮降低的局面,导致修复效果降低;目前许多研究仅仅处于实验室研究阶段,只有少数处于中试水平,如何将实验室研究成果应用到实际污染场地将是一大难题。
针对以上提出的生物法修复土壤汞污染存在的几大问题,笔者认为后续的研究应主要从以下几方面着手:
(1)研究植物不同生长时期螯合剂的添加对植物提取效率、地下水渗滤风险的影响,并尽快开发一种无毒易降解、新型高效的人工/天然螯合剂,再辅以堆肥等物质处理,在提高植物对汞的提取效率的同时,有效解决螯合剂引起的二次污染风险问题。(2)国家加大对转基因技术研究支持力度,同时对公众大力推广转基因技术科普宣传,从根本上扭转公众对转基因技术误解。研究人员应加快在实验室环境中筛选汞抗性关键调控基因,并及时将该基因导入目标植物中,测定其汞提取效率,并强化对转基因植物进行广泛而有效的风险评估。(3)强化生物修复与物理、化学修复之间的联合使用,在利用物理、化学修复技术的优点(修复周期短、效率高)同时,也能发挥生物修复的优势。例如可以在污染土壤中通一低强度电场,使土壤中汞得到活化,促进植物提取效率,同时避免了土壤结构遭到破坏。(4)进一步加大生物修复的田间试验与示范工程,并尽早开展该修复技术的大规模场地修复的实际运用。(5)当前,土壤汞污染生物修复已经发展成为多学科融合性技术,包括土壤化学、植物生物学、生态学、土壤微生物学、环境工程学、土地学、土壤毒理学、分析化学、分子生物学、遗传学等,而汞在植物微生物中迁移、解毒等机理性研究过程十分匮乏,因此要求我们加大对有关基础科学的研究,并及时地将相应研究成果运用到应用研究上来。此外,寻找对汞有超富集性能的植物仍然是当前最亟待解决的问题。
| [1] | 冯新斌, 陈玖斌, 付学吾, 等. 汞的环境地球化学研究进展[J]. 矿物岩石地球化学通报, 2013, 32(5):503-530. |
| [2] | Brook PR, Lee J, Reeves RD, et al. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants[J]. Geochemical Exploration, 1977, 7:49-57. |
| [3] | Ali H, Khan E, Sajad MA. Phytoremediation of heavy metals-Concepts and applications[J]. Chemosphere, 2013, 91(7):869-881. |
| [4] | 王春霞, 朱利中, 江桂斌. 环境化学学科前沿与展望[M]. 北京:科学出版社, 2011:359-471. |
| [5] | Yang ZM, Chen J. Mercury toxicity, molecular response and tolerance in higher plants[J]. Biometals, 2012, 25(5):847-857. |
| [6] | Carrasco-Gil S, Siebner H, LeDuc DL, et al. Mercury localization and speciation in plants grown hydroponically or in a natural environment[J]. Environmental Science & Technology, 2013, 47(7):3082-3090. |
| [7] | Esteban E, Deza MJ, Zornoza P. Kinetics of mercury uptake by oilseed rape and white lupin:influence of Mn and Cu[J]. Acta Physiologiae Plantarum, 2013, 35(7):2339-2344. |
| [8] | Lopes MS, Lglesia-Turino S, Cabrera-Bosquet L, et al. Molecular and physiological mechanisms associated with root exposure to mercury in barley[J]. Metallomics, 2013, 5(9):1305-1315. |
| [9] | Dago A, Gonzalez I, Arino C, et al. Evaluation of mercury stress in plants from the Almaden mining district by analysis of phytochelatins and their Hg complexes[J]. Environmental Science & Technology, 2014, 48(11):6256-6263. |
| [10] | Park J, Song W, Ko D, et al. The phytochelatin transporters AtABCC1 and AtABCC2 mediate tolerance to cadmium and mercury[J]. Plant Journal, 2012, 69(2):278-288. |
| [11] | Du X, Zhu YG, Liu WJ, et al. Uptake of mercury(Hg)by seeding of rice(Oryza sativa L.)grown in solution culture and interactions with arsenate uptake[J]. Environmental and Experimental Botany, 2005, 54(1):1-7. |
| [12] | Zhang H, Feng XB, Zhu JM, et al. Selenium in soil inhibits mercury uptake and trans location in rice(Oryza sativa L.)[J]. Environmental Science & Technology, 2012, 46(18):10040-10046. |
| [13] | Lomonte C, Wang YD, Doronila A, et al. Study of the spatial distribution of mercury in roots of vetiver grass(Chrysopogon zizanioides)by micro-PIXE spectrometry[J]. International Journal of Phytoremediation, 2014, 16(11):1170-1182. |
| [14] | Shahid M, Pinelli E, Dumat C. Review of Pb availability and toxicity to plants in relation with metal speciation;role of synthetic and natural organic ligands[J]. Journal of Hazardous Materials, 2012, 219:1-12. |
| [15] | Debeljak M, van Elteren JT, Vogel-Mikus K. Development of a 2D laser ablation inductively coupled plasma mass spectrometry mapping procedure for mercury in maize(Zea mays L.)root cross-sections[J]. Analytica Chimica Acta, 2013, 787:155-162. |
| [16] | 杨肖娥, 龙新宪, 倪吾钟. 超积累植物吸收重金属的生理及分子机制[J]. 植物营养与肥料学报, 2002, 8(1):8-15. |
| [17] | Ruiz ON, Alvarez D, Torres C, et al. Metallothionein expression in chloroplasts enhances mercury accumulation and phytoremediation capability[J]. Plant Biotechnology Journal, 2011, 9(5):609-617. |
| [18] | Chen YA, Chi WC, Trinh NN, et al. Transcriptome profiling and physiological studies reveal a major role for aromatic amino acids in mercury stress tolerance in rice seedings[J]. PLoS One, 2014, 9(5):1-11. |
| [19] | Wang JX, Feng XB, Anderson CWN, et al. Implications of mercury speciation in thiosulfate treated plants[J]. Environmental Scien-ce & Technology, 2012, 46(10):5361-5368. |
| [20] | Na G, Sal DE. The role of sulfur assimilation and sulfur-containing compounds in trace element homeostasis in plant[J]. Environme-ntal and Experimental Botany, 2011, 72(1):18-25. |
| [21] | Lomonte C, Doronila AI, Gregory D, et al. Phytotoxicity of biosolids and screening of selected plant species with potential for mercury phytoextraction[J]. Journal of Hazardous Materials, 2010, 173(1-3):494-501. |
| [22] | 冯保民, 麻密. 植物络合素及其合酶在重金属抗性中的功能研究进展[J]. 应用与环境生物学报, 2003, 9(6):657-661. |
| [23] | Shahid M, Austruy A, Echevarria G, et al. EDTA-enhanced phytor-emediation of heavy metals:A review[J]. Soil and Sediment Contamination, 2014, 23(4):389-416. |
| [24] | Lomonte C, Doronila A, Gregory D, et al. Chelate-assisted phytoex-traction of mercury in biosolids[J]. Science of the Total Environ-ment, 2010, 409(13):2685-2692. |
| [25] | Carrasco-Gil S, Estebaranz-Yubero M, Medel-Cuesta D, et al. Influence of nitrate fertilization on Hg uptake and oxidative stress parameters in alfafa plants cultivated in a Hg-polluted soil[J]. Environmental and Experimental Botany, 2011, 75:16-24. |
| [26] | Smolinska B, Krol K. Leaching of mercury during phytoextraction assisted by EDTA, KI and citric acid[J]. Journal of Chemical Technology and Biotechnology, 2012, 87(9):1360-1365. |
| [27] | Wang JX, Feng XB, Anderson CWN, et al. Remediation of mercury contaminated sites - A review[J]. Journal of Hazardous Materials, 2012, 221:1-18. |
| [28] | 杜红霞, Yasuo Igarashi, 王定勇. 汞在微生物中的跨膜运输机制研究进展[J]. 微生物学报, 2014, 54(10):1109-1115. |
| [29] | Mok T, Chen JS, Shlykov MA, et al. Bioinformatic analyses of bacterial mercury lon(Hg2+)transporters[J]. Water Air and Soil Pollution, 2012, 223(7):4443-4457. |
| [30] | Sone Y, Nakamura R, Pan-Hou H, et al. Role of MerC, MerE, MerF, MerT, and/or MerP in resistance to mercurials and the transport of mercurials in Escherichia coli[J]. Biological & Pharmaceutical Bulleftin, 2013, 36(11):1835-1841. |
| [31] | Champier L, Duarte V, Michaud-Soret I, et al. Characterization of the MerD protein from Ralstonia metallidurans CH34:a possible role in bacterial mercury resistance by switching off the induction of the mer operon[J]. Molecular Microbiology, 2004, 52(5):1475-1485. |
| [32] | Nagata T, Morita H, Akizawa T, et al. Development of a transgenic tobacco plant for phytoremediation of methylmercury pollution[J]. Applied Microbiology and Biotechnology, 2010, 87(2):781-786. |
| [33] | Wiatrowski HA, Ward PM, Barkay T. Novel reduction of mercury(Ⅱ)by mercury-sensitive dissimilatory metal reducing bacteria[J]. Environmental Science & Technology, 2006, 40(21):6690-6696. |
| [34] | 马莹, 骆永明, 滕应, 等. 根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报, 2013, 50(5):1021-1031. |
| [35] | 陆雅海, 张福锁. 根际微生物研究进展[J]. 土壤, 2006, 38(2):113-121. |
| [36] | 罗巧玉, 王晓娟, 林双双, 等. AM真菌对重金属污染土壤生物修复的应用与机理[J]. 生态学报, 2013, 33(13):3898-3906. |
| [37] | 胡海燕, 顾宝华, 冯新斌. S12-09厌氧微生物对汞的氧化、还原和甲基化作用[C]. 贵阳:第七届全国环境化学大会摘要集-S12重金属污染与修复, 2013. |
| [38] | 谷春豪, 许怀凤, 仇广乐. 汞的微生物甲基化与去甲基化机理研究进展[J]. 环境化学, 2013, 32(6):926-936. |
| [39] | Marvin-Dipasquale M, Agee J, McGowan C, et al. Methyl-mercury degradation pathways:A comparison among three mercury-impacted ecosystems[J]. Environmental Science & Technology, 2000, 34(23):4908-4916. |
| [40] | Pedrero Z, Bridou R, Mounicou S, et al. Transformation, localization, and biomolecular binding of Hg species at subcellular level in methylating and nonmethylating sulfate-reducing bacteria[J]. Environmental Science & Technology, 2012, 46(21):11744-11751. |
| [41] | 张卫信, 陈迪马, 赵灿灿. 蚯蚓在生态系统中的作用[J]. 生物多样性, 2007, 15(2):142-153. |
| [42] | Sizmur T, Hodson ME. Do earthworms impact metal mobility and availability in soil? - A review[J]. Environmental Pollution, 2009, 157(7):1981-1989. |
| [43] | Gudbrandsen M, Sverdrup LE, Aamodt S, et al. Short-term pre-exposure increases earthworm tolerance to mercury[J]. European Journal of Soil Biology, 2007, 43(1):S261-S267. |
| [44] | 陈旭飞, 张池, 高云华, 等. 蚯蚓在重金属污染土壤生物修复中的应用潜力[J]. 生态学杂志, 2012, 31(11):2950-2957. |
| [45] | Wu G, Kang HB, Zhang XY, et al. A critical review on the bio-removal of hazardous heavy metals from contaminated soils:Issues, progress, eco-environmental concerns and opportunities[J]. Journal of Hazardous Materials, 2010, 173(1-3):1-8. |
| [46] | Alvarez CR, Moreno MJ, Bernardo FJG, et al. Mercury methylation, uptake and bioaccumulation by the earthworm Lumbricus terrestris(Oligochaeta)[J]. Applied Soil Ecology, 2014, 84:45-53. |
| [47] | Zhang ZS, Zhang DM, Wang QC, et al. Bioaccumulation of total and methyl mercury in three earthworm species(Drawida sp., Allolobophora sp., and Limnodrilus sp.)[J]. Bulletin of Environ-mental Contamination and Toxicology, 2009, 83(6):937-942. |
| [48] | Ernst G, Zimmermann S, Christie P, et al. Mercury, cadmium and lead concentrations in different ecophysiological groups of earthw-orms in forest soils[J]. Environmental Pollution, 2008, 156(3):1304-1313. |
| [49] | Colacevich A, Sierra MJ, Borghini F, et al. Oxidative stress in eart-hworms short- and long-term exposed to highly Hg-contaminated soils[J]. Journal of Hazardous Materials, 2011, 194:135-143. |
| [50] | Kaschak E, Knopf B, Petersen JH, et al. Biotic methylation of mercury by intestinal and sulfate-reducing bacteria and their potential role in mercury accumulation in the tissue of the soil-living Eisenia foetida[J]. Soil Biology & Biochemistry, 2014, 69:202-211. |




