哺乳动物卵巢黄体在调控动物繁殖机能方面具有至关重要的作用。动物未妊娠的情况下,卵巢黄体即退化,新一轮的发情方可启动;而妊娠期间黄体退化即可导致胚胎死亡或流产。长期以来,人们围绕黄体退化现象展开了广泛的研究,试图解释黄体退化的分子机制。目前普遍认为,黄体退化分为功能性退化(孕酮水平下降)和结构性退化(细胞程序性死亡)[1]。前列腺素F2α(prostaglandin F2α,PGF2α,PGF)作为哺乳动物的主要溶黄体因子,早在40 多年前即被发现,目前广泛应用于家畜的同期发情、诱导分娩和繁殖障碍治疗等方面[2, 3]。PGF与其受体(prostaglandin F receptor,PTGFR)结合,可诱导黄体组织多种基因包括早期反应、类固醇生成、免疫和血管生成等相关基因的变化[4, 5, 6, 7, 8],但其溶解黄体的具体分子机制尚未完全明确。本文综述了PGF2α的受体及PGF2α诱导的早期反应基因参与黄体退化的分子机制研究进展,以期为进一步研究卵巢黄体退化的分子机制提供理论依据。
1 PGF2α受体对黄体退化的影响PGF2α需与PGF2α受体结合才能调节黄体功能。 PTGFR是具有7个跨膜结构域的G蛋白-偶联受体。假孕小鼠卵巢黄体在第11和13天出现细胞凋亡现象,同时PGF2α受体mRNA水平也达到峰值[9]。Rao等[10]指出,牛在发情周期d3-d13期间,PGF2α以逐步增加的趋势结合到黄体细胞的细胞膜上。猪的卵巢黄体在发情周期全期均存在PTGFR,尽管猪的黄体退化敏感性或溶解能力(luteolytic capacity)发生在发情周期的13 d(相较于其他哺乳动物较迟)以后,但在发情周期的第5 天,卵巢黄体上的PTGFR浓度就足以引起黄体细胞对PGF产生反应[11]。Sakamoto等[12]研究表明,在牛黄体中PTGFR全长存在剪接变异体。这些PTGFR异构体分为两种类型,I型包括α、β和γ,而II型包括δ、ε和ζ。I型异构体具有完整的7个跨膜区域,而II型异构体则是缺乏跨膜结构域VII和全长PTGFR在细胞内可以抑制C末端活性的截短结构。与全长PTGFR mRNA的表达相似,PTGFRα和PTGFRζ的mRNA表达水平在黄体发育的早期和中期上调,PTGFRζ mRNA水平在黄体退化时降低,而PTGFRα mRNA并没有减少。在PGF2α诱导的黄体溶解过程中,全长PTGFR、PTGFRα和PTGFRζ的mRNA水平迅速下调,而PTGFR蛋白则在12 h后才减少。另外,由于环氧化酶是由花生四烯酸合成PG的限速酶,利用小分子RNA干扰技术沉默全长PTGFR能够抑制PGF2α刺激的环氧化酶-2 mRNA的上调,从而抑制了孕酮的合成。研究表明,即使敲除全长PTGFR,PGF2α也可以诱导血管内皮生长因子A(VEGFA)mRNA,提示VEGFA可能是通过其他PTGFR亚型诱导的。也有研究认为I型受体,如PTGFRα,拥有完整的7个跨膜段,PGF2α的信号可能由PTGFRα转移从而诱导VEGFAs[13]。然而,PGF2α能诱导转染全长PTGFR细胞中的蛋白激酶C活性,而在转染PTGFRζ细胞中没有检测到PKC活性[11],提示PTGFR的各亚型可能发挥不同的作用。总之,在发情周期牛黄体细胞PTGFR蛋白不断的表达,提示PGF2α可以在整个发情周期都发挥作用。此外,在牛黄体中PTGFR的亚型均有表达,但是在黄体溶解期间,PGF2α是通过全长PTGFR还是通过PTGFR异构体对黄体产生影响仍然无全面研究。
关于PTGFR在黄体组织中的定位,已有的研究结果显示PTGFR主要定位于黄体类固醇生成细胞,但在血管内皮细胞中的研究结果则不尽相同。Shirasun等[14]研究显示在黄体内皮细胞中存在PGF受体的表达,Liptak等[15]研究显示黄体内皮细胞中不存在PGF受体的表达,Mao等[6]利用牛的血管内皮细胞系研究显示内皮细胞对PGF无反应性,因而内皮细胞上可能没有PTGFR的表达。PTGFR在内皮细胞中的不同表达结果可能是缘于黄体中存在多种类型的内皮细胞[16]。
2 PGF2α诱导的早期反应基因参与黄体退化的分子机制黄体化的卵泡细胞获得对PGF的反应性通过PTGFR实现。在黄体中,PGF2α与其同源受体结合后,激活与膜结合的磷脂酶-C(PLC),磷脂酰肌醇-4,5-二磷酸(PIP2)在PLC作用下水解生成二酰基甘油(DAG)和三磷酸肌醇(IP3)。IP3能够促进细胞内Ca2+的释放,在磷脂代谢中间产物DAG的作用下,激活蛋白激酶C(protein kinase C,PKC)。体内外实验表明,PTGFR激活可迅速诱导Ca2+释放和PKC及Raf-MEK-Erk的激活,这些早期事件可激活MAPK(mitogen-activated protein kinases)信号通路,包括ERK1/2(extracellular-regulated kinases 1/2),p38MAPK 和JNK(c-JUN N terminal kinase)[17],随之激活多种转录因子,尤其是活化的ERK信号可诱导早期反应基因如FOS、JUN、NR4A1、EGR1和ATF3的表达[18, 19]。PGF亦可通过活化NF-κB(nuc-lear factor-kappa B)促进假孕大鼠黄体前列腺素合成酶2的表达,进而促进黄体细胞进一步合成PGF[20]。通过ERK和p70S6K途径,PGF可抑制IGF-1诱导的IRS1/PI3K/AKT信号通路,从而降低牛黄体细胞对IGF-1的反应性[21]。PGF能增加牛黄体eNOS的生成,从而抑制孕酮的分泌[14, 22]。黄体退化的可能分子机制,见图 1。
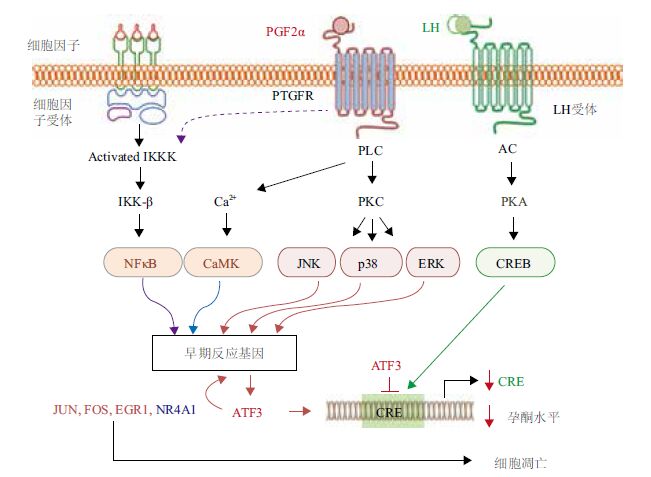
|
| 图 1 卵巢黄体退化的分子机制示意图 |
早期生长反应基因1(early growth response 1,EGR1)是早期生长反应基因家族成员之一。该家族包括4个成员:EGR1(又称为KROX-24、TIS8、ZIF268和NGFI-A)、EGR2(KR-OX-24)、EGR3(PILOT)和EGR4(NGF-IC),它们都含有3个特定的Cys2-Hys2锌指结构,可以识别并结合富含GC-DNA 的序列。Egr家族基因的结构,见图 2[23]。其中Egr2和Egr3最接近,其次是Egr1,而Egr4最远。锌指结构域在4 个成员间最为保守,两个基本结构域在前3个成员间保守,C端的基本结构域也存在Egr4中。互作结构域存在于前3个成员中。Egr1基因定位于5p31,长2.1 kb,编码3.3 kb成熟的mRNA和543AA。

|
| 图 2 Egr的基因结构 |
EGR1通过激活或是抑制靶基因的表达实现其生物学功能,其活化的过程是许多炎症相关性疾病的发生发展的重要环节[24]。EGR1通过影响细胞的增殖和凋亡参与诱导细胞的转化和肿瘤的形成。EGR1在雌性生殖系统中发挥重要作用。利用hCG处理母牛,结果发现处理后6 h卵泡中的Egr1表达量明显上调,进一步利用Forsklin处理颗粒细胞,Egr1表达显著升高,且过表达Egr1可诱导PGHS-2、PGES、PGE2受体和LHR等转录水平上调,提示EGR1在排卵过程中具有潜在作用[25]。作为早期反应基因,EGR1的激活反应涉及到MAPK家族中的ERK1/2及JNK和p38MAPK 3个成员,尤其是可被ERK1/2激活快速上调。
2.1.3 Egr1在黄体中的表达近期研究发现,EGR1可被诱导在黄体组织中表达。Sayasith等[25]利用hCG处理母牛,结果发现处理后6 h黄体组织中的Egr1表达显著上调。Atli等[26]利用PGF对牛进行重复处理研究相关基因的表达模式,结果发现,PGF重复处理4次后的黄体和处理2次黄体退化者的Egr1 mRNA水平上调7倍,而重复2次处理黄体未退化者的Egr1 mRNA水平则平均上调5倍。Hou等[18]利用PGF处理母牛的体内外实验发现,PGF处理1 h后即诱导牛黄体组织EGR1蛋白表达的上调,EGR1蛋白主要定位于黄体细胞的核中,PMA亦可诱导黄体细胞表达EGR1蛋白,PGF诱导的EGR1表达依赖于钙离子和PKC路径,且EGR1的表达受到MEK1/ERK的调控。为了进一步研究Egr1的作用,采用黄体细胞过表达Egr1和PMA处理,结果发现,EGR1可能是通过作用于转化生长因子TGFB1抑制LH介导的孕酮分泌。
2.2 ATF3 2.2.1 ATF3的结构激活转录因子3(activating transcription factor 3,ATF3)是转录因子ATF/CREB家族成员之一,是Hai等[27]用DNA探针在血清诱导的HeLa细胞cDNA库中首次分离出的,定位于染色体1q32.3,大约56 kb,包含6个外显子(图 3)。体外实验表明人类ATF3基因具有两个启动子(P1)[28]。ATF3全长包括181个氨基酸,分子量为22 kD[29],其中40-84 aa肽段有转录抑制活性,碱性亮氨酸拉链区(88-147 aa)是二聚物形成和特异DNA 结合所必需的。尽管很多证据都表明应激会诱导ATF3的迅速表达,但有关ATF3的作用机制了解甚少。瞬时转染和体外转录分析表明,ATF3同二聚体会抑制转录;然而,ATF3可以与Gadd153或其他蛋白质形成异二聚体激活转录。ATF3的长亚型最初被认为会同型二聚体化从而抑制ATF-结合元件启动子的转录。ATF3可以与其他ATF/CREB成员(AT-F2、c-Jun、Jun B和Jun D)形成二聚体,这些异二聚体既可以激活转录也可以抑制转录。ATF3∆Zip,作为ATF3 cDNA的一个可变剪接体,编码一个缺乏亮氨酸拉链二聚体化功能域的截短亚型。ATF3ΔZip即使不结合DNA也会诱导转录,很可能是由于成功抑制了抑制性辅助因子结合基因启动子所致。因此,ATF3基因的可变剪接体很可能对靶基因的调节具有重要的生理学作用。
2.2.2 ATF3的生物学功能ATF3基因表达可以被多种细胞外信号所诱导,包括炎症趋化因子类、生长因子、激素、DNA损伤、营养缺失、细胞因子类、缺氧及内质网应激。尽管ATF3早就被认为是应激反应基因,最近一些报道揭示了ATF3参与到更广泛的适应性反应中,如环境、情绪和营养的改变[30]。在静息状态下,ATF3在大部分健康组织中均有低水平的表达,并可被一系列应激信号快速诱导,它的异常表达可能会参与炎性疾病、免疫性疾病和癌症的发生[31, 32]。另外,ATF3可以调节并控制细胞的增殖、凋亡及发病相关的下游基因。已有研究表明,ATF3的启动子区存在众多的转录因子结合位点,如AP-1、ATF/CRE、NFκB、E2F、MYC/MAX、EGR1、C/EBP和 SMAD蛋白,激活MAPK通路亦可诱导ATF3的表达。Lu等[32]发现在茴香霉素作用下p38信号通路具有促凋亡作用,而ATF3是其功能上的重要靶标,但其中的作用机制还未明确。
2.2.3 ATF3在黄体中的表达近来,有研究表明ATF3在卵巢黄体上可被诱导表达。Mondal等[4]应用PGF2α对处于发情周期第4天(早期)和第11天(中期)的肉牛进行处理。尽管在早期和中期,PGF处理均引起ATF3 mRNA水平的上调,但只有在发情周期中期处理PGF2α时,ATF3蛋白水平才明显上调,提示ATF3有可能参与卵巢黄体退化。
随后,Mao等[6]通过体内外实验相对更深入的研究了ATF3在牛黄体退化中的作用。应用PGF处理发情周期中期的肉牛,结果处理2 h后的ATF3蛋白水平明显上调,且表达至少持续至处理后4 h,ATF3主要定位于大黄体细胞的细胞核内。为了研究ATF3在黄体退化中的可能作用,对黄体组织进行细胞分离,而后利用PGF和TNFα分别处理黄体类固醇生成细胞和血管内皮细胞系,结果发现PGF处理仅在大黄体细胞中诱导了ATF3的表达,而TNFα处理则在大、小黄体细胞和内皮细胞中均诱导了ATF3的表达。与体内实验一致,细胞免疫荧光显示ATF3定位于黄体细胞的细胞核中。由于ATF3在大、小黄体细胞中均有表达,因此应用ATF3过表达大、小黄体细胞,结果过表达ATF3抑制了LH介导的孕酮分泌水平和CRE介导的启动子的转录活性,而对LH刺激4 h的孕酮合成通路的关键调节因子如StAR、P450scc和HSD3B及细胞凋亡则无影响。因此,ATF3可能在PKA信号通路的下游,在胆固醇转化为孕酮之前影响促性腺激素诱导的孕酮分泌。
Guo等[19]利用假孕大鼠研究发现,与牛黄体ATF3表达有所不同的是,虽然PGF处理2 h后也诱导了大鼠黄体组织ATF3的表达,但PGF诱导的大鼠黄体组织ATF3似乎在大、小黄体细胞的核上均有表达。究其原因可能由于牛和大鼠的黄体细胞对PGF的反应性不同,且大鼠和牛黄体组织中大、小黄体细胞的来源和比例不同造成。Nelson等[33]研究发现大鼠黄体组织的大、小黄体细胞数量基本相等,而O'Shea等[34]研究发现牛的大、小黄体细胞的数量之比则高达到1∶8。
同样,PGF诱导的牛大黄体细胞ATF3的表达受到MAPK的调控,因为MAPK通路(ERK1/2、JNK和p38)抑制剂两两联合处理可显著抑制ATF3的表达[6]。尽管MAPK通路(ERK1/2、JNK和p38)抑制剂单独处理牛体外黄体细胞没有引起显著的抑制效应,但PGF处理引起了牛黄体细胞MAPK通路的3个成员的强表达,而体内处理大鼠引起了ERK1/2和JNK的表达,但与ATF3表达的关系还不甚清楚,因为免疫组织化学结果显示ATF3均匀地表达于黄体组织的外周和中心区域,而磷酸化的ERK1/2表达则是从黄体的外周向中心逐渐减弱,这或许是由于检测(处理后30 min的ERK1/2和2 h的ATF3)或因子活性作用的时间点不同,但也进一步提示MAPK通路可能通过作用于其他的下游因子(如Nur77)等发挥溶解黄体的作用。然而,PGF诱导的ATF3在黄体细胞中的作用也有可能通过其它通路,如细胞因子TNFα诱导而参与卵巢黄体的退化过程。
2.3 NR4A1 2.3.1 NR4A1的结构核受体NR4A1(Nuclear rec-eptor subfamily 4,group A,member 1,又称为Nur-77,NGFI-B),属于类固醇/甲状腺素受体超家族的一员,最初在嗜铬细胞瘤细胞和成纤维细胞中,神经生长因子及血清能够快速激活该基因表达。后来的研究发现,在成年啮齿动物的肾上腺、甲状腺、垂体、卵巢等多种器官均有NR4A1的表达。Liu等[35]克隆了猪的NR4A1基因,该基因包含6个外显子和5个内含子,初步研究表明内含子5 的A/G突变与窝产仔数有关,且该基因在猪卵巢、子宫、肾脏和心脏中呈现高表达。
NR4A1是核受体4A家族成员之一。该家族包括3 个成员:NR4A1、NR4A2(Nurr1)和NR4A3(NOR-1)。它们拥有十分相似的基因组结构,均有3个基本的功能结构域:C末端的配体结合域(LBD)(同源性60%)、中间的DNA结合域(DBD)(同源性91%-95%)和N末端的转录激活域(AF-1)(同源性20%-30%)。作为转录因子,它们可作为单体结合到DNA中的NBREs(NGFI-B反应元件:AAAGGTCA)上,也可以以同二聚体的形式结合到NurRE(Nur 反应元件)(TGATATTTX6AAATGCCA)上。而Nur77和Nurr1(但不是NOR-1)可以与RXR结合以异二聚体的形式结合到DR5元件(GG-TTCAX5AGGTCA)调节维甲酸信号通路。已有报道,Nur77可以结合并激活NBRE和NurRE序列报告基因的转录,而不需要额外信号输入。由于NR4A蛋白没有已知的配体,故被归类为孤儿受体,并且现在有很多证据表明,它们参与生理功能并不需要配体的结合,是真正的孤儿受体。Nur77的配体结合结构域的功能目前还不清楚,但可能涉及二聚化或辅因子的募集。由于NR4A核受体家族并不依赖于配体发挥作用,故体内NR4A转录或翻译后修饰等受到控制是可能存在的。例如,磷酸化ERK1/2会影响Nur77的定位,而在Nur77中丝氨酸Ser350的磷酸化则会抑制Nur77的转录活性。
2.3.2 NR4A1的生物学功能作为早期反应基因,NR4A1具有对细胞环境感知和迅速反应的能力,其表达可被寒冷、生长因子、钙离子、细胞因子、肽类激素、脂肪酸、神经递质及物理刺激等快速诱导,与炎症反应、动脉粥样硬化、糖脂代谢、类固醇生成及细胞凋亡等密切相关[36, 37, 38, 39, 40]。在类似的刺激下,Nurr1和NOR-1的转录也可以像Nur77一样上调。NR4A1作为关键的转录因子对性腺甾体激素生成酶基因具有重要的调控作用。NR4A1可以激活睾丸间质细胞相关基因,如人HSD3B2、大鼠Cyp17及小鼠Star基因等雄激素合成基因表达[41],从而促进雄激素的合成;抑制人卵巢颗粒细胞芳香化酶基因CYP19A1的转录[42],导致雌激素合成下降;刺激人排卵时颗粒细胞HSD3B2转录,导致孕酮的合成增加[43];刺激小鼠卵泡膜细胞Star、Cyp11a1、Cyp17和Hsd3b2的表达,促进睾酮的分泌[44]。NR4A1作为早期反应基因,还参与细胞的有丝分裂过程,在细胞存活和凋亡中亦发挥重要作用。已经证实NR4A1是一种前存活蛋白(pro-survival),但NR4A1也可引起细胞的凋亡。产生这两种后果的原因是或激活存活和凋亡基因,或越位至细胞质,作用于线粒体,与Bcl-2结合引起凋亡[45]。因此,NR4A1控制癌细胞的存活决定于其亚细胞定位。NR4A家族定位在细胞核中发挥转录活性,定位于线粒体中可以通过更直接的机制诱导凋亡[46]。
2.3.3 NR4A1在黄体中的表达研究发现人和大鼠卵巢卵泡和黄体中均有NR4A1的表达[43]。大鼠卵巢NR4A1主要表达于卵泡膜细胞和黄体细胞的胞质中,且成熟卵泡表达量高于生长卵泡,新鲜黄体细胞表达量最高,提示核受体NR4A1与卵泡的发育、成熟、闭锁、黄体的萎缩相关。亦有研究表明,卵巢黄体NR4A1可被PGF诱导上调。Atli等[26]利用PGF重复处理母牛研究相关基因的表达模式,结果PGF重复处理4次后的黄体组织NR4A1上调16倍之多,PGF处理2次黄体退化者的则上调16倍左右,而处理2 次黄体未退化者则上调7倍。Stocco 等[47]利用PGF处理妊娠末期大鼠,结果诱导了NR4A1表达,促进了大鼠20α类固醇脱氢酶的转录,进而使孕酮代谢为20α二氢孕酮。进一步研究发现,NR4A1作用于大鼠黄体细胞20α-HSD启动子上游-1599/-1606处。同样,Sudeshna等[48]对水牛的实验表明,PGF2α处理诱导了NR4A1的表达,但并没有引起20α类固醇脱氢酶表达的上调,推测NR4A1可能通过引起细胞凋亡而促进水牛黄体的结构性退化。
3 总结雌性动物的繁殖机能受到环境、营养和遗传等因素的影响,这些因素从不同角度影响机体的内分泌,从而对卵巢黄体的形成、发育和退化产生影响。黄体的存留对母畜生殖活动的调控具有重要的作用,黄体退化需要一系列细胞信号级联事件应对黄体功能和形态的改变。而早期反应基因是联系细胞生化改变与细胞最终对刺激发生特异性反应的中介物,其不仅参与细胞的正常生长、分化过程,而且也参与细胞内信息传递过程和细胞的能量代谢过程,因此在母畜卵巢黄体退化过程中起着极为重要的作用。研究早期反应基因的功能有助于揭示黄体退化的分子机制,深入了解母畜性腺机能的调控机理,对提高母畜繁殖力,促进可持续发展具有重要意义。
| [1] | Davis JS, Rueda BR. The corpus luteum:an ovarian structure with maternal instincts and suicidal tendencies[J]. Front Biosci, 2002, 7:1949-1978. |
| [2] | McCracken JA, Glew ME, Scaramuzzi RJ. Corpus luteum regression induced by prostagland in F2-alpha[J]. J Clin Endocrinol Metab, 1970, 30(4):544-546. |
| [3] | Stocco C, Telleria C, Gibori G. The molecular control of corpus luteum formation, function, and regression[J]. Endocr Rev, 2007, 28(1):117-149. |
| [4] | Mondal M, Schilling B, Folger J, et al. Deciphering the luteal transcriptome:potential mechanisms mediating stage-specific luteolytic response of the corpus luteum to prostaglandin F(2)alpha[J]. Physiol Genomics, 2011, 43(8):447-456. |
| [5] | Pate JL, Johnson-Larson CJ, Ottobre JS. Life or death decisions in the corpus luteum[J]. Reprod Domest Anim, 2012, 47(Suppl.4):297-303. |
| [6] | Mao D, Hou X, Talbott H, et al. ATF3 expression in the corpus luteum:possible role in luteal regression[J]. Mol Endocrinol, 2013, 27(12):2066-2079. |
| [7] | Talbott H, Delaney A, Zhang P, et al. Effects of IL8 and immune cells on the regulation of luteal progesterone secretion[J]. Reproduction, 2014, 148(1):21-31. |
| [8] | Przygrodzka E, Witek KJ, Kaczmarek MM, et al. Expression of factors associated with apoptosis in the porcine corpus luteum throughout the luteal phase of the estrous cycle and early pregnancy:their possible involvement in acquisition of luteolytic sensitivity[J]. Theriogenology, 2015, 83(4):535-545. |
| [9] | Hasumoto K, Sugimoto Y, Yamasaki A, et al. Association of expression of mRNA encoding the PGF2 alpha receptor with luteal cell apoptosis in ovaries of pseudopregnant mice[J]. J Reprod Fertil, 1997, 109(1):45-51. |
| [10] | Rao CV, Estergreen VL, Carman FR Jr, et al. Receptors for gonadotrophin and prostaglandin F2 alpha in bovine corpora lutea of early, mid and late luteal phase[J]. Acta Endocrinol(Copenh), 1979, 91(3):529-537. |
| [11] | De Rensis F, Saleri R, Tummaruk P, et al. Prostaglandin F2alpha and control of reproduction in female swine:a review[J]. Theriogenology, 2012, 77(1):1-11. |
| [12] | Sakamoto K, Ishii Y, Onodera T, et al. Cloning and characterization of the novel isoforms for PGF2 alpha receptor in the bovine corpus luteum[J]. DNA Seq, 2002, 5:307-311. |
| [13] | Shirasuna K, Akabane Y, Beindorff N, et al. Expression of prostaglandin F2alpha(PGF2alpha)receptor and its isoforms in the bovine corpus luteum during the estrous cycle and PGF2alpha-induced luteolysis[J]. Domest Anim Endocrinol, 2012, 43(3):227-238. |
| [14] | Shirasuna K, Watanabe S, Asahi T, et al. Prostaglandin F2alpha increases endothelial nitric oxide synthase in the periphery of the bovine corpus luteum:the possible regulation of blood flow at an early stage of luteolysis[J]. Reproduction, 2008, 135(4):527-539. |
| [15] | Liptak AR, Sullivan BT, Henkes LE, et al. Cooperative expression of monocyte chemoattractant protein 1 within the bovine corpus luteum:evidence of immune cell-endothelial cell interactions in a coculture system[J]. Biol Reprod, 2005, 72(5):1169-1176. |
| [16] | Davis JS, Rueda BR, Spanel-Borowski K. Microvascular endothelial cells of the corpus luteum[J]. Reprod Biol Endocrinol, 2003, 1:89. |
| [17] | Yadav VK, Medhamurthy R. Dynamic changes in mitogen-activated protein kinase(MAPK)activities in the corpus luteum of the bonnet monkey(Macaca radiata)during development, induced luteolysis, and simulated early pregnancy:a role for p38 MAPK in the regulation of luteal function[J]. Endocrinology, 2006, 147(4):2018-2027. |
| [18] | Hou X, Arvisais EW, Jiang C, et al. Prostaglandin F2alpha stimulates the expression and secretion of transforming growth factor B1 via induction of the early growth response 1 gene(EGR1)in the bovine corpus luteum[J]. Mol Endocrinol, 2008, 22(2):403-414. |
| [19] | Guo N, Meng C, Bai W, et al. Prostaglandin F2alpha induces expression of activating transcription factor 3(ATF3)and activates MAPK signaling in the rat corpus luteum[J]. Acta Histochem, 2015, 117(2):211-218. |
| [20] | Taniguchi K, Matsuoka A, Kizuka F, et al. Prostaglandin F2alpha(PGF2alpha)stimulates PTGS2 expression and PGF2alpha synthesis through NFKB activation via reactive oxygen species in the corpus luteum of pseudopregnant rats[J]. Reproduction, 2010, 140(6):885-892. |
| [21] | Arvisais E, Hou X, Wyatt TA, et al. Prostaglandin F2alpha represses IGF-I-stimulated IRS1/phosphatidylinositol-3-kinase/AKT signaling in the corpus luteum:role of ERK and P70 ribosomal S6 kinase[J]. Mol Endocrinol, 2010, 3:632-643. |
| [22] | Skarzynski DJ, Okuda K. Inter- and intra-cellular mechanisms of prostaglandin F2alpha action during corpus luteum regression in cattle[J]. Soc Reprod Fertil Suppl, 2010, 67:305-324. |
| [23] | Poirier R, Cheval H, Mailhes C, et al. Distinct functions of egr gene family members in cognitive processes[J]. Front Neurosci, 2008, 2(1):47-55. |
| [24] | Ogishima T, Shiina H, Breault JE, et al. Increased heparanase expression is caused by promoter hypomethylation and up-regulation of transcriptional factor early growth response-1 in human prostate cancer[J]. Clin Cancer Res, 2005, 11(3):1028-1036. |
| [25] | Sayasith K, Brown KA, Lussier JG, et al. Characterization of bovine early growth response factor-1 and its gonadotropin-dependent regulation in ovarian follicles prior to ovulation[J]. J Mol Endocrinol, 2006, 37(2):239-250. |
| [26] | Atli MO, Bender RW, Mehta V, et al. Patterns of gene expression in the bovine corpus luteum following repeated intrauterine infusions of low doses of prostaglandin F2alpha[J]. Biol Reprod, 2012, 86(4):130. |
| [27] | Hai TW, Liu F, Coukos WJ, et al. Transcription factor ATF cDNA clones:an extensive family of leucine zipper proteins able to selectively form DNA-binding heterodimers[J]. Genes Dev, 1989, 3(12B):2083-2090. |
| [28] | Miyazaki K, Inoue S, Yamada K, et al. Differential usage of alternate promoters of the human stress response gene ATF3 in stress response and cancer cells[J]. Nucleic Acids Res, 2009, 37(5):1438-1451. |
| [29] | Thompson MR, Xu D, Williams BR. ATF3 transcription factor and its emerging roles in immunity and cancer[J]. J Mol Med(Berl), 2009, 87(11):1053-1060. |
| [30] | Green TA, Alibhai IN, Unterberg S, et al. Induction of activating transcription factors(ATFs)ATF2, ATF3, and ATF4 in the nucleus accumbens and their regulation of emotional behavior[J]. J Neur-osci, 2008, 28(9):2025-2032. |
| [31] | Hai T, Wolford CC, Chang YS. ATF3, a hub of the cellular adaptive-response network, in the pathogenesis of diseases:is modulation of inflammation a unifying component?[J]. Gene Expr, 2010, 15(1):1-11. |
| [32] | Lu D, Chen J, Hai T. The regulation of ATF3 gene expression by mitogen-activated protein kinases[J]. Biochem J, 2007, 401(2):559-567. |
| [33] | Nelson SE, McLean MP, Jayatilak PG, et al. Isolation, characteriza-tion, and culture of cell subpopulations forming the pregnant rat corpus luteum[J]. Endocrinology, 1992, 130(2):954-966. |
| [34] | O’Shea JD, Rodgers RJ, D’Occhio MJ. Cellular composition of the cyclic corpus luteum of the cow[J]. J Reprod Fertil, 1989, 85(2):483-487. |
| [35] | Liu LQ, Li FE, Deng CY, et al. Molecular cloning, tissue expression and association of porcine NR4A1 gene with reproductive traits[J]. Mol Biol Rep, 2011, 38(1):103-114. |
| [36] | Maxwell MA, Muscat GE. The NR4A subgroup:immediate early response genes with pleiotropic physiological roles[J]. Nucl Recept Signal, 2006, 4:e002. |
| [37] | Hamers AA, Hanna RN, Nowyhed H, et al. NR4A nuclear receptors in immunity and atherosclerosis[J]. Curr Opin Lipidol, 2013, 24(5):381-385. |
| [38] | Close AF, Rouillard C, Buteau J. NR4A orphan nuclear receptors in glucose homeostasis:a minireview[J]. Diabetes Metab, 2013, 39(6):478-484. |
| [39] | Dai A, Yan G, He Q, et al. Orphan nuclear receptor Nur77 regulates androgen receptor gene expression in mouse ovary[J]. PLoS One, 2012, 7(6):e39950. |
| [40] | Chang LF, Lin PC, Ho LI, et al. Overexpression of the orphan receptor Nur77 and its translocation induced by PCH4 may inhibit malignant glioma cell growth and induce cell apoptosis[J]. J Surg Oncol, 2011, 103(5):442-450. |
| [41] | Martin LJ, Boucher N, Brousseau C, et al. The orphan nuclear receptor NUR77 regulates hormone-induced StAR transcription in Leydig cells through cooperation with Ca2+/calmodulin-dependent protein kinase I[J]. Mol Endocrinol, 2008, 9:2021-2037. |
| [42] | Wu Y, Ghosh S, Nishi Y, et al. The orphan nuclear receptors NURR1 and NGFI-B modulate aromatase gene expression in ovarian granulosa cells:a possible mechanism for repression of aromatase expression upon luteinizing hormone surge[J]. Endocrinology, 2005, 146(1):237-246. |
| [43] | Havelock JC, Smith AL, Seely JB, et al. The NGFI-B family of transcription factors regulates expression of 3beta-hydroxysteroid dehydrogenase type 2 in the human ovary[J]. Mol Hum Reprod, 2005, 11(2):79-85. |
| [44] | Li M, Xue K, Ling J, et al. The orphan nuclear receptor NR4A1 regulates transcription of key steroidogenic enzymes in ovarian theca cells[J]. Mol Cell Endocrinol, 2010, 319(1-2):39-46. |
| [45] | Li QX, Ke N, Sundaram R, et al. NR4A1, 2, 3-an orphan nuclear hormone receptor family involved in cell apoptosis and carcinogenesis[J]. Histol Histopathol, 2006, 21(5):533-540. |
| [46] | Boldingh Debernard KA, Mathisen GH, Paulsen RE. Differences in NGFI-B, Nurr1, and NOR-1 expression and nucleocytoplasmic translocation in glutamate-treated neurons[J]. Neurochem Int, 2012, 61(1):79-88. |
| [47] | Stocco CO, Zhong L, Sugimoto Y, et al. Prostaglandin F2alpha-induced expression of 20alpha-hydroxysteroid dehydrogenase involves the transcription factor NUR77[J]. J Biol Chem, 2000, 275(47):37202-37211. |
| [48] | Sudeshna T, Anand K, Medhamurthy R. Analysis of 20alpha-hydroxysteroid dehydrogenase expression in the corpus luteum of the buffalo cow:effect of prostaglandin F2-alpha treatment on circulating 20alpha-hydroxyprogesterone levels[J]. Reprod Biol Endocrinol, 2013, 11:111. |



