2. 湖北医药学院生物医学工程学院,十堰 442000
2. College of Biomedical Engineering,Hubei University of Medicine,Shiyan 442000
趋化因子受体4(Chemokine receptor 4,CXC-R4)属于高度保守的7次跨膜G蛋白偶联受体(G protein-coupled receptor,GPCR),主要参与信号转导[1]。趋化因子可影响肿瘤的生长、诱导血管生成、使肿瘤逃避免疫系统的监视,从而在肿瘤的发生发展中发挥重要作用[2]。研究表明,CXCR4与肝癌细胞生长、迁移和侵袭密切相关[3]。转录激活样效应物核酸酶(TALEN)可对细胞的基因组进行改造影响蛋白的表达,目前运用此技术介导的靶位点的基因敲除已经成为一种新型基因打靶工具[4]。此技术操作简单、对细胞使用要求不高,适用于大多数物种及各种体外培养细胞的基因改造[5]。本研究将应用TALEN 技术建立CXCR4基因敲除的HepG2细胞系,以期研究CXCR4对肝癌的影响。
1 材料与方法 1.1 材料TALEN试剂盒(斯丹塞生物技术有限公司);DMEM,Opti-MEM(Gibco);胎牛血清(四季青);T7E1酶(NEB公司);CXCR4抗体(Abcam);DA-PI,碱性磷酸酶标记的鼠抗兔二抗(碧云天生物技术有限公司)。
1.2 方法 1.2.1 细胞培养人肝癌细胞系HepG2在含10%胎牛血清,100 U/mL的青霉素、链霉素的高糖细胞培养基DMEM中37℃,5% CO2培养箱中培养。隔天换液,保持细胞生长状态良好,每次实验使用处于对数生长期的细胞。
1.2.2 TALEN质粒的构建及打靶根据CXCR4基因序列设计打靶位点,TALEN试剂盒说明书构建CXCR4 TALEN质粒。将10 μg CXCR4 TALEN质粒(左右臂质粒各5 μg)与90 μL含1×106 HepG2细胞的Opti-MEM混合,150 V电击5 s后将细胞转移至六孔板中37℃培养,并以3 μg/mL嘌呤霉素筛选3 d,按同样的方法进行二次打靶。
1.2.3 T7E1酶切根据CXCR4缺失型两端的序列设计PCR引物,CXCR4上游引:5'-GCCCTTAGCC-CACTACTTC-3',下游引物:5'-GCGGTCCAGACTG-ATGAA-3'。PCR反应条件为:95℃ 5 min;95℃ 10 s,56℃ 30 s,72℃ 1 min,30个循环,72℃延长10 min。PCR产物37℃ T7E1酶切30 min后琼脂糖凝胶电泳。检测打靶效率时打靶细胞基因组PCR产物直接T7E1酶切,挑选阳性克隆时野生型与打靶细胞PCR产物经变性退火后再进行T7E1酶切。
1.2.4 挑细胞单克隆测序在96孔板内加入200 μL含10% FBS的DMEM,在显微镜下用移液枪吸取单个细胞接种在96孔板内。每孔接种1个细胞,置于37℃,5% CO2培养箱中培养。观察克隆生长情况并标记单细胞的孔。细胞长满后传入24孔板继续培养,提取基因组PCR扩增T7E1酶切鉴定,阳性克隆目的片段PCR产物连入T载体并测序。
1.2.5 细胞免疫荧光细胞经固定液固定30 min后,PBS洗3遍加入1%牛血清白蛋白封闭1 h,再加入按1∶100稀释的兔抗人CXCR4,混匀后37℃ 孵育1 h,孵育结束后PBS洗3次,加入按1∶100稀释的Cyc3标记的山羊抗兔IgG,混匀后37℃孵育1 h,PBS洗3次,用5 μg/mL DAPI染色2 min,加入抗淬灭封片剂封片后荧光显微镜下观察。
1.2.6 Western blot细胞提取总蛋白,SDS-PAGE蛋白电泳后转移到PVDF膜。后用5%脱脂奶粉在室温下封闭1 h,37℃孵育兔抗人CXCR4一抗1 h。用TBST洗3次后,加入碱性磷酸酶标记的鼠抗兔二抗孵育1 h,TBST洗3次后用AP底物显色。通过凝胶成像系统成像(Bio-Rad)照像。
1.2.7 统计学分析实验计量数据以x±s表示,两组间差异采用t检验,多组间均数差异采用单因素方差分析,采用SPSS18.0统计软件进行分析,P<0.05为差异有统计学意义。
2 结果 2.1 TALEN载体的构建根据NCBI中CXCR4的基因序列和TALEN试剂盒设计要求,设计TALEN打靶左右臂的序列如图 1所示。按试剂盒的说明经测序证明,成功构建了CXCR4打靶的TALEN质粒。
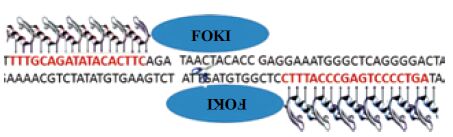
|
| 图 1 CXCR4 基因TALENs 打靶位点示意图 |
TALEN打靶后的细胞和野生型的细胞提取基因组,经PCR扩增电泳检测,结果(图 2-A)显示,理论PCR产物大小为526 bp,电泳结果与理论相符。打靶细胞提取基因组的PCR产物经T7E1酶切,通过琼脂糖凝胶电泳检测结果(图 2-B)显示,理论打靶酶切后得到的产物大小为150 bp和370 bp左右的两条带,电泳结果与理论相符,并经灰度分析打靶效率约为40%。结果表明构建的打靶CXCR4的TALEN质粒可成功打靶CXCR4基因。
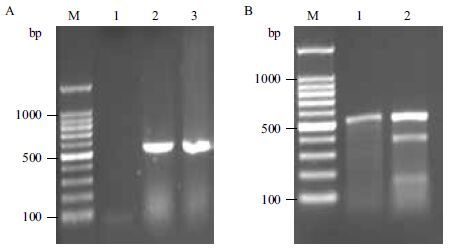
|
| A :提取基因组PCR 扩增CXCR4 产物:M :100 bp DNA ladder ;1 :H2O ;2 :野生型CXCR4 ;3 :打靶CXCR4 ;B :PCR 产物T7E1 酶切鉴定:M :100bp DNA ladder ;1 :野生型CXCR4 ;2 :打靶CXCR4 图 2 T7E1 酶切检测打靶效率 |
单克隆细胞提取基因组后PCR的产物与野生型PCR产物混合变性退火,T7E1酶切。经鉴定为阳性的克隆PCR产物连入T载体,每个单克隆细胞挑取10个进行测序。测序结果(图 3-A)显示,与野生型CXCR4基因序列通过NCBI Blast比对,不同克隆碱基缺失和插入情况均不相同。一共挑取了24个单克隆,通过分析发现21号单克隆有3条链突变,如图 3-B所示。

|
| A :CXCR4 基因打靶测序结果(破折号- 位点处丢失,红色字体- 插入的碱基);B :21 号克隆基因测序结果 图 3 打靶单克隆细胞提基因组测序结果 |
免疫荧光检测细胞中CXCR4基因的表达,结果(图 4-A)显示,CXCR4敲除的细胞株荧光强度明显比野生型弱。Western blot检测的结果(图 4-B)显示,敲除细胞CXCR4蛋白表达量与野生型相比有显著差异(P<0.01)。
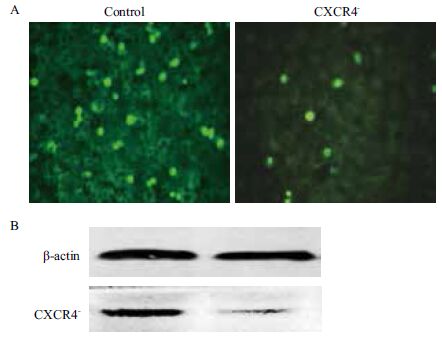
|
| A :免疫荧光检测CXCR4 蛋白表达;B :Western blot 检测CXCR4 蛋白表达 图 4 CXCR4 敲除细胞株中CXCR4 蛋白的表达情况 |
肝癌是最常见的原发性肝脏肿瘤,也是全球最常见的恶性肿瘤之一[6]。肝癌的早期症状通常不明显,许多患者在晚期才被确诊,因此治疗效果不理想。为了寻找有效的治疗途径阐明肝癌发展的机制和识别早期疾病生物标志物是非常必要的。趋化因子CXCR4在正常组织中表达基本一致,但在许多实体肿瘤中表达异常[7, 8]。对CXCR4基因的异常表达可以作为部分疾病预后指标,如结直肠癌[9, 10]、神经胶质瘤[11]、乳腺癌[12, 13]、胃癌[14]、肺癌[15]以及白血病[16]等。研究证明,CXCR4与其受体参与肝癌的发生和转移,但其具体的作用机制仍不太清楚[17]。目前已有报道采用干扰RNA使CXCR4基因沉默来研究其对肿瘤增殖,迁移等方面的影响[18]。然而,干扰RNA只能短时间内使基因沉默,限制了其对肿瘤的长期发生发展方面的研究。TALEN基因打靶技术可快速敲除基因,并建立稳定的基因敲除细胞系,有利于深入研究基因的功能。目前,很少有报道研究TALEN介导的CXCR4基因敲除对肝癌细胞的影响。为了进一步深入研究CXCR4对肝癌细胞的影响,本研究利用TALEN打靶CXCR4,通过挑取单克隆测序最终成功获得了稳定下调CXCR4基因表达的细胞株,并通过免疫荧光和Western blot 进一步证实了敲除后CXCR4蛋白表达显著低于野生型,为进一步研究CXCR4对肝癌增殖、集落形成和迁移等方面的影响奠定基础。
4 结论本研究利用TALEN打靶技术成功建立了稳定下调CXCR4基因表达的HepG2细胞株。
| [1] | Tan XY, Chang S, Liu W, et al. Silencing of CXCR4 inhibits tumor cell proliferation and neural invasion in human hilar cholangiocarcinoma[J]. Gut Liver, 2014, 8(2):196-204. |
| [2] | Hattermann K, Holzenburg E, Hans F, et al. Effects of the chemokine CXCL12 and combined internalization of its receptors CXCR4 and CXCR7 in human MCF-7 breast cancer cell[J]. Cell Tissue Res, 2014, 357(1):253-266. |
| [3] | Ghanem I, Riveiro ME, Paradis V, et al. Insights on the CXCL12-CXCR4 axis in hepatocellular carcinoma carcinogenesis[J]. Am J Transl Res, 2014, 6(4):340-352. |
| [4] | Sun N, Zhao H. Transcription activator-like effector nucleases(TALENs):a highly efficient and versatile tool for genome editing[J]. Biotechnol Bioeng, 2013, 110(7):1811-1821. |
| [5] | Cermak T, Doyle EL, Christian M, et al. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting[J]. Nucleic Acids Res, 2011, 39(12):e82. |
| [6] | Shinoda M, Kishida N, Itano O, et al. Long-term complete response of advanced hepatocellular carcinoma treated with multidisciplinary therapy including reduced dose of sorafenib:case report and review of the literature[J]. World J Surg Oncol, 2015, 13:144. |
| [7] | Zlotnik, A. Chemokines and cancer[J]. Int J Cancer, 2006, 119 |
| [8] | Homey B, Müller A, Zlotnik A. Chemokines:agents for the immunotherapy of cancer?[J]. Nat Rev Immunol, 2002, 2(3):175-184. |
| [9] | Kim J, Takeuchi H, Lam ST, et al. Chemokine receptor CXCR4 expression in colorectal cancer patients increases the risk for recurrence and for poor survival[J]. J Clin Oncol, 2005, 23(12):2744-2753. |
| [10] | Gao Y, Li C, Nie M, et al. CXCR4 as a novel predictive biomarker for metastasis and poor prognosis in colorectal cancer[J]. Tumour Biol, 2014, 35(5):4171-4175. |
| [11] | Zhu Y, Yang P, Wang Q, et al. The effect of CXCR4 silencing on epithelial-mesenchymal transition related genes in glioma U87 cells[J]. Anat Rec(Hoboken), 2013, 296(12):1850-1856. |
| [12] | Liang Z, Bian X, Shim H. Inhibition of breast cancer metastasis with microRNA-302a by downregulation of CXCR4 expression[J]. Breast Cancer Res Treat, 2014, 146(3):535-542. |
| [13] | Hiller DJ, Li BD, Chu QD. CXCR4 as a predictive marker for locally advanced breast cancer post-neoadjuvant therapy[J]. J Surg Res, 2011, 166(1):14-18. |
| [14] | Xie L, Wei J, Qian X, et al. CXCR4, a potential predictive marker for docetaxel sensitivity in gastric cancer[J]. Anticancer Res, 2010, 30(6):2209-2216. |
| [15] | Paratore S, Banna GL, D’Arrigo M, et al. CXCR4 and CXCL12 immunoreactivities differentiate primary non-small-cell lung cancer with or without brain metastases[J]. Cancer Biomark, 2011, 10 |
| [16] | Paratore S, Banna GL, D’Arrigo M, et al. CXCR4 is a prognostic marker in acute myelogenous leukemia[J]. Blood, 2007, 109(2):786-791. |
| [17] | Xiang ZL, Zeng ZC, Tang ZY, et al. Chemokine receptor CXCR4 expression in hepatocellular carcinoma patients increases the risk of bone metastases and poor survival[J]. BMC Cancer, 2009, 9:176. |
| [18] | Wang L, Huang T, Chen W, et al. Silencing of CXCR4 by RNA interference inhibits cell growth and metastasis in human renal cancer cells[J]. Oncol Rep, 2012, 28(6):2043-2048. |




