2. 云南农业大学 动物科学技术学院,昆明 650201 ;
3. 云南农业大学 招生就业处,昆明 650201
2. Faculty of Animal Science and Technology,Yunnan Agricultural University,Kunming 650201 ;
3. Admission and Employment Office,Yunnan Agricultural University, Kunming 650201
腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)在真核生物中是一个重要的蛋白激酶,可加速脂肪酸氧化、葡萄糖转运和糖酵解分解代谢途径,同时能抑制糖异生、脂肪酸和胆固醇合成、蛋白质合成等合成途径,以降低能量消耗,维持机体能量代谢平衡[1]。Leptin介导的AMPK信号通路在脂肪代谢的调节中起主要作用,能促进脂肪酸的氧化,减少脂肪沉积。本研究以体外培养的猪皮下前脂肪细胞为研究对象,用100 ng/mL Leptin处理48 h观察Leptin对前脂肪细胞的影响。以油红O染色观察前脂肪细胞中脂滴的形成,从mRNA水平来研究Leptin对AMPK通路中各基因表达的影响,并通过检测细胞中甘油三酯和游离脂肪酸的含量,阐明Leptin对脂类代谢的影响,为深入开展AMPK信号通路对脂肪代谢调节的信号转导机制的研究提供参考。
1 材料与方法 1.1 材料 1.1.1 实验动物及分组取一头15 kg仔猪的皮下脂肪组织,分离皮下前脂肪细胞,进行体外细胞培养,Leptin组和对照组均为6个重复。仔猪购自云南农业大学实验猪场。
1.1.2 主要试剂Trizol购自天根公司;反转录试剂盒购自北京全式金公司;SYBR ® Premix Ex TaqTM购自大连宝生物;甘油三酯试剂盒购自北京北化康泰临床试剂有限公司;游离脂肪酸试剂盒购自南京建成科技有限公司。
1.2 方法 1.2.1 猪前体脂肪细胞培养无菌条件下切取15日龄仔猪背部皮下脂肪组织,PBS缓冲液冲洗3次,分离去除脂肪组织中可见的纤维及血管,剪碎后加入1 mg/mL 的Ⅰ型胶原酶消化液,置37℃振荡摇床内震荡消化1 h,用不锈钢细胞筛过滤(200目),滤液以1 500 r/min离心10 min,弃上清,沉淀物用无血清培养液重悬,再次过滤离心10 min,弃上清,沉积的细胞团块用基础培养液制成细胞悬液,细胞以5.0×104个/cm2密度接种至培养板内,置于37℃,饱和湿度,5% CO2培养箱内培养,1 d后换液,此后每2 d换液一次。
1.2.2 猪皮下前脂肪细胞的诱导分化待猪原代皮下脂肪细胞汇合度达60%时,更换培养液为以10 mg/L胰岛素、0.25 µmol/L地塞米松和0.5 mmol/L 1-甲基3-异丁基黄嘌呤的分化培养液,分别在分化培养液中添加0和100 ng/mL Leptin 处理48 h(其中0 ng/mL为对照组),一部分细胞用于油红O染色鉴定,一部分细胞用于甘油三酯和游离脂肪酸含量测定,其余细胞用于提取总RNA。
1.2.3 油红O染色 诱导分化2 d后的细胞,取出培养板,弃培养液,用PBS冲洗3次,10%甲醛固定30 min,PBS漂洗3次后,油红O工作液染色40 min,移去染色液,PBS漂洗3次,镜检。
1.2.4 甘油三酯的测定用甘油三酯试剂盒(北京北化康泰临床试剂有限公司)测定皮下脂肪细胞中的甘油三酯浓度,操作方法按照试剂盒说明书执行。
1.2.5 脂肪酸含量的测定用游离脂肪酸测试盒说明书(NEFA)(南京建成科技有限公司)测定皮下脂肪细胞中游离脂肪酸含量,操作方法按照试剂盒说明书执行。
1.2.6 总RNA提取收集对照组和100 ng/mL Leptin处理48 h后的脂肪细胞,采用Trizol-A+ Reagent提取总RNA,并用琼脂糖凝胶电泳检测其完整性,通过OD260 nm/OD280 nm 测定其浓度。
1.2.7 Real-timePCR反应及条件 根据所测定的浓度,各取2 µg总RNA进行反转录,使用EasyScript First-Strand cDNA Synthesis SuperMix(北京全式金生物技术有限公司)进行反转录,反应体系为20 μL,其中含有10 μL 2×ES Reaction Mix、1 μL EasyScript RT/RI Enzyme Mix、1 μL Anchored Oligo(dT),加入Rnase-free Water至20 μL。将这20 μL混合物42℃孵育30 min,85℃加热5 min失活,EasyScript RT反转录后的cDNA单链可于-20℃中保存。
目的基因:瘦素受体(Leptin receptor,lepR),肝激酶B1(liver kinase B1,LKB1),腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK),乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC),肉碱棕榈酰转移酶-1(carnitine palmitoyltransferase-1,CPT-1)和内参基因18S rRNA的引物使用Primer 5软件设计,由上海生物工程有限公司合成。基因登录号及引物序列见表 1。
Real-time PCR反应体系(20 µL)为:1.5 µL反转录产物,10 µL SYBR Green,10 mmol/L的上下游引物各0.4 µL,加ddH2O至20 µL。每个重复做2个平行,同时用ddH2O代替RT产物和荧光试剂作空白对照,以检验是否有外源基因和基因组DNA 污染。
1.2.8 数据分析采用SAS9.0和Excel2003软件对实验数据进行统计分析,所有数据表示为平均值±标准差(x±s),并对平均值进行方差分析,作显著性检验(P<0.05)。
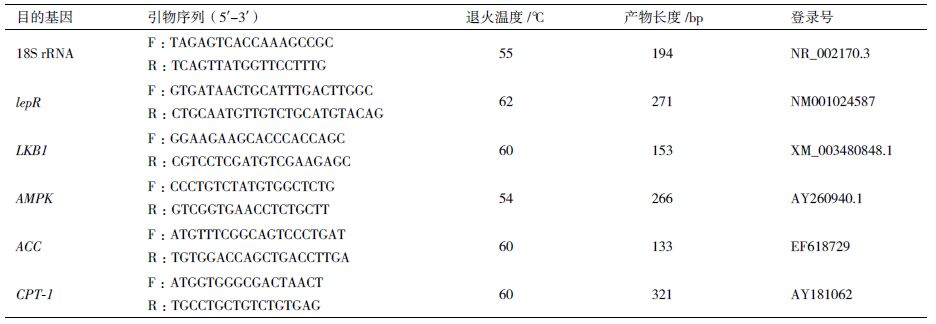
2 结果 2.1 Leptin对前脂肪细胞形态变化的影响观察猪皮下前体脂肪细胞的诱导分化结果发现,不同浓度的Leptin对前脂肪细胞形态变化无明显影响。处理48 h后,可见部分细胞开始分化,细胞内可见少量球形脂滴。油红O染色结果(图 1)显示,Leptin组比对照组着色细胞数多。
|
| A :对照组油红O 染色的猪脂肪细胞;B :添加100 ng/mL Leptin 油红O 染色图 图 1 皮下前脂肪细胞油红O 染色(200×) |
Leptin对猪前脂肪细胞甘油三酯和游离脂肪酸合成影响的结果(表 2)显示,Leptin组中甘油三酯含量显著低于对照组(P<0.05);Leptin组中游离脂肪酸含量低于对照组,但没有达到显著水平(P>0.05)。
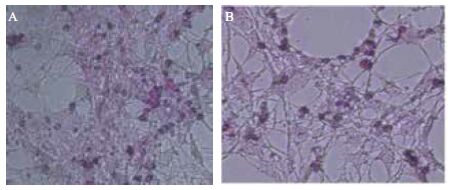
皮下前脂肪细胞中,Leptin介导AMPK信号通路中各基因相对表达水平结果(图 2)显示,Leptin组lepR(图 2-A)、AMPK(图 2-B)和CPT-1(图 2-C)基因相对表达量显著高于对照组(P<0.05),Leptin组中LKB1(图 2-D)基因相对表达量高于对照组,但没有达到显著水平(P>0.05)(图 2-D),Leptin组中ACC(图 2-E)基因相对表达量显著低于对照组(图 2-E,P<0.05)。
|
| A :LepR 基因相对表达量;B :AMPK 基因相对表达量;C :CPT-1 基因相对表达量;D :LKB1 基因相对表达量;E :ACC 基因相对表达量;不同字母表示差异显著(P<0.05) 图 2 Leptin 介导AMPK 信号通路中基因的相对表达水平 |
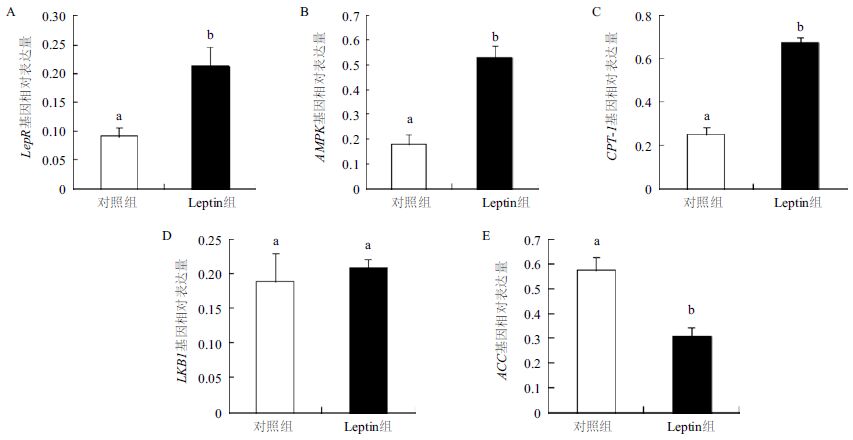
皮下前脂肪细胞中,Leptin介导的AMPK信号通路中各基因相对表达量与甘油三酯含量相关性结果显示,lepR(图 3-A)、AMPK(图 3-B)和 CPT-1(图 3-C)基因的mRNA的表达水平与甘油三酯含量之间存在负相关且达到显著水平(P<0.05),LKB1(图 3-D)基因的mRNA的表达水平与甘油三酯含量之间存在负相关但没有达到显著水平(图 3-D,P>0.05),ACC(图 3-E)基因的mRNA的表达水平与甘油三酯含量之间存在正相关且达到显著水平(图 3-E,P<0.05)。
|
| A :lepR 基因表达量与甘油三酯含量相关性;B :AMPK 基因表达量与甘油三酯含量相关性;C :CPT-1 基因表达量与甘油三酯含量相关性;D :LKB1 基因表达量与甘油三酯含量相关性;E :ACC 基因表达量与甘油三酯含量相关性 图 3 AMPK 信号通路中基因表达量与甘油三酯含量相关性 |
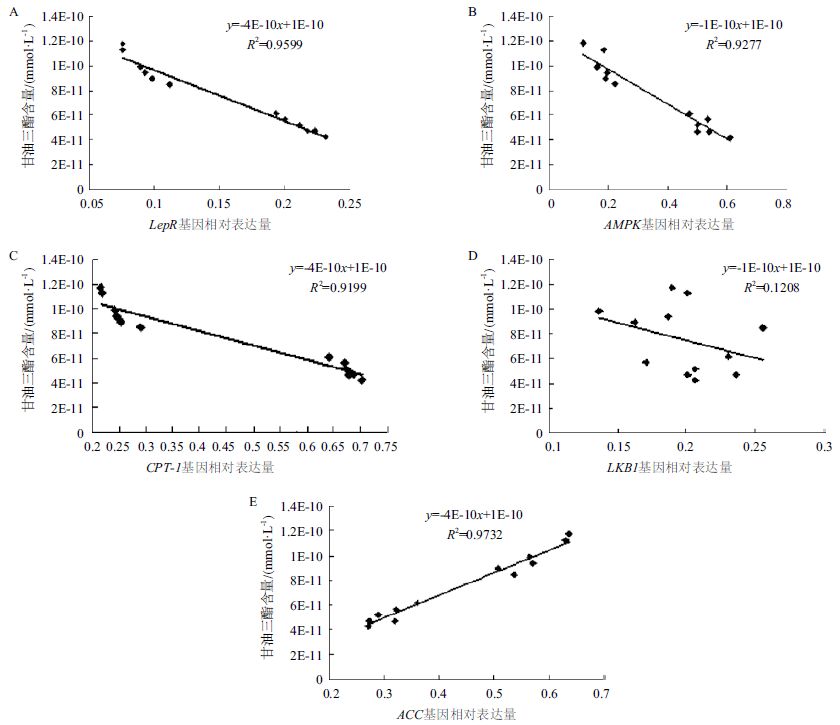
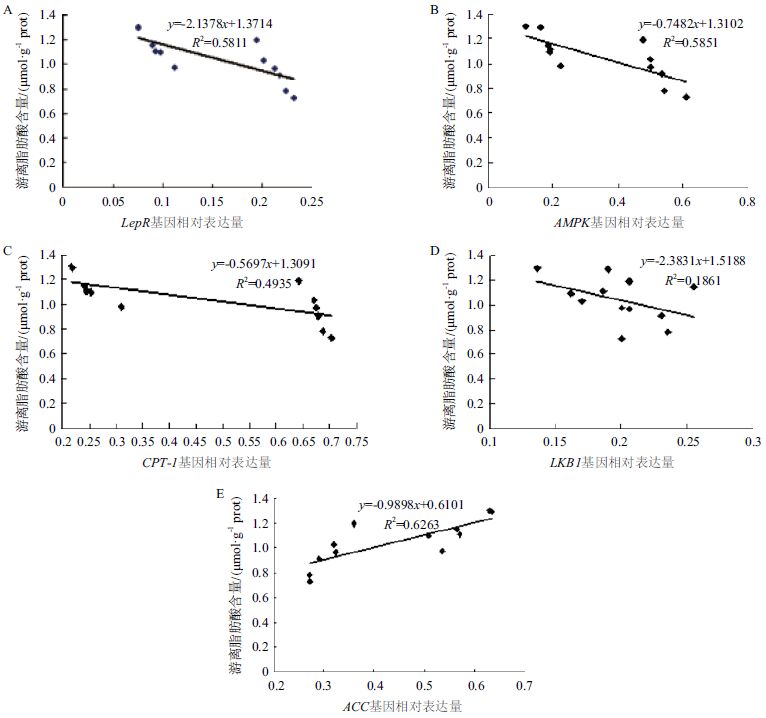
皮下前脂肪细胞中,AMPK信号通路中各基因表达量与游离脂肪酸含量相关性结果(图 4)显示,lepR(图 4-A)、AMPK(图 4-B)和 CPT-1(图 4-C)基因的mRNA的表达水平与游离脂肪酸含量之间存在强负相关(P<0.05),LKB1(图 4-D)基因的mRNA的表达水平与游离脂肪酸含量之间成负相关,但未达到显著水平(P>0.05),ACC(图 4-E)基因的mRNA的表达水平与游离脂肪酸含量之间存在强正相关(P<0.05)。
|
| A :lepR 基因表达量与游离脂肪酸含量相关性;B :AMPK 基因表达量与游离脂肪酸含量相关性;C :CPT-1 基因表达量与游离脂肪酸含量相关性;D :LKB1 基因表达量与游离脂肪酸含量相关性;E :ACC 基因表达量与游离脂肪酸含量相关性 图 4 AMPK 信号通路中基因表达量与游离脂肪酸含量相关性 |
脂肪即甘油三酯,是动物机体内储能的主要形式,是能源物质。当动物摄入的能源物质超过其所需要的消耗量时,就以脂肪的形式贮存起来。而当摄入的能源物质不能满足生理活动需要时,则体内贮存的脂肪会氧化供能。脂肪细胞从血液中摄取脂肪酸和葡萄糖,合成甘油三酯,并以脂滴的形式贮存在细胞内部[2],这些富含甘油三酯的脂滴是机体能量的贮存单位。甘油三酯可被脂蛋白酯酶分解,释放游离脂肪酸和单甘油酯。游离脂肪酸和单甘油酯被脂蛋白的膜外小叶转运到脂肪细胞的内质网内,在脂肪细胞内单甘油酯可以继续分解成游离脂肪酸和甘油[3]。而游离脂肪酸由于作为能量物质被消耗,将其作为衡量脂解的一个辅助指标。Leptin是肥胖基因(ob)的表达产物,主要由白色脂肪组织合成和分泌,在调节机体脂肪沉积和维持体重方面具有重要的作用。而Leptin能够抑制食欲中枢,减少能量摄取,增加能量消耗,抑制脂肪合成,促进脂肪分解,减少体内脂肪沉积,从而发挥降低体重的功能[4]。Nogalska等[5]指出,Leptin的增加可在体内抑制白色脂肪组织中脂肪酸合成酶的基因表达,从而使白色脂肪组织中脂肪酸的合成速度下降并导致脂肪酸氧化,脂肪量降低。Gregory等[6]研究认为,Leptin对调节体内肌肉甘油三酯的含量具有重要作用,血浆中瘦蛋白水平的慢性升高可通过刺激脂肪酸氧化和甘油三酯的水解,以及降低脂肪酸的摄取,而使瘦型大鼠肌肉内甘油三酯含量减少。本研究表明,在皮下前脂肪细胞中,添加Leptin的Leptin组中的甘油三酯和游离脂肪酸含量均低于对照组,说明Leptin具有促进脂肪分解和抑制脂肪合成的作用。
lepR是一种跨膜受体,主要的生理功能是与Leptin结合,lepR基因表达量与Leptin浓度有关[7, 8]。Leptin与lepR结合后可激活LKB1,使LK-B1与STE20相关接合蛋白(STE20 related adaptor protein,STRAD)和鼠蛋白25(mouse protein 25,MO25)结合形成三元复合物,使LKB1从细胞核转到细胞质中。此三元复合物可使LKB1活性增强从而激活下游的AMPK[9, 10]。本研究表明,Leptin组与对照组相比,LKB1的表达量没有显著差异,说明LKB1从细胞核转到细胞质过程中其表达量没有改变。活化的LKB1使AMPKα亚基中的Thr172磷酸化,并使AMPK活化[11, 12]。活化的AMPK可以磷酸化ACC的Ser79,从而使ACC失去活性。有研究表明,瘦素缺陷小鼠ACC mRNA的表达增强,可导致脂肪酸合成增加,而给予瘦素干预后,ACC mRNA的表达下调[13]。在离体的脂肪细胞中,Leptin可以降低涉及合成脂肪酸的ACC的酶活性,同时上调了CPT-1基因的表达量,从而促进了脂肪酸的氧化以及降低甘油三酯的合成[14]。本研究中Leptin组CPT-1基因相对表达量显著高于对照组(P<0.05),ACC基因相对表达量显著低于对照组(P<0.05),本研究结果与前人研究一致。
ACC是脂肪酸从头合成过程中的限速酶,它调节脂肪酸的合成,可以催化乙酰CoA形成丙二酸单酰CoA,所以ACC直接影响丙二酸单酰CoA在细胞内的浓度,而丙二酸单酰CoA是脂肪酸合成的底物,也是抑制脂肪酸β氧化的一种抑制剂,它可以抑制CPT-1活性从而阻碍脂肪酸转运进入线粒体来降低脂肪酸的氧化[15, 16]。当ACC失去活性后会减少丙二酸单酰CoA的生成,一方面减少了脂肪酸的合成,另一方面解除了丙二酸单酰CoA对CPT-1的抑制,使CPT-1活性增强,促进了脂肪酸进入到线粒体内进行β氧化[17]。故ACC基因的表达量与甘油三酯和游离脂肪酸呈正相关,CPT-1基因表达量与游离脂肪酸和甘油三酯含量呈显著负相关。ACC是脂肪酸合成的关键酶,为AMPK重要底物。激活AMPK使ACC磷酸化失活,抑制了脂肪的合成。此外AMPK磷酸化甘油磷酸酰基转移酶,抑制甘油三酯合成,以及磷酸化激素敏感酯酶,控制脂解作用,使其不超过脂肪酸的氧化速率,以防过量堆积的脂肪酸重新合成脂肪[18]。有研究表明,AMPK可以抑制甘油二酯和甘油三酯的合成,在大鼠肝细胞培养液中加入AICAR培养3 h,14C-油酸和3H-进入甘油三酯的量分别降低50%和38%,14C-油酸进入甘油二酯的量降低60%。肌细胞与AICAR仪器培养90 min,14C-油酸进入甘油三酯量降低37%,而14CO2的产量增加48%[19]。Leptin具有促磷酸化作用,可活化骨骼肌中AMPKα2催化亚基。AMPK具有检测细胞内能量状态的作用,可通过抑制ACC的活性,有效地促进肌肉中脂肪酸的氧化,降低脂肪酸的酯化。与AMPK活化相平衡,Leptin抑制ACC的活性,刺激脂肪酸在肌肉中的氧化。通过AMPK-ACC的调节作用实现Leptin的信号转导,故AMPK基因表达量与甘油三酯和游离脂肪酸成负相关。Leptin通过与lepR结合后使LKB1从细胞核转到细胞质与STARD和MO25两种蛋白结合,形成的三元复合物可激活LKB1,但LKB1基因表达量没有明显改变。活化的LKB1可以磷酸化AMPK并激活AMPK,故LKB1基因表达量与甘油三酯和游离脂肪酸含量呈负相关但没达到显著水平。Leptin通过lepR来调节下游基因,lepR基因表达量与Leptin浓度有关,故lepR基因表达量与甘油三酯和游离脂肪酸含量成显著负相关。
4 结论Leptin通过激活AMPK信号途径,降低ACC基因的表达量,提高CPT-1基因表达水平,促进甘油三酯分解及脂肪酸的氧化,降低细胞中甘油三酯和游离脂肪酸的含量。
| [1] | Luo Z, Zang M, Guo W. AMPK as a metabolic rumor suppressor:control of metabolism and cell growth[J]. Future Oncol, 2010, 6(3):457-470. |
| [2] | Tauchi K, Ozek S, Houjou T, et al. The surface of lipid droplets is a phospholipid monolayer with a unique fatty acid composition[J]. Biological Chemistry, 2002, 277:44507-44512. |
| [3] | 赵素梅. 两种肉鸡胚胎期脂肪代谢及DHEA调控研究[D]. 南京:南京农业大学, 2007. |
| [4] | Eikelis N, Lambert G, Wiesner G, et al. Extra-adipocyte Leptin release in human obesity and its relation to sympathoadrenal function[J]. Am J Physiol, 2004, 286(5):E744-E752. |
| [5] | Nogalska A, Swierczynski J. Potential role of high serum Leptin con-centration in age-related decrease of fatty acid synthase gene expre-ssion in rat white adipose tissue[J]. Experimental Gerontology, 2004, 39:147-150. |
| [6] | Gregory R, Arend B, David J, et al. Fatty acid oxidation and triacylg-lycerol hydrolysis are enhanced after chronic Leptin treatment in Rats[J]. American Journal of Physiology Endocrinology and Metablism, 2002, 282:593-600. |
| [7] | Ramsay TG, Richards MP. Leptin and Leptin receptor expression in skeletal muscle and adipose tissue in response to in vivo porcine somatotropin treated[J]. Animal Science, 2005, 83:2501-2508. |
| [8] | Borja G, Alfredo S, Teresa F, et al. Leptin receptors in human skeletal muscle[J]. Applied Physiology, 2007, 102:1786-1792. |
| [9] | 龙璐, 王平芳. LKB1-AMPK信号通路与胰岛素抵抗[J]. 中国糖尿病杂志, 2007, 15:382-384. |
| [10] | Song P, Xie ZL, Wu Y, et al. Protein kinase Cζ-dependent LKB1 serine 428 phosphorylation increases LKB1 nucleus export and apoptosis in endothelial cells[J]. Biological Chemistry, 2008, 283:12446-12455. |
| [11] | Eijiro Y, Jeffrey E, Irwin J, et al. Fyn-dependent regulation of energy expenditure and body weight is mediated by tyrosine phosphorylation of LKB1[J]. Cellular Metabolism, 2010, 11:113-124. |
| [12] | Chung T, Blerina K, Marta K. AMPK as a mediator of hormonal signalling[J]. Molecular Endocinology, 2010, 44:87-97. |
| [13] | Li J, Grigoryev DN, Ye SQ, et al. Chronic interm ittent hypoxia upregulates genes of lipid biosynthesis in obesemice[J]. Applied Physiology, 2005, 99:1643-1648. |
| [14] | Niang F, Benelli C, Ribiere C, et al. Leptin induces nitric oxide-mediated inhibition of lipolysis and glyceroneogenesis in rat white adipose tissue[J]. Nutrition, 2011, 141:4-9. |
| [15] | Jeukendrup AE. Regulation of fat metabolism in skeletal muscle[J]. Annals of the New York Academy of Sciences, 2002, 967:217-235. |
| [16] | Knafo L, Chessex P, Rouleau T. Association between hydrogen peroxide-dependent byproducts of ascorbic acid and increased hepatic acetyl-CoA carboxylase activity[J]. Clinical Chemistry, 2005, 51:1462-1471. |
| [17] | 张芳林. 肉碱棕榈酰转移酶-Ⅰ的研究进展[J]. 国外医学内分泌学分册, 2002, 22:166-169. |
| [18] | 符庆瑛, 高钰琪. 蛋白激酶AMPK的研究进展[J]. 生命科学, 2005, 17:147-152. |
| [19] | Muoio D, Seefeld K, Witters L, et al. AMP-activated kinase reciprocally regulates triacylglycerol synthesis and fatty acid oxidation in liver and muscle:evidence that sn-glycerol-3-phosphate acyltransferase is a novel target[J]. Biochemistry, 1999, 338:783-791. |