2. 西安交通大学前沿科学技术研究院 骨骼关节疾病与治疗研究中心,西安 710061 ;
3. 中国科学院微生物研究所,北京100101 ;
4. 中国科学院上海药物研究所 药物安全性评价中心,上海 201203
2. Bone and Joints Research Center,Frontier Institute of Science and Technology,Xi’an Jiaotong University,Xi’an 710061 ;
3. Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101 ;
4. Center for Drug Safety Evaluation and Research,Shanghai Institute of Materia Medica,Chinese Academy of Sciences,Shanghai 201203
1966年,Friedenstein等[1, 2, 3]首次从大鼠骨髓中分离鉴定出具有造血支持功能的干细胞,并证明其在体外可以分化为骨细胞及脂肪细胞。在此基础上,Owen及其同事提出间充质干细胞(Mesenchymal stem cells,MSCs)这一概念[4, 5]。目前,已经证实MSCs是中胚层来源的一类多能干细胞,具有自我更新及多向分化潜能,广泛存在于胎儿和成体多种组织器官中,例如:骨髓、脂肪、羊水、骨骼肌、胎肺、胎肝、脐血、脐带和胎盘等[6, 7, 8, 9, 10, 11]。其中,骨髓中的含量高,分离及获取操作简便,可于自身获取等特点一直深受研究人员的青睐,因此骨髓来源的MSCs研究比较普遍;但是,目前绒山羊骨髓MSCs体外分离培养的文献报道极少。
绒山羊作为经济价值很高的家畜,有关其生物学研究对当代畜牧业发展具有重大的战略意义。目前的绒山羊转基因克隆大多使用的是成纤维细胞,它的一个显著的缺点是培养传代数目有限、基因转染后存活率低,这一缺点已成为绒山羊转基因新品种培育的瓶颈。本研究从阿尔巴斯绒山羊骨髓中分离培养MSCs,并对其生物学特性进行系统研究,旨在深入了解大型偶蹄类动物骨髓MSCs的生物学特性,为后续转基因动物新品种培育及组织工程提供参考。
1 材料与方法 1.1 材料 1.1.1 实验动物阿尔巴斯绒山羊3-5月龄流产胎儿5个。
1.1.2 主要试剂DMEM/F12、IMDM、胎牛血清(Hyclone公司产品);胰酶、L-谷氨酰胺、地塞米松、吲哚美辛、β-磷酸甘油、维生素C、黄嘌呤、Giemsa染液、DAPI染液(Sigma公司产品);油红O(上海紫一试剂厂);转化生长因子-β、人碱性成纤维细胞生长因子、人表皮生长因子(Pepro Tech公司产品);阿利新蓝染液(阿拉丁公司产品);氨水(永大公司产品);CCK-8试剂盒(Beyotime公司产品);TRLzol 裂解液(Ambion公司产品);反转录试剂盒(TaKaRa公司产品);兔多克隆抗体 CD13、CD29、CD34、CD44、CD45、CD90、CD106和CD166(博士德产品);山羊抗兔 FITC-IgG(Protein Tech产品);定量PCR引物均由大连宝生物(TaKaRa)公司设计并合成,序列见表 1。
无菌条件下取阿尔巴斯绒山羊3-5月龄流产胎儿腿骨,用培养基冲洗获取骨髓,加入肝素抗凝。置20 mL DMEM/F12培养基中,1 000 r/min离心10 min,收集细胞;再加入完全培养基(含有DMEM/F12,50 ng/mL人表皮生长因子,10 ng/mL人碱性成纤维细胞生长因子,10-8 mol/L地塞米松,2 mmol/L谷氨酰胺,5%胎牛血清,100 U/mL青霉素/链霉素),将细胞悬浮后接种到10 mm培养皿中,随后置于37℃、5% CO2、饱和湿度培养箱中培养,48 h后全量换液,以后每隔2 d换液,当细胞生长至80%融合时用0.25%胰蛋白酶进行1∶2的消化传代。培养的过程中,倒置相差显微镜下观察细胞形态和生长状况。
1.2.2 细胞增殖能力检测取分离至3个不同个体的处于对数生长期的第4代gBM-MSCs,加入完全培养基稀释为2×104/mL细胞悬液,按每孔100 μL接种到96孔板中,每隔2 d换液;接种后的第1天起,每隔24 h加入10 μL CCK-8试剂,置于37℃恒温箱中孵育4 h,用酶标仪检测450 nm处的吸光值,连续检测7 d,并用GraphPad Prism 5软件进行数据处理。
1.2.3 细胞核型分析取第15代处于对数生长期的gBM-MSCs,加入80 μL 0.1 mg/mL秋水仙素,置37℃恒温培养箱中孵育3.5 h;消化收集细胞,加入8 mL 0.075 mol/L KCl低渗液,置于37℃水浴锅,孵育30 min,固定,滴片;Gimesa染色15 min,自来水冲洗,自然晾干,油镜下观察细胞中期染色体形态及数目,并用Genus软件分析。
1.2.4 免疫荧光法检测细胞表面标志物CD13、CD-29、CD44、CD90和CD106取第4代gBM-MSCs,在6孔板内进行细胞爬片,细胞生长至80%融合时,每孔加入1.5 mL 4%多聚甲醛固定30 min;加入封闭液(PBS+2%牛血清蛋白+2%山羊封闭血清+2%脱脂奶粉+0.15 mol/L甘氨酸)室温封闭2 h;滴加1∶200稀释兔多克隆抗体CD13、CD29、CD44、CD106、CD90,4℃孵育过夜,PBS冲洗;之后加入1∶50稀释异硫氰酸荧光素(FITC)标记的山羊抗兔IgG,室温孵育2 h;DAPI染色15 min后共聚焦显微镜下观察结果。阴性对照以磷酸盐缓冲液(PBS)代替第一抗体。
1.2.5 流式细胞术检测细胞表面标志物CD34、CD45和CD166消化收集第4代gBM-MSCs,用F-PBS(含1%胎牛血清PBS)重悬,将细胞以106个/管分装至2 mL离心管中,离心弃上清,分别加 5 μL兔多克隆抗体 CD34、CD45和CD166,避光常温孵育2 h,PBS冲洗,之后加入1∶50稀释异硫氰酸荧光素(FITC)标记的山羊抗兔IgG,室温孵育2 h;补加F-PBS冲洗2次,离心弃上清,加800 μL 2%多聚甲醛固定,流式细胞仪检测,用FlowJo 7.6.1软件分析数据。
1.2.6 多向分化潜能检测消化收集第4代gBM-MSCs,加完全培养基,将细胞浓度调整至2×104个/mL,接种于六孔板中,培养24 h后,更换诱导培养液,以后每隔2 d换液,第21天检测诱导结果。对于成脂肪诱导的细胞,用1%油红O染色,倒置荧光显微镜观察脂滴形成情况;用RT-PCR法检测脂肪细胞经典基因过氧化物酶体增殖物激活受体γ PPARG(Peroxisome proliferator-activated receptor gamma)的表达。成骨诱导的细胞,用20 ng/mL硝酸银染色,观察钙盐沉积情况;用RT-PCR法检测骨细胞经典基因骨钙素蛋白GLA(Galactosidase alpha)的表达。成软骨诱导的细胞,用1%阿利新蓝染色,观察酸性黏多糖合成情况,用RT-PCR法检测软骨细胞经典基因光蛋白聚糖LUM(lumican)的表达。
成脂肪诱导液:IMDM,5%牛胎血清,1 μmol/L地塞米松,5 μg/mL胰岛素,0.5 mmol/L黄嘌呤,60 μmol/L吲哚美辛;成骨诱导液:IMDM,5%牛胎血清,0.1 μmol/L地塞米松,0.05 mmol/L维生素C,10 mmol/L β-甘油磷酸;成软骨诱导液:IMDM,5%牛胎血清,10 ng/mL 转化生长因子-β,10-7 mol/L地塞米松,50 μg/mL维生素C。
1.2.7 多向分化相关基因动态表达分析按照上述1.2.6中的实验方法诱导培养gBM-MSCs后,分别提取诱导7、14和21 d 后的细胞总RNA,通过荧光定量PCR法检测诱导不同天数后相应分化基因动态表达情况。对于成脂肪诱导的细胞,检测脂肪经典基因PPARG的表达趋势;对于成骨诱导的细胞,检测骨经典基因GLA的表达趋势;对于成软骨诱导的细胞,检测软骨经典基因LUM的表达趋势;以未诱导的gBM-MSCs作为对照,基因相对表达量用GAPDH标准化并用 2-ΔΔCt 法运算。
2 结果 2.1 细胞分离和培养实验对5个绒山羊流产胎儿进行了骨髓分离培养,获得了5株gBM-MSCs。gBM-MSCs原代培养时4-6 h开始贴壁,大约培养14 d后达到80% 汇合,通过培养基筛选和传代培养去除其他类型的干细胞和终末分化细胞,传至P5时呈现均一的成纤维样细胞,贴壁生长,状态良好(图 1)。

|
| A :第5 代gBM-MSCs ;B :第15 代gBM-MSCs 图 1 阿尔巴斯绒山羊骨髓间充质干细胞形态 |
第5代gBM-MSCs生长曲线呈S型(图 2),接种后第0-1天为潜伏适应期,从第1天起快速增殖,进入对数生长期,第5天进入平台期,平台期持续1-2 d,之后细胞增殖速度显著下降,进入衰退期。
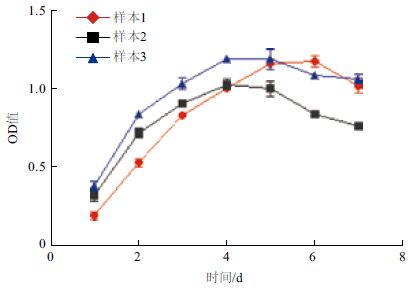
|
| 不同样本代表来自不同个体的gBM-MSCs 图 2 第5 代阿尔巴斯绒山羊骨髓间充质干细胞生长曲线 |
为验证本实验所分离出的gBM-MSCs在体外传代过程中细胞染色体数目是否完整,我们收集第15代gBM-MSCs做染色体数目分析,随机选取20个样本进行染色体计数。结果(图 3)显示,所做的第15代gBM-MSCs中有95%(19/20)的细胞染色体为2n=60条,具有正常二倍体核型,表明体外培养的gBM-MSCs能够进行正常染色体复制和分裂。
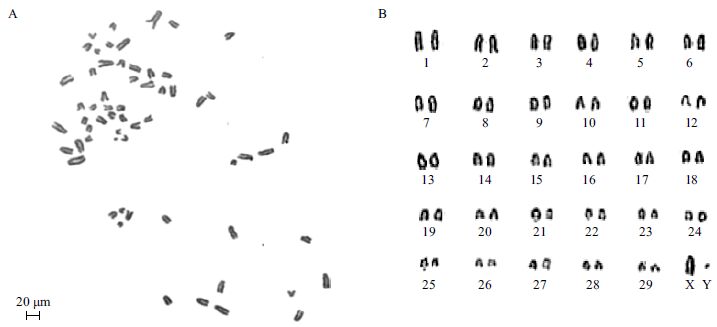
|
| A :通过软件处理后去掉底色的核型图;B :经过配对的核型图 图 3 第15 代阿尔巴斯绒山羊骨髓间充质干细胞核型(2n=60) |
免疫荧光检测结果显示,第5代gBM-MSCs表达间质系表面标志物CD13(图 4-B)、整合素家族成员CD29(图 4-C)、黏附分子CD44(图 4-D)、CD106(图 4-E)及CD90(图 4-F)。

|
| A :阴性对照;B-F :gBM-MSCs 均表达间质系表面标志物CD13(B)、CD29 (C)、CD44(D)、CD106(E)和CD90(F) 图 4 免疫荧光法检测第5 代阿尔巴斯绒山羊骨髓间充质干细胞表面标志物 |
流式细胞术检测结果显示,第5代gBM-MSCs表达粘附分子CD166(图 5-A)、不表达造血干细胞表面标志物CD34(图 5-B)、CD45(图 5-C)。
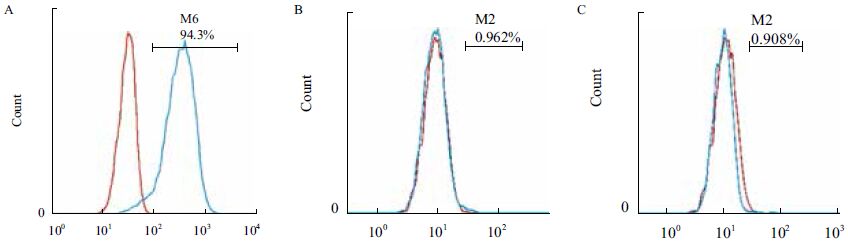
|
| A :gBM-MSCs 表达CD166 ;B :gBM-MSCs 不表达造血干细胞表面标志物CD34 ;C :gBM-MSCs 不表达造血干细胞表面标志物CD45,蓝色曲线代表实验组样本,红色曲线代表同型对照 图 5 流式细胞术检测第5 代阿尔巴斯绒山羊骨髓间充质干细胞表面标志物 |
第5代gBM-MSCs分别用成脂肪、成骨和成软骨培养基诱导21 d后,进行染色和RT-PCR法鉴定。结果(图 6)显示,成脂肪诱导后细胞质中形成脂肪颗粒,经油红O染色后,能观察到桔红色的脂滴(图 6-A1),RT-PCR显示成脂肪诱导后的细胞阳性表达脂肪经典基因PPARG(图 6-A3);成骨诱导后细胞质中出现钙盐沉积,硝酸银染色呈阳性(图 6B1),RT-PCR显示成骨诱导后的细胞阳性表达成骨经典基因GLA(图 6-B3);成软骨诱导后细胞质中形成酸性黏多糖,经阿尔新兰染色后,能特异性着蓝色(图 6-C1);RT-PCR显示成软骨诱导后的细胞阳性表达软骨经典基因LUM(图 6-C3)。以上结果显示,gBM-MSCs具有多向分化潜能。

|
| A1 :脂肪诱导实验组;A2 :脂肪诱导对照组;A3 :RT-PCR 检测脂肪细胞经典基因PPARG 表达。B1 :成骨诱导实验组;B2 :成骨诱导对照组;B3 :RT-PCR 检测骨细胞经典基因GLA 表达。C1 :软骨诱导实验组;C2 :软骨诱导对照组;C3 :RT-PCR 检测软骨细胞经典基因LUM 表达。(GAPDH :内参;CTRL :阴性对照) 图 6 体外诱导第5 代阿尔巴斯绒山羊骨髓间充质干细胞向脂肪、成骨和软骨细胞分化 |
进一步通过荧光定量PCR法检测诱导7、14和21 d后相关分化基因动态表达情况,结果(图 7)显示,成脂肪细胞诱导后脂肪经典基因PPARG表达量随着诱导天数的增加逐步上升,诱导21 d后达到最高,约上调1 270倍(图 7-A);成骨细胞诱导后骨细胞经典基因GLA的表达也随着诱导天数的增加逐步上调,诱导21 d后达到最高,约上调165倍(图 7-B);成软骨细胞诱导后软骨经典基因LUM的表达量也逐步增加,诱导21 d后达到最高,约上调63倍(图 7-C)。本实验进一步证实我们分离培养的gBM-MSCs具有多向分化潜能,多向分化相关基因的表达水平随着诱导天数的增加呈上升趋势。

|
| A :成脂肪细胞诱导后脂肪经典基因PPARG 的表达;B :成骨细胞诱导后成骨经典基因GLA 的表达;C :成软骨细胞诱导后软骨经典基因LUM 的表达 图 7 实时定量PCR 法检测诱导后分化相关基因的动态表达 |
本研究采用全骨髓贴壁培养法,对5个绒山羊流产胎儿进行了骨髓分离培养,用含人表皮生长因子(EGF)和人碱性成纤维细胞生长因子(bFGF)等的扩增培养基培养,获得了5株细胞,该细胞具备MSCs的生物学特征。有研究证实,培养基中添加人碱性成纤维细胞生长因子有利于细胞贴壁生长[12],同时不影响其多向分化能力[13];而人表皮生长因子的添加能够促进细胞增殖,缩短细胞的倍增时间[14, 15]。
目前,MSCs的鉴定采用2006年国际细胞治疗协会(International Soeiety for Cellular Therapy,ISCT)提出的标准,包括以下几方面:①细胞形态为成纤维细胞样,具有贴壁生长特性;②阳性表达间质系表面标志物,如CD73(SH3和SH4),CD105(SH2)和CD90(Thy1)等,阴性表达造血干细胞表面标志物,如:CD45,CD19,CD19或CD79、CD14或CD11b和HLA-DR等;③具有向脂肪细胞、成骨细胞和软骨细胞分化的多向分化潜能[16, 17]。本实验对gBM-MSCs生物学特征进行了系统研究,结果显示,gBM-MSCs体外培养时具有贴壁特性,呈梭形或纺锤形,具有较强的增殖能力,符合MSCs的基本特征;可连续稳定传代至15代以上,第15代gBM-MSCs仍然具备正常二倍体核型;第5代gBM-MSCs表达间质系表面标志物,如:CD13、CD29、CD44、CD106、CD90及CD166,而不表达造血干细胞表面标志物CD45及CD34;体外诱导培养后,gBM-MSCs能够向脂肪细胞、成骨细胞和软骨细胞分化;以上结果说明我们分离获得的细胞具备MSCs的生物学特性。这一结果与Ren等[18, 19]的报道相似,他们研究显示,绒山羊gBM-MSCs表达间质系表面标志物CD29、CD44和CD90,不表达内皮及造血干细胞表面标志物CD31及CD45,体外可以向骨细胞、神经细胞诱导分化。
在此基础上,我们通过荧光定量PCR法检测多向分化相关基因PPARG、GLA和LUM动态表达情况。Rosen等研究显示,PPARG通过结合脂肪细胞特异基因,如脂肪酸结合蛋白和脂肪细胞P2基因,在脂肪形成过程中扮演重要角色[20, 21]。我们发现成脂肪诱导后PPARG表达量随着诱导天数的增加逐步上升。GLA是成骨特异性表达基因,与骨矿化基质的形成有关[22, 23]。我们发现成骨诱导后GLA表达随着诱导天数的增加逐步上调,此结果与Açil等[24]的研究一致,他们发现人骨髓MSCs成骨分化过程中,碱性磷酸酶和骨钙蛋白表达上调。LUM编码形成亮氨酸丰富的蛋白多糖家族,包括聚糖、双链蛋白聚糖和纤维调节蛋白,也可能参与到胶原原纤维的构建[25]。我们发现成软骨诱导后LUM表达量同样随着诱导天数的增加逐步上升,诱导21 d时,表达显著上调。本实验发现体外诱导培养gBM-MSCs后,多向分化相关基因的表达水平随着诱导天数的增加呈上升趋势,进一步证实gBM-MSCs具有多向分化潜能。
综上所述,采用全骨髓贴壁培养法能够从阿尔巴斯绒山羊骨髓中分离gBM-MSCs,获得的gBM-MSCs具有自我更新及多向分化潜能。此培养法操作简单,可大量分离及纯化gBM-MSCs,可以为后续转基因动物新品种培育及组织工程提供充足种子细胞,具有重要现实意义。
4 结论本研究从阿尔巴斯绒山羊骨髓中分离培养获得了gBM-MSCs,该细胞符合国际细胞治疗协会提出的MSCs鉴定标准,具备MSCs生物学特性,可以用于后续实验研究。
| [1] | Friedenstein AJ, Piatetzky-Shapiro II, Petrakova KV. Osteogenesis in transplants of bone-marrow cells[J]. J Embryol Exp Morphol, 1966, 16:381-390. |
| [2] | Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J]. Exp Hematol, 1976, 4(5):267-274. |
| [3] | Owen M, Friedenstein AJ. Stromal stem cells:marrow-derived osteogenic precursors[J]. Ciba Found Symp, 1988, 136:42-60. |
| [4] | Caplan AI. Mesenchymal stem cells[J]. J Orthop Res, 1991, 9:641-650. |
| [5] | Ahn MY, Zhang ZG, Tsang W, et al. Endogenous plasminogen activator expression after embolicfocal cerebral ischemia in mice[J]. Brain Res, 1999, 83(7):169-176. |
| [6] | Campagnoli C, Roberts IA, Kumar S, et al. Identification of mesenchymal stem/progenitorcells in human first-trimester fetal blood, liver, and bone marrow[J]. Blood, 2001, 98:2396-2402. |
| [7] | Zvaifler NJ, Marinova-Mutafchieva L, Adams G, et al. Mesenchymal precursor cells in theblood of normal individuals[J]. Arthritis Res, 2000, 2:477-488. |
| [8] | Erices A, Conget P, Minguell JJ. Mesenchymal progenitor cells in human umbilical cord blood[J]. Br J Haematol, 2000, 109:235-242. |
| [9] | Wang HS, Hung SC, Peng ST, et al. Mesenchymal stem cells in the Wharton’s jelly of thehuman umbilical cord[J]. Stem Cells, 2004, 22:1330-1337. |
| [10] | In ‘t Anker PS, Scherjon SA, Kleijburg-van der Keur C, et al. Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta[J]. Stem Cells, 2004, 22:1338-1345. |
| [11] | Bruder SP, Kurth AA, Shea M, et al. Bone regeneration by implantation of purified, culture-expanded human mesenchymal stem cells[J]. J Orthop Res, 1998, 16:155-162. |
| [12] | Shur I, Lokiec F, Bleiberg I, et al. Differential gene expression of cultured human osteoblasts[J]. J Cell Biochem, 2001, 83:547-553. |
| [13] | Solmesky L, Lefler S, Jacob-Hirsch J, et al. Serum free cultured bone marrow mesenchymal stem cells as a platform to characterize the effects of specific molecules[J]. PLoS One, 2010, 5(9):e12689. |
| [14] | Sotiropoulou PA, Perez SA, Salagianni M, et al. Characterization of the optimal culture conditions for clinical scale production of human mesenchymal stem cells[J]. Stem Cells, 2006, 24:462-471. |
| [15] | Horwitz E, Le BK, Dominici M, et al. Clarification of the nomenclature for MSC:the international society for cellular therapy position statement[J]. Cytotherapy, 2005, 7:393-395. |
| [16] | Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. the international society for cellular therapy position statement[J]. Cytotherapy, 2006, 8:315-317. |
| [17] | Burgener A. Cell culture technology for pharmaceutical and cell-based therapies[M]. USA:CRC Press, 2006:41-79. |
| [18] | Ren Y, Wu H, Wang X, et al. Analysis of the stem cell characteristics of adult stem cells from Arbas white Cashmere goat[J]. Biochemical, 2014, 448(2):121-128. |
| [19] | Ren Y, Wu H, Wang X, et al. The effect of arbas cashmere goat bone marrow stromal cells on production of transgenic cloned embryos[J]. Theriogenology, 2014, 81(9):1257-1267. |
| [20] | Rosen ED, Spiegelman BM. PPARγ:a nuclear regulator of metabolism, differentiation, and cell growth[J]. J Bio Chem, 2001, 276(41):37731-37734. |
| [21] | Tontonoz P, Hu E, Graves RA, et al. PPAR γ2:tissue-specific regulator of an adipocyte enhancer[J]. Genes Dev, 1994, 8:1224-1234. |
| [22] | Ryoo HM, Hoffmann HM, Beumer T, et al. Stage-specific expression of dlx-5 during osteoblast differentiation:involvement in regulation of osteocalcin gene expression[J]. Mol Endocrinol, 1997, 11(11):1681-1694. |
| [23] | Hauschka PV, Lian JB, Cole DE, et al. Osteocalcin and matrix gla protein vitamin K-dependent proteins in bone[J]. Physiol Rev, 1989, 69(3):990-1047. |
| [24] | Açil Y, Ghoniem AA, Wiltfang J. Optimizing the osteogenic differentiation of human mesenchymal stromal cells by the synergistic action of growth factors[J]. J Craniomaxillofac Surg, 2014, 42(8):2002-2009. |
| [25] | Pietraszek K, Chatron-Colliet A, Brezillon S, et al. Lumican:A new inhibitor of matrix metalloproteinase-14 activity[J]. FEBS Lett, 2014, 588(23):4319-4324. |





