2. 国家海洋局海洋生物活性物质重点实验室,青岛 266061
2. Key Laboratory of Marine Bioactive Substances, State Ocean Administration,Qingdao 266061
1963年Bunt[1]首次报道南极海水及海冰中有冰藻的存在。此后,各国科研人员对其展开了大量的研究[2, 3, 4]。冰藻可以在南极低温环境中快速生长,是海冰生态系统中主要的初级生产力来源[3, 4],并且可以耐受海冰反复冻融所产生的渗透压急剧变化、高盐度以及强紫外辐射等极端环境[4]。
脯氨酸和可溶性糖在高等植物的抗逆生理中发挥着重要的作用[5]。脯氨酸是在各种生物体内均有分布的渗透保护物质,在低温胁迫条件下,高等植物通过增加细胞内的脯氨酸和可溶性糖含量来维持细胞的渗透压,增强细胞对低温的抵抗能力[6, 7, 8]。同时,可溶性糖的含量与植物抗寒性之间呈正相关[9]。然而,两者在相对低等的海洋微藻的低温胁迫生理适应机制中的研究未见报道。
当前,对于南极冰藻低温适应性的机制研究中,细胞膜适应性变化、冰活性蛋白、不饱和脂肪酸、低温酶等研究已相对较多[10],而关于脯氨酸及可溶性糖的变化及与低温适应性的相关性研究较少。本研究通过分析两种南极冰藻中的脯氨酸及可溶性糖在低温胁迫下的变化趋势,探究脯氨酸及可溶性糖在南极冰藻适应极端低温环境中的变化过程和作用机制。
1 材料与方法 1.1 材料 1.1.1 藻种及其培养实验用南极冰藻为两种单细胞绿藻,塔胞藻Pyramidomonas sp. L-1和衣藻Chlamydomonas sp. L-4[11, 12],均为中国第18次南极科考所采集海冰样品中分离所得,并在国家海洋局海洋生物活性物质重点实验室获得长期保藏。
冰藻在温控光照培养箱中培养,光照强度为20-30 μmol/(m2·s),光暗周期为12∶12;培养基为f/2海水培养基,每日摇动4-5次,培养至对数生长期[13]。
1.2 方法 1.2.1 细胞内脯氨酸含量的测定取一定体积的南极冰藻培养液,低温离心机4 000 r/min离心5 min,去除上清液后用蒸馏水洗涤。藻泥加入5 mL、5%的乙酸和20 mL蒸馏水,用研磨器研磨20 min后,加入1 g人造沸石,振荡5 min,以5 000 r/min的转速离心10 min。取上清液3 mL,加入冰醋酸和茚三酮各3 mL,振荡5 min后,沸水浴1 h,冷却后加入苯3 mL,充分振荡,测定515 nm的光吸收值。同时取相同体积的冰藻培养液,测定干重。
脯氨酸标准曲线的方程为:Pro(μg/mL)=10.27x+0.00468。从标准曲线中查出每毫升样品中脯氨酸的含量,再计算出样品中脯氨酸含量(mg/g)。
1.2.2 细胞内可溶性糖的提取及含量的测定取一定体积的南极冰藻培养液,低温离心机4 000 r/min离心5 min,去除上清液后用蒸馏水洗涤,藻泥加入乙醚后用研磨器研磨10 min成均匀糊状,加入蒸馏水后放入烧杯中70-80℃水浴30 min,冷却后滴加饱和中性醋酸铅至完全沉淀,将混合物及沉淀在100 mL容量瓶中定容,充分振荡混合后过滤取清液,清液用草酸钠去除过量醋酸铅后再次过滤,此时透明滤液即为可溶性糖提取液。
取1 mL可溶性糖提取液,加入5 mL蒽酮置于试管中,沸水浴中10 min,冷却后用分光光度法在625 nm处测定光吸收值。从标准曲线中查出每毫升样品中可溶性糖的含量,再计算出样品中可溶性糖含量(mg/g)。
1.2.3 温度对细胞内脯氨酸和可溶性糖含量的影响实验设定培养温度为-5℃、0℃和5℃(-5℃-0℃视为低温),每个温度梯度分别处理6、12、24和48 h。测定不同培养温度和培养时间下两种南极绿藻细胞中的脯氨酸和可溶性糖含量。
2 结果 2.1 温度对两种绿藻胞内脯氨酸含量的影响温度对塔胞藻Pyramidomonas sp. L-1的脯氨酸含量的影响结果(图 1)显示,塔胞藻L-1细胞内的脯氨酸含量在不同温度作用下的变化幅度有较大差异。在温度处理初始的6 h内,3组别温度作用下的L-1细胞内脯氨酸的含量变化并不明显,差别也不大;随着处理时间的延长,塔胞藻L-1细胞内的脯氨酸含量开始增加,并且3组别温度作用的细胞内脯氨酸含量的变化有明显差异。其中在-5℃下,塔胞藻L-1胞内的脯氨酸含量增加最多,明显超过其它两组别温度作用下的结果;处理48 h后,该组别细胞内的脯氨酸含量由0.48 mg/g增加到了3.24 mg/g,含量增加到初始值的6.5倍。0℃温度组别的L-1在48 h后胞内的脯氨酸含量也增到初始值的4.8倍;而5℃温度组别的L-1胞内脯氨酸的含量变化则相对小很多,仅增加到初始值含量的2倍左右。
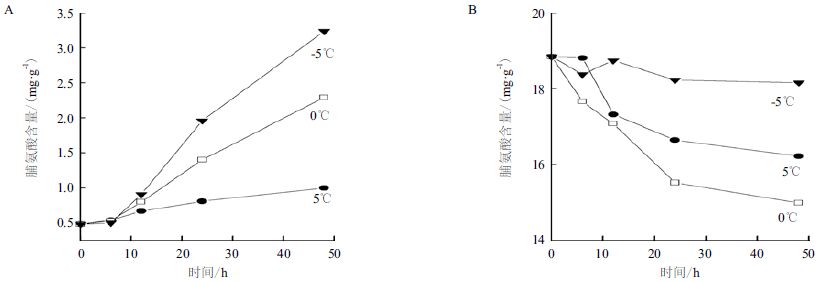
|
| 图 1 温度对Pyramidomonas sp. L-1(A)和Chlamydomonas sp. L-4(B)胞内脯氨酸含量的影响 |
相同温度条件作用下,衣藻Chlamydomonas sp. L-4胞内脯氨酸的含量变化趋势与塔胞藻Pyramido-monas sp. L-1相反。同样由图 1可知,衣藻L-4的细胞内脯氨酸的含量随着温度作用时间的增加出现减少的趋势。处理初始,3个组别的L-4细胞内的脯氨酸含量都是18.84 mg/g。-5℃处理48 h后,L-4胞内的脯氨酸含量基本维持在了初始的含量状态,虽略有减少但基本可以视为保持稳定。在3个组别当中,该组别细胞内脯氨酸的含量相对最高,其它两组别胞内脯氨酸的含量都出现了明显的下降;其中,0℃组别胞内脯氨酸的含量降低最多,由0 h时的18.84 mg/g降低到了48 h后的14.99 mg/g,降幅达到了20%。
虽然两种绿藻的胞内脯氨酸含量的变化趋势不同,但是衣藻Chlamydomonas sp. L-4胞内脯氨酸的相对含量却远远大于塔胞藻Pyramidomonas sp. L-1,其初始状态时胞内脯氨酸含量是L-1的近40倍。-5℃温度处理48 h后,虽然L-1胞内的脯氨酸含量有大幅度增加,但L-4胞内的脯氨酸含量仍然是L-1的5.6倍,而这个差距也是3组温度组别处理48 h后最小的。
虽然两种绿藻胞内脯氨酸含量的变化趋势不同,但均在-5℃时具有相对最高的胞内含量,这说明低温胁迫下细胞内的脯氨酸的积累在冰藻的低温适应性过程中发挥了积极的作用。
2.2 温度对两种绿藻胞内可溶性糖含量的影响塔胞藻Pyramidomonas sp. L-1经过3个组别温度处理48 h后,胞内的可溶性糖含量出现较大差异,结果见图 2。其中,0℃和5℃的温度处理后胞内可溶性糖的含量变化相对于-5℃处理的结果非常微小。5℃条件下处理48 h后L-1胞内可溶性糖的含量变化非常小,0℃组别胞内的可溶性糖含量在12 h有所增加,12 h后基本维持在一定含量保持不变。-5℃组别的L-1胞内可溶性糖含量变化最为明显,其含量在处理6 h后开始稳定增加,由初始时的3.23 mg/g增加到了48 h时的5.13 mg/g,增加了约60%的含量。
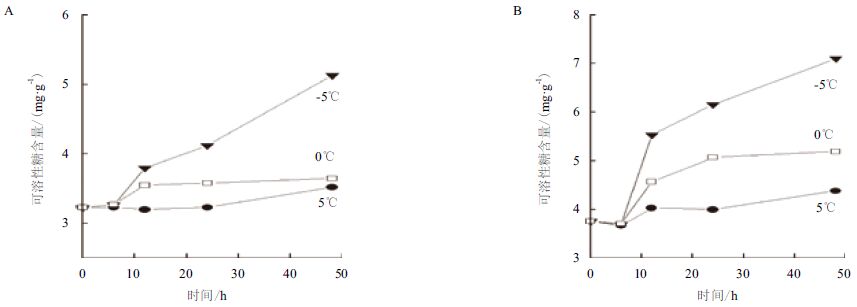
|
| 图 2 温度对Pyramidomonas sp. L-1(A)和Chlamydomonas sp. L-4(B)胞内可溶性糖含量的影响 |
温度对衣藻Chlamydomonas sp. L-4胞内可溶性糖含量变化的影响与塔胞藻L-1的变化趋势相似,0℃与5℃处理48 h后的可溶性糖含量变化不明显,-5℃处理48 h后变化较大,含量由初始时的3.76 mg/g增加到48 h后的7.13 mg/g,增加了90%的含量。
对比两种绿藻细胞内可溶性糖的含量,均在-5℃条件下含量最高,并且L-4胞内的可溶性糖含量要略高于L-1。
3 讨论脯氨酸的积累是植物体抵抗渗透胁迫的一种有效方式,其可以通过调节细胞的渗透势,稳定蛋白结构来维持细胞正常的生理功能[5, 7, 8]。
本研究的结果表明,在塔胞藻Pyramidomonas sp. L-1中,随着培养温度的降低,其胞内脯氨酸的含量成倍增加。温度在-5℃,培养48 h后,胞内的脯氨酸含量由0.48 mg/g增加到了3.24 mg/g,含量是初始值的6.5倍;0℃温度组别的L-1在48 h后胞内的脯氨酸含量也增到初始值的4.8倍,5℃由于在其可正常生长的温度内(2-6℃)[11],因此脯氨酸含量增加较小。这说明在低温(-5℃-0℃)环境胁迫下,L-1胞内通过富集脯氨酸来维持细胞在低温下的正常生理功能。
温度对衣藻Chlamydomonas sp. L-4胞内的脯氨酸含量的影响不同于L-1。-5℃条件下,L-4胞内的脯氨酸含量没有明显变化,而温度为0℃和5℃时,脯氨酸含量随着作用时间的延长而降低。这说明-5℃的低温条件下,L-4细胞内的脯氨酸含量需要维持在一个较高的水平;而在0℃和5℃时,脯氨酸的含量适当减少即可维持其胞内正常的生理活动。
Chlamydomonas sp. L-4胞内的脯氨酸含量远远高于Pyramidomonas sp. L-1,约为后者的40倍。L-1的脯氨酸对温度变化敏感,低温会导致其含量成倍增加,而L-4在低温下可以维持胞内较高的脯氨酸含量。这说明脯氨酸在南极冰藻的低温适应性机制中起到了重要的作用,对于不同的藻种,其发挥作用的方式不同;L-1和L-4在各自的低温适应过程中的脯氨酸调节机制和方式是不同的。另一方面,L-1可能对低温的反应更加敏感;而L-4在长期的进化过程中,相对于L-1更适应极地的低温环境,因此在胞内已合成较高含量的脯氨酸,这种高含量的脯氨酸足以抵御不良环境对其造成的伤害,从而维持其正常的细胞生长。
根据脯氨酸在高等植物抗逆过程中的作用机制[6, 7, 8],分析脯氨酸在南极冰藻低温环境适应过程中的作用可能有以下几方面:(1)作为渗透保护物质,调节胞内外的渗透压平衡。在海冰的冻融过程中,生存在其中的南极冰藻不仅受低温的影响,还需要经受由于盐度的急剧变化而导致的渗透压的巨大变化,脯氨酸作为渗透调节剂能够迅速维持南极冰藻细胞内外的渗透压平衡。(2)保护和稳定蛋白。脯氨酸具有很高的水溶性,其分子结构既具有亲水部分,又具有疏水部分,可以同蛋白质的疏水部分结合,又不影响蛋白质分子内部的疏水作用,使蛋白质不变性,在低温下保持蛋白质的生物活性。(3)脯氨酸可与细胞内的一些化合物形成聚合物,降低细胞质的冰点。(4)清除羟基自由基。脯氨酸能够清除低温下产生的活性氧,保护细胞膜免受破坏。
高等植物细胞在低温下会大量的积累可溶性糖以提高其抗寒性[8],袁淑珍等[17]对低温胁迫下螺旋藻细胞内可溶性糖的研究也已证明在藻类植物细胞中其作用机制同样如此。本研究的结果表明,在低温胁迫下,两株冰藻细胞内的可溶性糖含量均有明显的增加,-5℃,48 h后,增加量均在60%以上,衣藻L-4胞内的可溶性糖含量增幅达90%。这说明两株绿藻均对低温环境胁迫做出了应答响应和适应性变化。而在0℃与5℃的温度下处理后,胞内可溶性糖的增幅并不明显。这说明,在L-1和L-4可正常生长的温度范围内,可溶性糖的含量增加并不明显,因为这些低温藻类已经适应了极地的环境温度,当周围环境温度继续降低至冰点以下时,其低温适应性机制中可溶性糖的变化机制才会开始发挥作用。
极地冰藻的低温适应性机制是其胞内各种生化组分共同作用的结果。以往的研究中,重点关注了细胞膜的流动性机制、抗冻蛋白及冰活性物质、低温酶的作用机制、细胞膜不饱和脂肪酸的变化机制等在冰藻低温适应过程中的作用,而关于脯氨酸和可溶性糖的研究则相对较少。本研究通过对两株冰藻在低温胁迫下脯氨酸和可溶性糖的变化过程的研究和分析,阐述了这二者在冰藻低温胁迫适应过程中的作用,为深入了解和分析极地冰藻的低温适应性机制提供了基础数据。
4 结论低温胁迫下通过对两种南极冰藻胞内脯氨酸和可溶性糖含量变化的分析,获得了其在低温适应性过程中的变化趋势,对于不同的藻种,两种物质发挥作用的方式不同。
低温下塔胞藻Pyramidomonas sp. L-1胞内的脯氨酸和可溶性糖含量均发生了明显变化,温度越低,脯氨酸和可溶性糖含量增加越明显,温度越高,增加的幅度越小。-5℃处理48 h后,脯氨酸含量增加到初始值的6.5倍;可溶性糖增加了约60%的含量。
衣藻Chlamydomonas sp. L-4胞内脯氨酸的含量变化随着温度作用时间的增加出现减少的趋势,温度越低,胞内脯氨酸的含量越高。-5℃处理48 h后,胞内的脯氨酸含量基本维持在了初始的含量,0℃降低最大达到了20%。可溶性糖随温度的变化趋势为温度降低含量增加;-5℃处理48 h后,L-4胞内可溶性糖增加了90%的含量。
| [1] | Bunt JS, Wood EJF. Microbiology of Antarctic sea-ice:microalgae and Antarctic sea-ice[J]. Nature, 1963, 199:1254-1255. |
| [2] | Priscu JC, Palmisano AC, Peiscu LR, et al. Temperature dependence of inorganic nitrogen uptake and assimilation in Antarctic sea-ice microalgae[J]. Polar Biology, 1989, 9(7):443-446. |
| [3] | Thomas DN, Dieckmann GS. Antarctic sea ice-a habitat for extremophiles[J]. Science, 2002, 295(5555):641-644. |
| [4] | 何剑锋, 王桂忠, 李少菁, 蔡明红. 南极海冰区冰藻类群及兴衰过程[J]. 极地研究, 2003, 15(2):102-105. |
| [5] | Verbruggen N, Hermans C. Proline accumulation in plants:a review[J]. Amino Acids, 2008, 35(4):753-759. |
| [6] | 王小华, 庄南生. 脯氨酸与植物抗寒性的研究进展[J]. 中国农业学报, 2008, 24(11):398-402. |
| [7] | 王丽媛, 丁国华, 黎莉. 脯氨酸代谢的研究进展[J]. 哈尔滨师范大学自然科学学报, 2010, 26(2):84-89. |
| [8] | 罗丹, 张喜春, 田硕. 低温胁迫对番茄幼苗脯氨酸积累及其代谢关键酶活性的影响[J]. 中国农学通报, 2013, 29(16):90-95. |
| [9] | 王荣富. 植物抗寒指标的种类及其应用[J]. 植物生理学通讯, 1987(3):49-55. |
| [10] | 史翠娟, 阚光锋, 缪锦来, 等. 南极冰藻逆境适应性机理的研究进展[J]. 海洋科学, 2010, 34(4):100-103. |
| [11] | 姜英辉, 侯旭光, 李光友. 两种南极冰藻的形态和超微结构观察[J]. 高技术通讯, 2001, 8:29-33. |
| [12] | 缪锦来, 阚光锋, 张波涛, 等. 南极冰藻Pyramidomonas sp. 和Chlorophyceae L-4的优化培养[J]. 中国水产科学, 2004, 11(3):244-252. |
| [13] | 缪锦来, 石红旗, 姜英辉, 等. 南极冰藻生化组成及其与低温适应性关系的研究[J]. 海洋科学进展, 2002, 20(4):43-50. |
| [14] | 朱广廉, 邓兴旺, 左卫能. 植物体内游离脯氨酸的测定[J]. 植物生理学通讯, 1983, 1(1):34-37. |
| [15] | 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2003. |
| [16] | 郝建军, 刘延吉. 植物生理学实验技术[M]. 沈阳:辽宁科学技术出版社, 2001. |
| [17] | 袁淑珍, 栗淑媛, 乔辰. 低温胁迫对螺旋藻体内可溶性糖含量的影响[J]. 中国农学通报, 2008, 24(5):113-116. |




