一氧化氮(NO)作为内源性气体信号分子[1]在调节植物生长发育[2, 3, 4, 5, 6, 7, 8, 9]和胁迫响应[10, 11, 12, 13, 14, 15, 16, 17]等方面起着重要的作用。干旱是世界最为严重的自然灾害之一,据统计全球由于水分胁迫导致的作物减产,可以超过其他因素造成减产的总和[18]。而我国国土总面积的52.5%是干旱和半干旱地区[19],严重阻碍了农业和林业生产及生态环境的改善[20, 21]。
细胞骨架作为细胞生物学发展中较晚发现的一种新的细胞器,参与动植物的各种生长发育和生理活动[22],而真核生物细胞骨架的重要成分有微管、微丝和中间纤丝,其中微管主要由微管蛋白α、β亚基聚合形成直径为25 nm的中空管状结构,参与细胞形态的发生和维持、细胞内物质运输、细胞运动和细胞分裂等过程[23, 24]。干旱胁迫虽一直是植物研究热点,但是对于NO对干旱胁迫下白菜幼苗细胞骨架的影响还未见报道。
本研究以白菜幼苗为材料,研究聚乙二醇6000(PEG6000)模拟干旱处理和一氧化氮后续处理幼苗叶片中微管蛋白的含量的变化,以期探讨微管蛋白在PEG6000模拟干旱和PEG6000模拟干旱-一氧化氮复合处理后在植物中的功能,从而为研究NO气体信号分子对调控植物生长发育的作用和增强植物抗逆影响等方面提供理论依据。
1 材料与方法 1.1 材料津育11号白菜(Brassica rapa pekinensis)由山西省农业科学院蔬菜研究所提供。
1.2 方法 1.2.1 材料培养选取籽粒饱满大小均匀的白菜种子用次氯酸钠消毒3-5次,并用无菌水漂洗数次后,培养于铺有湿滤纸的培养皿内,30粒/盘,每组3次重复,温度(22±1)℃,相对湿度65%,光照强度180 μE/(m2·s),光周期为16/8 h(昼/夜),7 d后开始对白菜幼苗进行处理。设对照(CK)、PEG处理、PEG+NO处理、PEG+PTIO处理共4组。
1.2.2 PEG6000处理PEG处理参考张仪章[25]的方法,7日龄白菜幼苗,吸去培养皿中水分,分别加入15 mL不同质量浓度(15、18、21、24和27 g/mL)的PEG6000处理12 h。
1.2.3 一氧化氮处理NO供体硝普钠(sodium nitrop russide,SNP)购买自Sigma公司。经27 g/mL PEG6000干旱胁迫的白菜幼苗,分别再用浓度为50、100和150 μmol/L的NO密闭熏蒸处理24 h。
1.2.4 白菜幼苗叶片微管蛋白提取称取白菜幼苗叶片0.1 g(除去叶柄和叶脉),放入已加入1 mL微管蛋白提取缓冲液的预冷的研钵中,置于冰盒上研磨,用超高速离心机(Micro Ultracentrifuge GXⅡ Hitachi)离心(53 600×g,4℃,20 min),离心后取上清液[26]。
1.2.5 测定白菜幼苗叶片的微管蛋白含量参照李合生[27]方法,取上清液样品提取液20 μL,加蒸馏水780 μL,CBB 200 μL,总体积共1 mL,混匀后在595 nm下比色测定吸光值,并通过查实验室中已得的标准曲线[标准曲线公式:y=0.0019x+0.352,y为测出值,x为蛋白含量(μg)]计算得出蛋白质的含量。提取液样品中微管蛋白含量的计算公式如下:

用SDS-PAGE凝胶电泳,采用3%的浓缩胶和10%的分离胶,厚度为0.75 mm。上样前按体积比1∶1加入20 μL的提取液和20 μL的2×上样缓冲液,然后放入沸水中热处理3 min。点样20 μL,80 V电压下电泳30 min,接着换成130 V电压,电泳60 min。
1.2.7 NO含量的测定NO浓度的测定用硝酸还原酶法,按照NO浓度测试盒说明书进行测定,按上述公式计算NO浓度。
1.2.8 白菜NOS基因相对表达量的测定取不同处理组白菜幼苗叶片各0.05 g,提取RNA。BraNOS引物为F(5'-GCTCGTAGACTGCCTCTTC-3')和R(5'-GACGCTTGCCACGCGAGATAC-3');内参基因18S rRNA为F(5'-CCTGCATACCGCAGCTAGGA-3')和R(5'-GCGGCAATACGAATGCCCC-3'),由TaKa-Ra公司合成。采用2-△△CT方法对实时荧光定量PCR的结果进行基因表达的相对定量分析计算。
1.2.9 统计分析结果为3次重复的平均值,数据使用STATISTICA(Stat Soft Inc,Tulsa,OK)软件进行分析,多重比较用Duncan新复极差法。
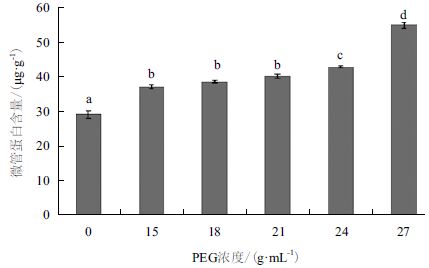
2 结果 2.1 干旱胁迫对白菜幼苗叶片微管蛋白含量的影响对照组和经不同浓度PEG6000(15、18、21、24和27 g/mL)处理后微管蛋白含量变化(图 1)显示,与对照组相比,PEG6000在5个浓度处理后的白菜幼苗微管蛋白含量都表现为增加的趋势,且PEG6000浓度越高,微管蛋白含量增加越明显,增加百分比分别为28.87%、34.51%、36.62%、44.37%和51.39%。因此选定27 g/mL作为干旱胁迫最佳处理浓度。
|
| 不同大小写字母分别表示处理在P<0.01、P<0.05 水平存在极显著差异和显著差异, 下同 图 1 不同浓度PEG 对白菜微管蛋白含量的影响 |
已有研究可知,纯化的微管蛋白主要由α亚基和β亚基以1∶1的二聚体形式存在,分子量大小是110 kD。经SDS-PAGE电泳(图 2)显示,出现分子量大约为53 kD的条带,而55 kD是微管蛋白单体分子量,推测可能是由于非共价键遭到破坏使所提取的白菜幼苗叶片微管蛋白发生解聚,因此该电泳图谱显示的是微管蛋白的单体分子量。此外,从图 2可看出对照组和各处理组的电泳条带大小基本相同,说明经干旱胁迫后的白菜幼苗叶片的微管蛋白都发生降解,且根据条带的粗细不同可知干旱胁迫浓度越高降解程度越大,与PEG浓度对白菜微管蛋白含量影响(图 1)得到的结果一致。

|
| 1-6 :PEG 浓度分别为0、27、24、21、18 和15 g/mL 图 2 不同浓度PEG 对白菜微管蛋白影响的SDS-PEG 凝胶电泳图 |
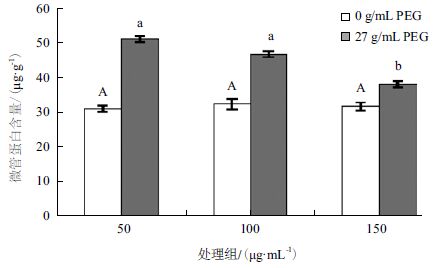
不同浓度的NO对对照组幼苗叶片中的微管含量的影响(图 3)表明,没有明显差异。而经过干旱胁迫后的白菜幼苗再经50、100和150 μmol/L 3个浓度的NO处理后,白菜幼苗叶片的微管蛋白含量分别有不同程度的下降。浓度为50 μmol/L时的作用并不明显,推测浓度偏低,对植物的影响较小。随着处理浓度的提高,微管蛋白含量发生较大的变化,浓度为150 μmol/L时能最大程度的降低胁迫后引起的微管蛋白含量的升高。说明在生理浓度范围内较高浓度NO在一定程度上对PEG6000模拟干旱胁迫处理的白菜幼苗叶片微管蛋白的解聚有一定的缓解作用。
|
| 图 3 外源NO 对干旱胁迫下白菜幼苗微管蛋白含量的影响 |
为进一步研究NO在白菜抵御干旱胁迫中的作用,用150 μmol/L的NO供体SNP和NO合成抑制剂PITO对白菜幼苗进行预处理,观察微管蛋白的含量变化。与对照组CK相比(图 4),PEG处理组微管蛋白含量大幅增加,胁迫后的幼苗再经NO处理后发现能在一定程度上降低微管蛋白的含量,这种降低又能被NO清除剂PITO抑制,表现出该组微管蛋白的含量低于干旱胁迫组却高于PEG+NO组,且差异显著。

|
| 图 4 不同处理组对微管蛋白含量的影响 |
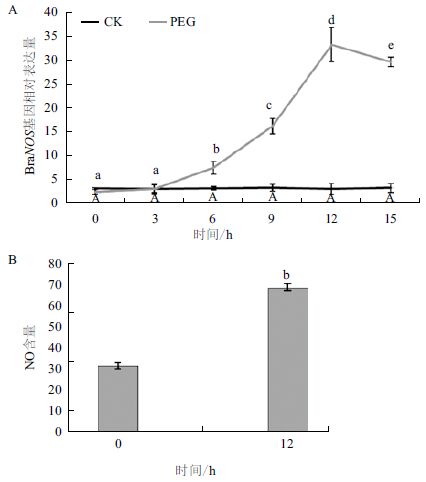
为了进一步探究外源NO对干旱胁迫后微管蛋白含量发生变化的原因,对白菜叶片中编码一氧化氮酶的基因和幼苗体内内源含量进行了测定。BraNOS是白菜体内产生一氧化氮酶的主要编码基因,白菜幼苗在经干旱胁迫后该基因的表达水平相对于未经处理的对照组都显著上调且在处理12 h后达到最高。同时叶片内源NO含量也显著升高(图 5),即在受到干旱胁迫后白菜幼苗体内NO含量显著升高,说明NO可能参与到白菜响应干旱胁迫的抗逆调节过程中。
|
| 图 5 干旱胁迫对白菜幼苗一氧化氮合酶基因表达量(A)和内源一氧化氮含量(B)的影响 |
植物微管的研究与动物微管相比较而言相对落后,其主要原因是从植物细胞中提取微管蛋白相对较困难。Morejohn等[28]首次在体外成功聚合在玉米、烟草、胡萝卜和玫瑰悬浮细胞中分离纯化得到的微管蛋白。目前我们已知微管骨架主要由微管蛋白和微管结合蛋白组成,并且通过其亚单位不断延伸和缩短发生踏车现象,从而改变它的存在状态。高素娟等[29]研究发现,光是其中一种调控微管组织的影响因素,且在受到化学试剂及环境胁迫时,体内胞质微管会迅速组装或解聚。程娜娜等[30]研究发现,当拟南芥叶片受到增强UV-B辐射累积到一定程度时,体内微管蛋白单体含量显著升高。时兰春[31]的研究表明,当膨压下降时,微管会弯曲、解聚甚至出现荧光斑点,微丝在质壁分离部位解聚,而在不发生质壁分离的部位其排布模式则发生改变;当膨压上升时,微丝解聚,但是微管随原生质体膨胀而被拉伸,不仅无解聚现象甚至可以观察到新微管合成。
本实验使用不同浓度PEG6000处理7日龄的白菜幼苗,采用SDS-PAGE聚丙烯酰胺凝胶电泳鉴定所提取的白菜幼苗叶片的微管蛋白。经5种不同PEG6000浓度下模拟干旱处理后,白菜幼苗叶片微管蛋白含量都呈现增加的趋势,推测由于PEG6000模拟干旱处理后,幼苗叶片中的微管发生了解聚,使体系中的微管蛋白的单体含量增加,而微管解聚可能是白菜幼苗在PEG6000模拟干旱处理下形成的自我保护功能,这与郭爱华[26]研究的小麦微管蛋白和程娜娜[30]研究拟南芥微管蛋白的结果一致。胁迫后再经3个浓度的NO复合处理时,随着NO浓度的增加,白菜幼苗叶片微管蛋白单体含量呈现逐渐减少的趋势,可能是生理浓度范围内较高浓度处理下,白菜幼苗叶片微管发生聚合,从而使测得的体系中微管蛋白单体含量降低。在干旱胁迫过程中植物为了应对干旱所造成的伤害,产生NO的相关基因表达量显著提高,同时体内NO含量也随之显著升高,而在没有干旱胁迫的对照组中编码NO的相关基因的相对表达量并没有发生显著变化。所以,NO可能参与到了白菜幼苗应对干旱胁迫的过程,并只在受到胁迫时才发生变化。综上所述,NO处理提高了植物的抗干旱能力,参与到了植物抗逆生理过程中。在PEG6000模拟干旱和NO熏蒸处理后,白菜幼苗叶片微管蛋白含量的增减,取决于PEG6000的浓度、NO的浓度和植物对PEG6000和NO的敏感程度差异。至于NO以何种机制影响干旱胁迫下白菜幼苗叶片微管蛋白的机理还有待进一步研究。
4 结论干旱胁迫下白菜幼苗生长受到抑制,白菜幼苗叶片中的微管蛋白发生解聚致使单体含量增加。经干旱胁迫后的白菜幼苗接着给予外源NO的处理,可以显著缓解干旱胁迫对白菜幼苗生长的抑制。与PEG组相比,PEG+NO处理组白菜幼苗叶片微管蛋白单体含量减少且差异显著,PEG+PITO组则几乎恢复到PEG组水平。在PEG干旱胁迫期间,白菜幼苗叶片内产生NO的主要基因BraNOS大量表达,与在此期间NO含量急剧升高的结果一致。说明在胁迫条件下,可以通过提高白菜幼苗体内NO含量来降低胁迫后微管蛋白的伤害程度,从而缓解干旱胁迫对白菜幼苗生长的抑制作用。
| [1] | 史庆华, 赖齐贤, 朱祝军, 等. 一氧化氮在植物中的生理功能[J]. 细胞生物学杂志, 2005, 6(1):39-42. |
| [2] | Del Rio LA. Peroxisomes as a cellular source of reactive nitrogen species signal molecules[J]. Arch Biochem Biophys, 2011, 506(1):1-11. |
| [3] | 于肇端. 外源NO缓解黄瓜、油菜幼苗胁迫的生理效应[D]. 泰安:山东农业大学, 2010. |
| [4] | Sanz L, Albertos P, Mateos I, et al. Nitric oxide(NO)and phytohormones crosstalk during early plant development[J]. J Exp Bot, 2015, 66(10):2857-2868. |
| [5] | Frohlich A, Durner J. The hunt for plant nitric oxide synthase(NOS):is one really needed?[J]. Plant Sci, 2011, 181(4):401-404. |
| [6] | Sirovfi J, Sedlfii-ovfi M, Piterkovfi J, et al. The role of nitric oxide in the germination of plant seeds and pollen[J]. Plant Sci, 2011, 181(5):560-572. |
| [7] | Bethke PC, Badger MR, Jonesa RI. Apoplastic synthesis of nitric oxide by plant tissues[J]. The Plant Cell, 2004, 16(2):332-341. |
| [8] | Rosales EP, Iannone MF, Groppa MD. Benavides MP. Polyamines modulate nitrate reductase activity in wheat leaves:involvement of nitric oxide[J]. Amino Acids, 2012, 42(2-3):857-865. |
| [9] | Kolbert Z, Ortega L, Erdei L. Involvement of nitrate reductase(NR)in osmotic stress—induced NO generation of Arabidopsis thaliana L. roots[J]. Plant Physiol, 2010, 167(1):77-80. |
| [10] | 赵敏桂. 气体信号分子一氧化氮和乙烯的生物学功能:一氧化氮在植物盐胁迫中的作用和乙烯激活钙离子通道[D]. 北京:中国科学院, 2008. |
| [11] | Jin CW, Du ST, Shamsi IH, et al. NO synthase--generated NO acts downstream of auxin in regulating Fe-deficiency-induced root branching that enhances Fe-deficiency tolerance in tomato plants[J]. J Exp Bot, 2011, 62(11):3875-3884. |
| [12] | Blokhina O, Fagerstedt KV. Oxidative metabolism, ROS and NO under oxygen deprivation[J]. Plant Physiol Biochem, 2010, 48(5):359-373. |
| [13] | 赵秀峰. 一氧化氮对水稻幼苗镉毒害的缓解效应及生理机制[D]. 南京:南京农业大学, 2012. |
| [14] | Hancock JT. NO synthase? Generation of nitric oxide in plants[J]. Period Biol, 2012, 114(1):19-24. |
| [15] | Bettina S, Buchmaie R, Asima B, et al. Renal cells express different forms of vimentin:the independent expression alteration of these forms is important in cell resistance to osmotic stress and apoptosis[J]. PLoS One, 2013, 8(7):e68301. |
| [16] | Liao WB, Huang GB, Yu JH, et al. Nitrc oxide and hydrogen peroxide alleviate drought stress in marigold explants and promote its adventitious root development[J]. Plant Physiol Biochem, 2012, 58(9):6-15. |
| [17] | Moreau M, Lindermayr C, Durner J, Klessig DF. NO synthesis and signaling in plants—where do we stand?[J]. Physiol Plant, 2010, 138(4):372-383. |
| [18] | 魏晓雪. 外源NO对UV-B胁迫下红松生理特性的影响[D]. 哈尔滨:东北林业大学, 2011. |
| [19] | 余叔文, 汤章程. 植物生理与分子生物学[M]. 第2版. 北京:科学出版社, 1998. |
| [20] | 柯贞进, 尹美强, 温银元, 等. 干旱胁迫下聚丙烯酰胺对谷子种子萌发及幼苗期抗旱性的影响[J]. 核农学报, 2015, 29(3):563-570. |
| [21] | 裴帅帅, 尹美强, 温银元, 等. 不同品种谷子种子萌发期对干旱胁迫的生理响应及抗旱性评价[J]. 核农学报, 2014, 28(10):1897-1904. |
| [22] | 刘小敏. 拟南芥微管结合蛋白WDL3调控下胚轴生长的分子机理[D]. 北京:中国农业大学, 2014. |
| [23] | 张运刚. 微管骨架在拟南芥根响应渗透胁迫中的作用[D]. 重庆:重庆大学, 2012. |
| [24] | 林抒豪, 石玉秀, 韩芳. 细胞凋亡与真核细胞骨架蛋白相关性的研究进展[J]. 解剖科学进展, 2015, 21(2):207-210. |
| [25] | 李翠芳. 外源一氧化氮对盐胁迫下棉苗主要形态和生理性状的影响[D]. 保定:河北农业大学, 2012. |
| [26] | 郭爱华. He-Ne 激光和增强 UV-B 辐射对小麦幼苗微管蛋白及微管骨架的影响[D]. 临汾:山西师范大学, 2010. |
| [27] | 李合生. 现代植物生理学[M]. 北京:高等教育出版社, 2002:415-419. |
| [28] | 廖俊杰, 吴英杰, 阎隆飞. 萱草花粉中微管蛋白生物化学性质[J]. 云南植物研究, 2006, 28(4):425-428. |
| [29] | 高素娟, 张丽丽, 王小菁. 微管动态不稳定性及其微管排向的光调控[J]. 天水师范学院学报, 2009, 29(5):16-19. |
| [30] | 程娜娜, 刘福霞, 马爱珍, 韩榕. 增强UV-B辐射对拟南芥叶片微管蛋白的影响[J]. 生物学杂志, 2013, 30(4):33-37. |
| [31] | 时兰春, 王伯. 微丝、微管骨架在拟南芥细胞机械响应中的作用[D]. 重庆:重庆大学, 2011. |



