2. 江南大学生物工程学院 工业生物技术教育部重点实验室,无锡 214122
2. Key Laboratory of Industrial Biotechnology of Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122
L-茶氨酸(L-Theanine,L-The)由日本科学家于1949年首次从绿茶中分离得到[1],是茶叶中特有的游离氨基酸,是天然茶叶中的重要风味物质,具有抑制苦味物质、改善产品风味的作用。同时L-The还有镇静放松[2, 3]、降低血压[4, 5]、控制体重[6]、增强免疫应答[7, 8]、预防肿瘤[9, 10, 11]等功效,因此在食品添加剂和保健品中被广泛应用。L-The自然界含量极少,从茶叶中提取成本很高,因此化学合成法是目前研究的主要方向。但是化学合成法存在反应时间长、收率低等缺点,同时由于需要采用高压惰性气体保护,因而生产成本居高不下。近年来,微生物发酵法和酶转化法已成为研究的热点。
γ-谷氨酰转肽酶(γ-Glutamyltranspeptidase,GG-T,EC 2.3.2.2)是谷胱甘肽代谢途径中的一个关键酶,2002年Suzuki等[12]研究报道,Escherichia coli K-12来源的GGT酶可以将L-谷氨酰胺(L-Gln)上的γ-谷氨酰基转移到乙胺受体上,催化合成L-The。由于这一过程位点特异性和光学选择性强,无需对反应物进行保护和脱保护,反应过程中也不消耗ATP,因此利用GGT酶转肽活性制备系列γ-谷氨酰基类化合物的研究成为生物催化领域的热点。
在实验室前期工作中已对GGT酶制备茶氨酸进行了初步研究,在L-Gln浓度为200 mmol/L时,L-The的摩尔转化率为78%,同时发现L-The的摩尔转化率随L-Gln浓度的升高而降低,在底物浓度为500 mmol/L和1 000 mmol/L时,转化率分别为58%和45%,产物浓度分别为290.2 mmol/L和450 mmol/L[12],目前对高底物浓度条件合成L-The的研究尚无报道。在工业化生产中,较高的底物浓度可大大降低L-The的生产成本,因此本研究采用不同的补料策略,以期提高L-The在高浓度底物下的产量,为L-The的酶法工业化制备奠定基础。
1 材料与方法 1.1 材料菌种为实验室保存,L-Gln(上海生工生物工程股份有限公司),乙胺盐酸盐(上海生工生物工程股份有限公司),L-The标品(Sigma公司),其他试剂均为国产分析纯。
1.2 方法 1.2.1 粗酶液制备菌种活化后按体积分数2%的接种量接入发酵培养基中,25℃、200 r/min 培养48 h,装液量为250 mL发酵瓶装50 mL。培养结束后将培养液以8 000 r/min离心20 min,收集上清液。
1.2.2 GGT酶活测定方法以γ-谷氨酰对硝基苯胺和双甘二肽为底物进行颜色反应[13]。酶活测定体系为1 mL,含终浓度为5 mmol/L γ-谷氨酰对硝基苯胺,80 mmol/L 双甘二肽,50 mmol/L 硼砂-NaOH缓冲液,pH10.0,在37℃下加入20 μL适当稀释的酶液反应5 min后,加入4 mol/L醋酸溶液400 μL终止反应,在分光光度计410 nm处测定吸光值。该条件下每分钟生成1 μmol对硝基苯胺所需的酶量定义为一个酶活单位(U)。
1.2.3 酶法合成L-The取一定浓度的L-Gln和乙胺盐酸盐用硼砂-NaOH缓冲液溶于500 mL烧杯中,加入一定量酶液,调节pH为10.0,体系终体积为300 mL,放置于37℃恒温水浴锅,以150 r/min的搅拌转速进行酶反应,定时取样进行分析。
1.2.4 L-The的检测以高效液相色谱(HPLC)检测分析产物浓度[14]。
1.2.4.1 样品处理反应液取样后用10%(W/V)的三氯乙酸等体积稀释,室温放置1-2 h,12 000 r/min离心10 min,再用0.22 μm水相针式滤器过滤,此时样品可于HPLC检测。
1.2.4.2 流动相配置A相(1 L):无水醋酸钠4.52 g,加入1 L去离子水,搅拌溶解,再加入225 μL三乙胺,醋酸调节pH到7.2±0.05,后加入5 mL四氢呋喃,混合后备用。
B相(1 L):无水醋酸钠4.52 g,去离子水定容为200 mL,醋酸调节pH到7.2±0.05,再加400 mL 甲醇(色谱纯)和400 mL乙腈(色谱纯)。
A,B 相配置完毕后需用无油真空泵过膜抽滤,其中A 相使用0.22 μm 的纤维素膜,B 相使用0.45 μm尼龙膜,并将抽滤后的流动性与超声清洗器中超声15-30 min 排除气泡。
1.2.4.3 衍生化试剂及程序柱前衍生化反应采用邻苯二甲醛(OPA)与2-巯基乙醇联用,缓冲液为0.4 mol/L的硼酸缓冲液(pH10.2),具体试剂配方和柱前衍生化程序由Agilent公司提供。
1.2.4.4 HPLC色谱条件检测系统:Agilent 120;色谱柱:Eclipse XDB-C18 5 μm(4.6 mm×150 mm);流动相:乙腈一水(75∶25);流速:0.8 mL/min;柱温:40℃;紫外检测波长:338 nm。
梯度洗脱程序:流动相完全由A、B 两相组成,初始比例为A∶B = 92∶8(V/V),一个样品分离时间为20 min,流动相混合比例呈匀速线性变化,具体条件为:0-12 min,B 相为8%-26%(V/V);12-14 min,B 相为26%-100%(V/V);14-15.5 min,B 相保持100%(V/V);15.5-18.5 min,B 相为8%-100%(V/V);18.5-20 min,B 相保持8%(V/V)。
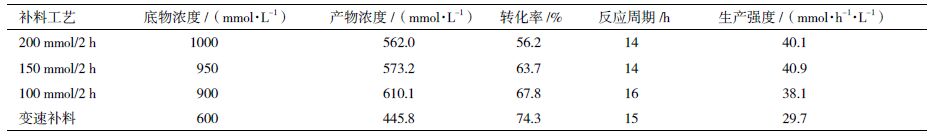
1.2.5 L-The产率的计算L-The摩尔转化率公式:
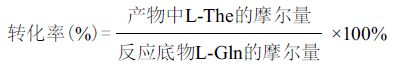
前期研究表明,采用酶转化法生产L-The时,底物浓度过高会导致L-The转化率下降,其原因主要是因为高浓度的底物L-Gln对GGT酶具有抑制作用,因此考虑使用较低的初始底物浓度,反应过程中补加L-Gln的补料策略以实现L-The的高浓度底物高转化率生产。为确定补料过程的初始条件,首先研究了不同底物浓度和不同加酶量对L-The合成的影响。根据前期工作的结果,GGT酶催化合成L-The在底物浓度较低的条件下反应速度较快,且转化率较高[13],因此选择研究L-Gln浓度为200 mmol/L和100 mmol/L 条件下,研究不同加酶量对反应的影响。
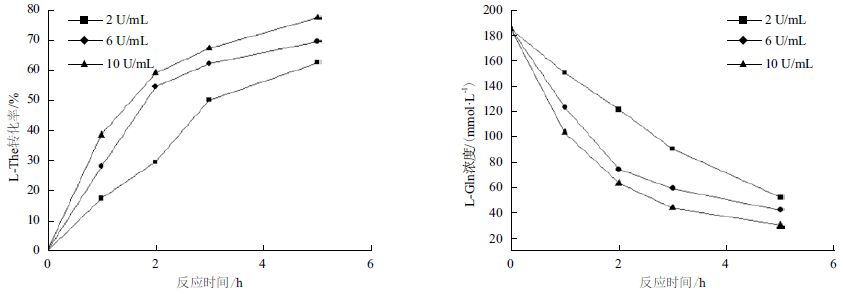
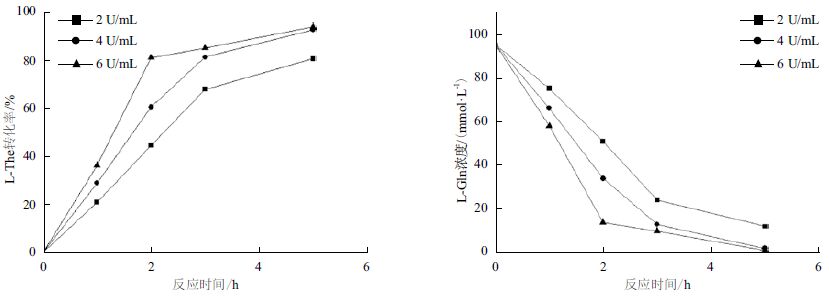
首先以200 mmol/L L-Gln和2 mmol/L乙胺盐酸盐为底物,研究加酶量为2、6和10 U/mL时,对L-The合成的影响。结果(图 1)显示,在加酶量为2 U/mL时,酶转化在前3 h反应较快,后2 h反应逐渐趋于平衡;而在加酶量为6 U/mL 和10 U/mL时,酶转化在前2 h反应较快,后3 h反应逐渐平衡。在反应进行至2 h时,L-The对底物L-Gln的摩尔转化率分别为29.5%、54.4%和58.9%,反应5 h转化率分别为62.4%、69.3%和77.1%。以100 mmol/L L-Gln和1 mol/L乙胺盐酸盐为底物,研究加酶量为2、4和6 U/mL时对L-The合成的影响。结果(图 2)显示,当加酶量分别为2、4和6 U/mL,反应进行至2 h时,L-The对L-Gln的摩尔转化率分别为44.2%、60.2%和80.9%,最终转化率分别为80.4%、92.5%和93.6%。
|
| 图 1 L-Gln 初始浓度为200 mmol/L 的过程曲线 |
|
| 图 2 L-Gln 初始浓度为100 mmol/L 的过程曲线 |
综上所述,在不同底物浓度的条件下,加酶量为2 U/mL时,酶反应在前3 h速率较快,加酶量为6 U/mL和10 U/mL时,酶反应都在前2 h速率较快,2 h后反应速率降低,因此初步确定以2 h作为后续补料过程的补料间隔。图 1和图 2显示,底物L-Gln浓度为200 mmol/L,加酶量6 U/mL与10 U/mL相差7.8%,但是比2 U/mL有明显提高,所以加酶量6 U/mL是最优条件,此条件下反应2 h产物浓度达到120 mmol/L左右。而在L-Gln浓度为100 mmol/L时,反应2 h产物浓度最高仅能达到80 mmol/L,由于工业生产追求的是高产量,也就是较高的产物浓度,所以选择底物浓度200 mmol/L,加酶量6 U/mL作为后续补料过程的初始条件。
2.2 酶转化生产L-The恒速补料策略研究以200 mmol/L L-Gln和2 mol/L乙胺盐酸盐为初始底物,加酶量为6 U/mL,在pH 10.0和37℃条件下,研究不同的补料量对L-The合成的影响。由于将底物维持在较低浓度能保持较高的反应速率,所以选择每2 h进行恒速补料,L-Gln补料量分别为200、150和100 mmol。
首先以每2 h添加200 mmol L-Gln固体粉末的补料方式,研究对L-The合成的影响。由于合成L-The的反应要求L-Gln与乙胺盐酸盐的摩尔比在1∶5-1∶10范围内,因此在反应过程中每4 h补加400 mmol乙胺固体以保证乙胺盐酸盐的浓度。结果(图 3)显示,底物L-Gln在反应前4 h消耗较大,每2 h浓度下降120 mmol/L左右,随着反应进行,L-Gln消耗速率逐渐降低,反应至4-6 h时,L-Gln消耗速率为89.5 mmol/L,6-8 h为80.4 mmol/L,分析原因是由于随着酶转化反应进行,反应液L-Gln和L-The浓度都逐渐上升,正逆反应速度逐渐达到平衡,致使反应速率进一步下降。8-11 h和11-14 h底物浓度下降仅为37.6 mmol/L和22.5 mmo/L。反应至14 h最终L-Gln的总浓度为1 000 mmol/L,L-The的浓度达到562 mmol/L,转化率为56.2%。
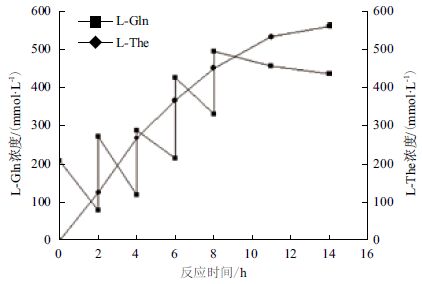
|
| 图 3每2 h 补料200 mmol 的恒速补料过程曲线 |
以每2 h添加150 mmol L-Gln固体粉末,每4 h补加400 mmol乙胺盐酸盐固体的补料方式,研究对L-The生产的影响。结果(图 4)显示,L-Gln在反应前6 h消耗较快,每2 h消耗量为120 mmol/L左右,6 h后L-Gln消耗速率降低,6-8 h底物消耗量为97.6 mmol/L,8-10 h底物消耗量为56.4 mmol/L,10 h后反应速率大幅下降,反应在14 h左右时达到平衡。最终L-Gln的总浓度为950 mmol/L,L-The的浓度达到573 mmol/L,转化率为63.7%。
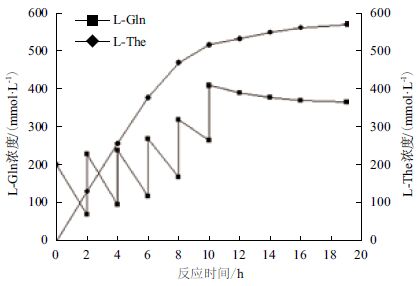
|
| 图 4 每2 h 补料150 mmol 的恒速补料过程曲线 |
研究以每2 h添加100 mmol L-Gln固体粉末,每4 h补加400 mmol乙胺盐酸盐固体的补料方式对酶转化的影响。结果(图 5)显示,L-Gln在反应前8 h消耗很快,每2 h消耗量为120 mmol/L左右,8 h后L-Gln消耗略有降低,8-10 h L-Gln消耗量为80.3 mmol/L,10-12 h为54.8 mmol/L,12 h后反应速率下降,L-Gln几乎不消耗。而L-The在前12 h的合成速率都较大,12 h后速率下降,约在16 h达到平衡。最终L-Gln的总浓度为900 mmol/L,L-The的浓度达到610.1 mmol/L,转化率为67.8%。

|
| 图 5 每2 h 补料100 mmol 的恒速补料过程曲线 |
根据上述的结果,在恒速补料的情况下,反应初期底物浓度较低,所以反应速率较快,而反应后期由于底物的累积导致反应变慢,逐渐达到平衡。因此尝试采用变速补料的工艺,以200 mmol/L L-Gln和2 mol/L乙胺盐酸盐为初始底物,加酶量为6 U/mL,在pH10.0和37℃条件下,每2 h测定L-Gln的含量,从而确定补加L-Gln的量,保证补料后L-Gln浓度为200 mmol/L,同时每4 h添加400 mmol乙胺盐酸盐固体,研究变速补料对L-The合成的影响。结果(图 6)显示,每2 h所需补加的L-Gln量在反应前期较多,随着反应进行,反应速率降低,补加的底物逐渐减少,反应进行到18 h后,反应液中底物浓度几乎不变,可以认为反应已经达到平衡,所以不再进行补料。最终L-Gln总浓度为600 mmol/L,L-The浓度最终达到445.8 mmol/L,转化率为74.3%。
2.4 不同补料工艺的研究通过对恒速补料和变速补料工艺的比较发现,不同的转化工艺所需的反应周期不同,产生的L-The的浓度也不同。表 1显示,从转化率角度,变速补料工艺的转化率最高,达74.3%,但所达到的底物浓度仅为600 mmol/L,导致生产强度较低,为29.7 mmol/(h·L),远低于恒速补料的生产强度。而比较不同的恒速补料策略,生产强度差异较小,转化率和产物终浓度都以100 mmol/2 h恒速补料工艺最高,达67.8%和610.1 mmol/L,基本满足了L-The在高底物浓度条件下能达到高转化率和高产物浓度的要求。因此,以100 mmol/2 h恒速补料进行茶氨酸的生产最能适应工业化生产要求。
L-The作为一种具有重要价值的非蛋白氨基酸,已经成为研究茶叶中功能活性成分的热点。目前L-The的合成主要以化学合成法为主,但是化学合成得到的产物存在一定的安全性问题,同时容易产生DL-型消旋体,因此近年来以酶法合成L-The逐渐被广泛研究。
2002年,来自日本的Suzuki等[15]利用GGT酶,以200 mmol/L的L-Gln和1.5 mol/L的乙胺为底物合成L-The,转化率可达到60%,产物浓度为120 mmol/L。Shuai等[16]以20 mmol/L的L-Gln和0.05 mol/L的乙胺为底物,L-The的转化率达到94%,产物浓度为18.8 mmol/L。孙帅[17]以200 mmol/L的L-Gln和1.8 mol/L乙胺合成L-The,反应36 h转化率达到86%,产物浓度达到172 mmol/L。李勤等[18]将来源于E. coli DH5α的GGT酶基因克隆到高表达质粒pET-32α中,并转化E. coli BL21,构建茶氨酸生物合成的工程菌,直接以工程菌为催化剂,以L-Gln和乙胺盐酸盐为底物,在一定条件下反应6 h,L-The转化率为41.05%。
利用其它酶转化L-The的研究也有报道。1998年,Tachiki等[19]利用谷氨酰胺酶,以500 mmol/L的L-Gln和1.5 mol/L的乙胺为底物,L-The的转化率为47%,产物浓度为235 mmol/L。2005年,Yamamoto等[20]报道了以200 mmol/L的L-谷氨酸钠和1.2 mol/L的乙胺为底物,L-The的转化率达到85%,浓度为170 mmol/L的产物。2008年,Tachiki等[21]以300 mmol/L的L-Gln和0.9 mol/L的乙胺为底物,获得L-The的转化率为55%,浓度为165 mmol/L的产物。Yokoyama和Itoh[22, 23]分别报道了一种在介孔硅材料上固定化谷氨酰胺酶,再由其催化合成L-The的方法。2008年,Yamamoto等[24]利用γ-谷氨酰甲胺合成酶,以600 mmol/L的L-谷氨酸钠和0.6 mol/L的乙胺为底物,L-The的转化率可达到100%,产物浓度达到600 mmol/L。
传统的酶转化过程中,在底物浓度较低的情况下,L-Gln消耗速率较快,L-The合成速度快;而在高底物浓度下,L-Gln消耗减慢,产物合成速率较慢。因此本实验研究了不同的补料方法,并通过比较得出以200 mmol/L的L-Gln和2 mol/L的乙胺盐酸盐为初始底物,加酶量6 U/mL,每2 h补加100 mmol L-Gln,反应16 h为最优工艺。在最优条件下L-The的转化率可以达到67.8%,产物浓度达到610.1 mmol/L,生产强度为38.1 mmol/(h·L)。
4 结论通过采用恒速补料和变速补料的策略,在L-Gln浓度为900 mmol/L和600 mmol/L时,转化率分别达到67.8%和74.3%,生产强度分别为38.1 mmol/(h·L)和29.7 mmol/(h·L)。本研究通过补料工艺进行L-The的合成,即使在高底物浓度下,仍能获得令人满意的底物转化率,且步骤简单,成本低廉,具有较好的应用前景。
| [1] | Sakato Y. The chemical constituents of tea:III. A new amide theanine[J]. Nippon Nogeik Kaishi, 1949, 23:262-267. |
| [2] | Juneja LR, Chu DC, Okubo T, et al. L-theanine:a unique amino acid of green tea and its relaxation effect in humans[J]. Trends Food Sci Tech, 1999, 10(6-7):199-204. |
| [3] | Kakuda T, Nozawa A, Unno T, et al. Inhibiting effects of theanine on caffeine stimulation evaluated by EEG in the rat[J]. Biosci Biotechnol Biochem, 2000, 64(2):287-293. |
| [4] | Yokogoshi H, Mochizuki M, Saitoh K. Theanine-induced reduction of brain serotonin concentration in rats[J]. Biosci Biotechnol Biochem, 1998, 62(4):816-817. |
| [5] | Yokogoshi H, Kato Y, Sagesaka YM, et al. Reduction effect of theanine on blood pressure and brain 5-hydroxyindoles in spontaneously hypertensive rats[J]. Biosci Biotechnol Biochem, 1995, 59(4):615-618. |
| [6] | Zheng G, Sayama K, Okubo T, et al. Anti-obesity effects of three major components of green tea, catechins, caffeine and theanine in mice[J]. In Vivo, 2004, 18(1):55-62. |
| [7] | Kamath AB, Wang LS, Das H, et al. Antigens in tea-beverage prime human Vγ2Vδ2 T cells in vitro and in vivo for memory and nonmemory antibacterial cytokine responses[J]. Proc Natl Acad Sci USA, 2003, 100(10):6009-6014. |
| [8] | Bukowski JF, Percival SS. L-theanine intervention enhances human γδ T lymphocyte function[J]. Nutr Rev, 2008, 66(2):96-102. |
| [9] | Zhang G, Miura Y, Yagasaki K. Effects of dietary powdered green tea and theanine on tumor growth and endogenous hyperlipidemia in hepatomabearing rats[J]. Biosci Biotechnol Biochem, 2002, 66(4):711-716. |
| [10] | Sadzuka Y, Sugiyama T, Suzuki T, et al. Enhancement of the activity of doxorubicin by inhibition of glutamate transporter[J]. Toxicol Lett, 2001, 123(2-3):159-167. |
| [11] | Sugiyama T, Sadzuka Y. Theanine and glutamate transporter inhibitors enhance the antitumor efficacy of chemotherapeutic agents[J]. Biochim Biophys Acta, 2003, 1653(2):47-59. |
| [12] | Chen X, Su L, Wu D, Wu J. Application of recombinant Bacillus subtilis γ-glutamyltranspeptidase to the production of L-theanine[J]. Process Biochemistry, 2014, 49:1429-1439. |
| [13] | Orlowski M, Meister A. Gamma-glutamyl-p-Nitroanilide:a new convenient substrate for determination and study of L- and D-γ-glutamyltranspeptidase activities[J]. Biochem Biophy Acta, 1963, 73(4):679. |
| [14] | 陈星奕. Bacillus subtilis γ-谷氨酰转肽酶的表达及其在茶氨酸制备中的应用[D]. 无锡:江南大学, 2014. |
| [15] | Suzuki H, Izuka S, Miyakawa N, Kumagai H. Enzymatic production of theanine, an “umami” component of tea, from glutamine and ethylamine with bacterial gamma-glutamyltranspeptidase[J]. Enzyme Microb Technol, 2002, 31(6):884-889. |
| [16] | Shuai Y, Zhang T, Jiang B, Mu W. Development of efficient enzymatic production of theanine by gamma-glutamyltranspeptidase from a newly isolated strain of Bacillus subtilis SK11. 004[J]. J Sci Food Agric, 2010, 90(15):2563-2567. |
| [17] | 孙帅. 谷氨酰胺酶和γ-谷氨酰转肽酶酶法合成L-茶氨酸的研究[D]. 南京:南京大学, 2013. |
| [18] | 李勤, 黄建安, 李娟, 等. 茶氨酸生物合成基因工程菌的构建及重组酶的表达[J]. 湖南农业大学学报:自然科学版, 2011, 37(3):267-270. |
| [19] | Tachiki T, Yamada T, Mizuno K, et al. γ-Glutamyl transfer reactions by glutaminase from Pseudomonas nitroreducens IFO 12694 and their application for the syntheses of theanine and γ-glutamylmethylamide[J]. Biosci Biotechnol Biochem, 1998, 62(7):1279-1283. |
| [20] | Yamamoto S, Wakayama M, Tachiki T. Theanine production by coupled fermentation with energy transfer employing Pseudomonas taetrolens Y-30 glutamine synthetase and Baker’s yeast cells[J]. Biosci Biotechnol Biochem, 2005, 69(4):784-789. |
| [21] | Tachiki T, Okada Y, Ozeki M, et al. Process for producing theanine[P]. US Patent, US 7335497, 2008-02-26. |
| [22] | Yokoyama T, Ishii R, Itoh T, et al. Synthesis of l-theanine using euzyme/mesoporous silica conjugates under high pH conditions[J]. Materials Letters, 2011, 65(1):67-69. |
| [23] | Itoh T, Hoshikawa Y, Matsuura S, et al. Production of L-theanine using glutaminase encapsulated in carbon-coated mesoporous silica with high pH stability[J]. Biochemical Engineering Journal, 2012, 68:207-214. |
| [24] | Yamamoto S, Morihara Y, Wakayama M, Tachiki T. Theanine production by coupled fermentation with energy transfer using γ-glutamylmethylamide synthetase of Methylovorus mays No. 9[J]. Biosci Biotechnol Biochem, 2008, 72(5):1206-1211. |