每年植物通过光合作用产生的木质纤维素类物质约7.2 ×1010 t,如此大量的生物质可以为人类的可持续发展提供丰富的再生能源[1]。但是由于结构的特殊性,木质纤维素的利用一直受到限制[2]。微生物生产的纤维素酶能够把纤维素降解成小分子糖,进一步发酵生产能源类物质[3, 4]。目前工业上用于纤维素酶生产的菌种主要是各种真菌,包括木霉属(Trichoderma)、曲霉属(Aspergillus)和青霉属(Penicillium)等[5],但不同菌株的最佳产酶条件和促进剂作用多有不同,每种菌株所产纤维素酶若不能发挥其全部潜能,将严重影响纤维素酶的降解效率[6, 7]。本实验从腐殖土壤样品中分离一株产纤维素酶降解菌,通过对其发酵产酶条件优化和产酶组成分析,旨为纤维素酶菌株的生产应用提供参考。
1 材料与方法 1.1 材料 1.1.1 实验样品实验样品采自大连市不同地区20个含有腐木、腐烂秸秆的土样及牛粪等。
1.1.2 实验试剂化学试剂均为分析纯。引物合成及DNA测序由上海生工生物工程有限公司完成。
1.1.3 培养基组分羧甲基纤维素钠培养基:CMC-Na 10 g,(NH4)2SO4 4 g,KH2PO4 1 g,MgSO4·7H2O 0.5 g,蛋白胨1.0 g,琼脂16 g,加水至1 L,1×105 Pa灭菌30 min。
纤维素刚果红鉴别培养基(参照文献[8]稍有改进):(NH4)2SO4 2.0 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,KH2 PO4 1.0 g,微晶纤维素 2.0 g,刚果红0.4 g,琼脂 20 g,加水至1 L,1×105 Pa灭菌30 min。
滤纸液体培养基:滤纸 0.5 g,(NH4)2SO4 20.0 g,尿素 3.0 g,蛋白胨 3.0 g,CaCl2 3.0 g,MgSO4·7H2O 5.0 g,NaCl 0.1 g,FeSO4·7H2O 50.0 mg,MnSO4·7H2O 16.0 mg,ZnSO4·7H2O 14.0 mg,COCl2 20.0 mg,加水至1 L,1×105 Pa灭菌30 min。
发酵培养基:麸皮 30 g,(NH4)2SO4 3.0 g,KH2PO4 2.0 g,加水至1 L,1×105 Pa灭菌30 min。
1.2 方法 1.2.1 菌株的筛选每份土样10.0 g,加入无菌水,28℃,200 r/min 振荡培养48 h 后,取上清液。采取梯度稀释法,按照10-1-10-8浓度分别涂布于羧甲基纤维素筛选培养基上,30℃暗培养3 d。挑取长势好的菌株转接到刚果红培养基,挑选显示有透明圈的菌株接入PDA 培养基进行纯化[9]。纯化3代后,接入滤纸液体培养基,30℃,180 r/min 震荡培养7 d,测试滤纸崩解率[10]。
滤纸崩解率(%)=(发酵前的滤纸条重量-发酵后的滤纸条的重量)/ 发酵前的滤纸条重量×100%
1.2.2 菌株的鉴定形态、培养和生理生化特征鉴定参照《真菌鉴定手册》进行。
DNA提取采用Sangon真菌提取试剂盒。以提取的基因组DNA为模板,真菌通用引物ITS1:(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4:(5'-T-CCTCGCCTTATTGATATGC-3')[11]为引物进行PCR扩增,反应体系25 μL。PCR反应条件:94℃预变性5 min;94℃ 1 min,54℃ 1 min,72℃ 2 min,35个循环;72℃延伸10 min。
PCR产物测序由Songon 公司完成。测序结果应用MEGA5.0 软件包构建系统发育树[12]。
1.2.3 纤维素酶酶活力测定和定义分别以1%(W/V)羧甲基纤维素钠、50 mg(1 cm×6 cm)新华滤纸、0.5%水杨苷为底物,在50℃下分别反应60 min、30 min 和30 min,在540 nm 紫外波长下,用DNS法测定滤纸酶(FPA)、β-1,4-内切葡聚糖酶(CMCase)、β-糖苷酶(BGL)[13]酶活。
酶活定义:在50℃条件下,相应底物在酶的作用下,每分钟产生1 μmol 葡萄糖所需酶量为一个酶活力单位,用 IU/mL表示[14]。
1.2.4 菌株初始pH、碳源、氮源及金属离子的确定将基础发酵培养基初始pH值分别调至1.0、2.0、3.0、4.0、5.0、6.0、7.0和8.0,测定不同pH条件下菌株产酶活性。分别用麸皮、滤纸、CMC-Na、玉米粉代替基础发酵培养基中碳源,用豆粉、硫酸铵、尿素、酵母粉、蛋白胨代替氮源,添加不同种类金属离子,30℃,180 r/min发酵培养144 h,测定不同碳、氮源及金属离子对菌株酶活的影响[15]。
1.2.5 不同种类表面活性剂对菌株产酶影响在优化后的培养基中分别加入EDTA二钠、SDS、PEG、鼠李糖脂及卵磷脂,30℃,180 r/min发酵培养144 h,测定不同表面活性剂对菌株JG产酶的影响[16, 17]。
1.2.6 纤维素酶SDS-PAGE分析菌株JG在优化后的培养基中,30℃,180 r/min 发酵培养144 h,粗酶液经40%乙醇沉淀、浓缩后,上样于15%的分离胶和5%的浓缩胶中进行SDS-PAGE电泳,以标准纤维素酶(上海Songon公司)及商品化酸性纤维素酶(山东龙元生物工程有限公司食品添加、纺织用工业酸性纤维素酶)作为对照。
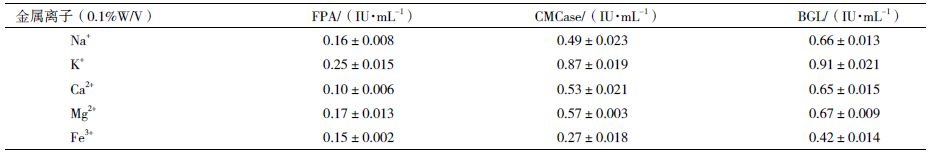
2 结果 2.1 菌株的筛选选取CMC-Na培养基上长势良好的10个菌株,分离纯化后分别命名为Y-1、JG-1、TNL-1、TNL-2、XTNL-1、HTNL-2、WHXTNL、LZ、JG-2和VI。从菌落生长形态判断Y-1和VI为放线菌;TNL-1和TNL-2为细菌;JG、XTNL-1、HTNL-2、WHXTNL、LZ和JG为真菌。进一步测试各菌株对滤纸崩解程度发现,JG滤纸崩解率最高,为19.7%。图 1为JG在刚果红鉴别培养基上产生的透明圈及其在PDA培养基上生长5 d的形态,可以看出菌落呈明显青绿色,表面为粉粒状,初步确定JG为真菌。液体培养结果测得,JG的CMCase酶活性为 0.435 IU/mL,明显高于其他菌株,故选择JG进一步研究。
|
| 图 1 菌株JG形态特征 |
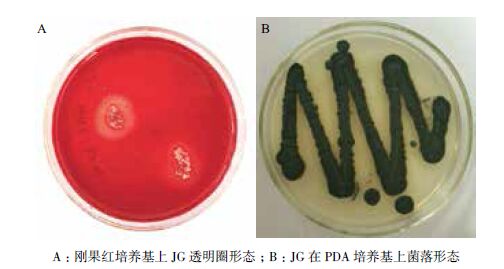
PCR扩增获得的序列长度为564 bp,GenBank序列登录号为KC880081.1,与Penicillium oxalicum strain QHBC11相似性最大,为99%,初步确定该菌株为一株草酸青霉菌,命名为Penicillium oxalicum JG(图 2)。
|
| 图 2 菌株JG基因系统发育进化树 |
培养基发酵初始pH值对菌株JG产酶活性影响结果(图 3)表明,菌株以麸皮为底物,初始pH在2.0-3.0时,所产纤维素总的酶活性最高,当初始pH>5.0时,酶活开始明显下降。在发酵过程中还发现,4.0时该菌产酶最适pH值。

|
| 图 3 不同初始发酵的pH值对纤维素酶活影响 |
发酵初始pH2.5条件下,菌株JG在以CMC-Na和麸皮为底物时,诱导产生的CMCase和BGL均表现出较高的酶活力(表 1),外切纤维素酶活也明显高于其他种类的碳源(表中未列出),但是以CMC-Na为碳源的FPA略低于以麸皮为碳源时的活力。通常情况下,CMCase作为水解纤维素聚合链的第一步反应酶,其活力大小起着重要作用,故选取CMCase酶活表现较高的CMC-Na作为JG发酵培养的最适碳源。
在发酵初始pH2.5,碳源为CMC-Na的条件下优化氮源的结果(表 2)显示,豆粉作为有机氮源更容易被菌株利用,且对提高菌株酶活力有明显的促进作用。故选择豆粉作为发酵培养基的最适氮源。
金属离子通常作为酶的活性中心的组成部分,对调节维持微生物细胞渗透压以及维持细胞结构的稳定性具有重要的作用。在培养基中分别加入Na+、Mg2+、Ca2+、K+和Fe3+,测定不同金属离子对菌株发酵酶活的影响,结果(表 3)显示,金属离子对纤维素酶活的影响相对较小,但是K+对酶活有一定的促进作用。因此,在菌株发酵过程中可以添加少量的K+作为促进剂。
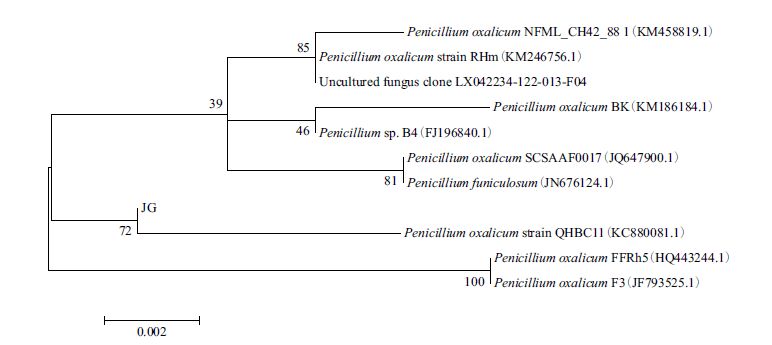
络合剂EDTA二钠和阴离子表面活性剂SDS,对菌株JG产生FPA、CMCase、BGL三种酶活性均有明显的抑制作用(图 4)。PEG、卵磷脂和鼠李糖脂都是非离子表面活性剂,它们对JG产生的纤维素酶活性却有一定的促进作用,其中PEG促进作用较小,并且对CMCase、BGL酶活性的产生抑制作用,但能提高FPA酶活性;而鼠李糖脂和卵磷脂却有明显的促进作用。但是鼠李糖脂价格较高,将增加工业应用的生产成本,相比之下,卵磷脂价格低廉、材料易得且无污染,更易成为首选。本实验中添加卵磷脂后,菌株JG所产的FPA、CMCase、BGL酶活性分别提高了72.9%、20.8%、33.6%,与添加鼠李糖脂的效果相同,故选择卵磷脂作为JG发酵产酶的最适表面活性剂。

|
| 图 4 不同种类表面活性剂对菌株产酶影响 |
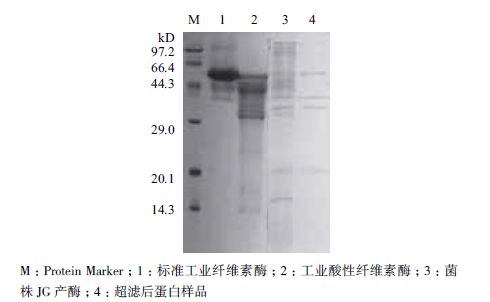
将优化后菌株JG所产的纤维素酶组分进行了分析,结果(图 5)显示,超滤后的3个目标蛋白大小约为55、37 和33 kD。发酵产物蛋白的谱型与商品酸性纤维素酶谱比较相近,具体成分有待进一步分离纯化后分析。
|
| 图 5 纤维素酶SDS-PAGE分析 |
本实验从含有腐烂树叶和秸秆的土壤中筛选到一株纤维素降解菌,形态学和分子生物学鉴定为草酸青霉菌,命名Penicillium oxalicum JG。近几年,对于草酸青霉菌产纤维素酶能力的研究比较集中,青岛农业大学张名爱等[18, 19]证明了分离出的鹅源草酸青霉(Penicillium oxalicum Currie&Thom)F67,具有产纤维素酶、果胶酶及溶磷等特性,并已有广泛的应用。杨友坤等[20]从牛粪堆肥样品中筛选出一株草酸青霉菌,命名为Penicillium oxalicum F12,具有较强的纤维素降解能力,在高纤维类物质堆肥过程中有着较大的应用潜力。王洪媛等[21]从土壤中筛选到一株降解能力较强的草酸青霉菌,命名为Penicillium oxalicum 98MJ,其对半纤维素、纤维素及木质素都有较好的降解效果,是一株具有开发潜力的纤维素酶生产菌株。本研究通过对筛选获得的草酸青霉菌JG进行产酶单因素优化,确定初始pH值为2.0-3.0,CMC-Na和豆粉为最优产酶条件。张蔚等[22]所筛选的草酸青霉菌在初始pH值7.0,以 4%麸皮和0.2%牛肉膏为最适产酶底物。本实验还对不同金属离子对产酶的影响进行了研究,结果表明,添加K+对菌株产酶具有一定的促进作用,但是效果并不明显。
菌株JG的最适初始发酵pH为2.0左右,发酵过程中pH值维持在4.0左右。穆春雷等[23]曾经筛选出一株草酸青霉菌M11(Penicillium oxalicum M11),该菌株在初始pH为6.5,发酵过程中pH值为5.0时产酶达到最适。耿丽萍等[24]对草酸青霉菌HB1的产酶条件优化后指出其菌株最适初始pH为4.0-7.0之间,发酵pH为7.0时,酶活力最旺盛。由此可知,本研究获得的草酸青霉菌JG为具备较强耐酸性的产纤维素酶菌株,其原因可能与草酸青霉菌代谢产酸有关。当工业上对纤维素类物质的处理采用酸时,该菌可以表现出较强的耐酸性,具有实际的应用价值。
表面活性剂由于结构的特殊性,具有改变酶作用微环境的功能。刘佳等[25]研究了吐温-80和鼠李糖脂对绿色木霉产纤维素酶的影响,发现鼠李糖脂促进产酶效果明显高于吐温-80。卵磷脂作为两性离子表面活性剂,在酸性环境中,呈阳离子表面活性剂的性质,可以使菌丝在培养基中分散更均匀,增加与底物接触,从而对菌株产酶有很大促进作用。卵磷脂对纤维素酶的作用机理很早之前就有研究。缪炜等[26]经研究发现卵磷脂可作用于内切葡聚糖酶,引起酶构象的变化,并且与作用pH值和卵磷脂添加浓度有很大的关系。本研究选用的JG发酵培养基中分别添加鼠李糖脂和卵磷脂,培养7 d后,内切葡聚糖苷酶、β-糖苷酶和滤纸酶活性较其它几种表面活性剂诱导产生的酶活性都达到最大值,结果非常相近。添加卵磷脂的最终滤纸酶活0.41 IU/mL、内切纤维素酶活0.978 IU/mL、β-葡萄糖苷酶活1.192 IU/mL,分别提高了72.9%、20.8%和33.6%。考虑到鼠李糖脂由于成本较高,不适于大规模的工业应用;相比之下,卵磷脂更具有工业应用的潜质。
4 结论本研究从含有枯枝腐叶及牛粪的土壤样品中筛选出一株具有纤维素降解能力的草酸青霉菌,命名为草酸青霉菌JG(Penicillium oxalicum JG)。该菌株在最适碳源、氮源底物和最适发酵初始pH条件下产酶能力有显著提高。生物表面活性剂卵磷脂菌株JG产酶具有明显的促进作用。
| [1] | Christian PK, Marianna M, André S, et al. Metabolic engineering strategies for the improvement of cellulase production by Hypocrea jecorina[J]. Biotechnology for Biofuels, 2009, 2:5-19. |
| [2] | Anita S, Narsi RB. Optimization of enzymatic hydrolysis of pretreated rice straw[J]. Appl Microbiol Biotechnol and Ethanol Production, 2012, 93:1785-1793. |
| [3] | Kumar P, Barrett DM, Delwiche MJ. Method for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production[J]. Industrial and Engineering Chemistry Research, 2009, 48(8):3713-3729. |
| [4] | Saritha M, Anju A, Surender S, et al. Streptomyces griseorubens medi-ated delignification of paddy straw for improved enzymatic sacchari-fication yields[J]. Bioresource Technology, 2013, 135:12-17. |
| [5] | Zhang H, Sang Q, Zhang WH. Statistical optimization of cellulases production by Aspergillus niger HQ-1 in solid-state fermentation and partial enzymatic characterization of cellulases on hydrolyzing chitosan[J]. Ann Microbiol, 2012, 62:629-645. |
| [6] | Long C, Ou Y, Guo P, et al. Cellulase production by solid state fermentation using bagasse with Penicillium decumbens L-06[J]. Annals of Microbiology, 2009, 59(3)517-523. |
| [7] | Noah W, Johan B, Lars SP, et al. Enzymatic lignocellulose hydroly-sis:Improved cellulase productivity by insoluble solids recycling[J]. Biotechnology for Biofuels, 2013, 6(5):2-14. |
| [8] | 陆晨, 陈介南, 王义强. 一株产纤维素酶真菌的筛选及产酶条件优化[J]. 中南林业科技大学学报, 2012, 32(6):118-122. |
| [9] | Takanori N, Yuka S, Mamoru N, et al. Discovery of cellobionic acid phosphorylase in cellulolytic bacteria and fungi[J]. FEBS Letters, 2013, 587:3556-3561. |
| [10] | 邓辉, 王成, 吕豪豪. 堆肥过程中放线菌演替及木质纤维素降解研究进展[J]. 应用与环境生物学报, 2013, 19:581-586. |
| [11] | Sanjeev R, Deepa D, Matti K, et al. Bioprocessing of enhanced cellulase production from a mutant of Trichoderma asperellum RCK2011 and its application in hydrolysis of cellulose[J]. Fuel, 2014, 124:183-189. |
| [12] | 钱林, 郑巧利, 付瑾. 一株高效纤维素降解菌株的分离鉴定及其酶学性质[J]. 微生物学通报, 2010, 37(4):524-528. |
| [13] | Ghose TK. Measurement of cellulase activities[J]. Pure Appl Chem, 1987, 59(2):257-268. |
| [14] | 宋波, 羊键. 一株降解纤维素的放线菌的筛选及其产酶条件的研究[J]. 微生物学杂志, 2005, 25(5):36-39. |
| [15] | 钟桂芳, 翟莉莉, 樊攀, 等. 里氏木霉产纤维素酶的条件优化及酶学性质研究[J]. 食品与发酵科技, 2013, 49:10-14. |
| [16] | Grgic I, Perdih A. Stimulation of ligninolytic enzyme production in Phanerochaete chrysosporium by polyoxyalkanes[J]. J Appl Microbiol, 2003, 94:360-368. |
| [17] | Garon D, Krivobok S, Wouessidjewe D, et al. Influence of surfactants on solubilization and fungal degradation of fluorene[J]. Chemosphere, 2002, 47:303-309. |
| [18] | 荆丽珍, 王宝维, 龙芳羽, 等. 鹅源草酸青霉产果胶酶的发酵条件研究[J]. 沈阳农业大学学报, 2008, 39(1):38-43. |
| [19] | 岳斌, 王宝维, 张名爱, 等. 鹅源草酸青霉溶磷效果及对鹅磷代谢的影响[J]. 青岛农业大学学报, 2008, 25(1):34-37. |
| [20] | 杨友坤, 朱凤香, 王卫平, 等. 堆肥中产纤维素酶真菌的筛选及其产酶条件[J]. 浙江农业学报, 2010, 22(4):464-468. |
| [21] | 王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7):870 -875. |
| [22] | 张蔚, 杨学鹏, 等. β-葡萄糖苷酶高产菌株的筛选及产酶条件优化[J]. 河南大学学报:自然科学版, 2011, 41(2):174-178. |
| [23] | 穆春雷, 武晓森, 李术娜, 等. 低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质[J]. 微生物学通报, 2013, 40(7):1193-1201. |
| [24] | 耿丽萍, 陆秀君, 赵全利, 等. 草酸青霉菌产酶条件优化及其秸秆腐解能力[J]. 农业工程学报, 2014, 30(3):170-180. |
| [25] | 刘佳, 袁兴中, 等. 表面活性剂对绿色木霉产纤维素酶影响的实验研究[J]. 中国生物工程杂志, 2006, 26:62-66. |
| [26] | 缪炜, 姚松年. 卵磷脂影响纤维素酶作用的机理研究[J]. 印染, 1998, 24(5):11-16. |