偶氮染料是目前使用量最大的一类合成染料,因其成本低廉和染色性能突出等优点被广泛应用于纺织、皮革、食品和化妆品等行业。偶氮染料具抗光、抗氧化能力,故能稳定存在于水体,造成水体色度增加,并影响水生生物的生存[1, 2]。据报道,多数偶氮染料及其代谢的中间产物具致癌、致畸和致突变等毒害作用[3, 4]。因此,偶氮染料引起的水污染问题一直是国内外关注的焦点。
废水的生物处理法具有高效、安全、低能耗以及环境友好等特点[5, 6]。迄今为止,已分离筛选出许多可使偶氮染料降解脱色的微生物,其中一些成功应用于染料废水的生物修复[7, 8, 9]。而有关偶氮染料甲基红的降解脱色菌株的研究一直较少有人涉及。本研究报道一株对甲基红有较好降解能力的菌株副球菌属Paracoccus sp. L-4,详细摸索菌株L-4的生理生化和降解特性,以期为该菌株应用偶氮染料废水的处理提供一定的理论依据。
1 材料与方法 1.1 材料污泥取自江苏常熟某染料化工厂排污口。
LB(Luria-Bertani)培养基:10.0 g蛋白胨,5.0 g酵母浸粉,10.0 g NaCl,1 000 mL水,pH 7.0-7.2。1/10 LB培养基:1.0 g蛋白胨,0.5 g酵母浸粉,1.5g NaCl,1.0 g NH4NO3,1.5 g K2HPO4·H2O,0.5 g KH2PO4,0.2 g MgSO4·7H2O,1 000 mL水,pH 7.0-7.2。无机盐培养基(Mineral salt medium,MSM):1.0 g NH4NO3,1.5 g K2HPO4·H2O,0.5 g KH2PO4,0.5 g NaCl,0.2 g MgSO4·7H2O,1 000 mL水,pH 7.0-7.2。甲基红为分析纯,购自天津市化学试剂三厂。二氯甲烷为分析纯,购自上海中试化工总公司。
1.2 方法 1.2.1 菌株的富集与分离将5.0 g污泥置于50 mL含20 mg/L甲基红的1/10 LB培养基中,30℃、170 r/min振荡培养。每隔1周转接1次,甲基红逐渐提高的浓度至100 mg/L。经测定,连续3代能降解甲基红达85%以上的即为稳定富集液。将富集液梯度稀释后涂布于含100 mg/L甲基红的LB平板。挑取有无色透明圈的单菌落接种到液体LB,采用紫外可见分光光度法检测其甲基红的降解脱色能力。
1.2.2 菌株的鉴定降解菌株的形态和生理生化特性参照文献[10]进行。菌株总DNA的提取采用高盐法,并以此作为模板进行16S rDNA基因的扩增。PCR产物经上海生工生物工程有限公司测序,测序结果通过在线分析,与GenBank中的其他16S rRNA 基因序列进行相似性比较,构建系统进化树。
1.2.3 菌株L-4 对甲基红的降解 在50 mL LB、MSM中分别添加100 mg/L甲基红,接种0.5 mL预培养的L-4种子液(OD600 nm=1.0),观察L-4对甲基红的降解。30℃、170 r/min摇床振荡培养,间隔时间取样,测定培养液中甲基红的残留量。菌株的生长用OD600 nm表示。
1.2.4 环境条件对菌株L-4 降解甲基红的影响在50 mL LB中添加100 mg/L甲基红,接种L-4后,分别在不同条件下170 r/min振荡培养后测定甲基红的降解脱色情况,观察温度、初始pH值、通气量和金属离子对菌株L-4甲基红脱色的影响。12 h后取样,测定培养液中甲基红的残留量。所有处理设3个重复。
1.2.5 染料浓度对菌株L-4 降解甲基红的影响 在50 mL LB中添加甲基红至终浓度分别为50、100、150、200、250、300、350和400 mg/L,30℃、170 r/min 摇床振荡培养。接种菌株2 d后,测定培养液中甲基红的残留量。所有处理设3个重复。
1.2.6 甲基红含量的测定培养液以12 000 r/min离心5 min,收集上清液。加入3倍体积的二氯甲烷,剧烈振荡5 min,静置10 min分层。用尖嘴吸管吸取下层有机相,加入少量无水硫酸钠。取1.0 mL置1.5 mL离心管,室温氮气吹干。加入3 mL二氯甲烷溶解,于岛津 UV-1800 紫外可见分光光度计检测培养液中的甲红红残留量。甲基红检测波长分别为420 nm。
2 结果 2.1 降解菌株L-4的分离和鉴定采用富集培养的方式,从长期受染料污染的污泥中分离到一株能够较好对甲基红降解脱色的细菌菌株,命名为L-4。该菌株在含有100 mg/L甲基红的50 mL 1/10 LB中,2 d对甲基红的降解率近达100%。
菌株L-4在LB平板上生长2 d后,菌落呈乳白色、圆形、光滑、黏稠。菌株L-4为革兰氏阴性菌,不运动,不能形成芽孢,呈短杆状(0.8-0.9 μm×0.9-1.1 μm)。菌株L-4氧化酶、过氧化氢酶、α-葡糖苷酶、硝酸盐还原反应阳性,α-半乳糖苷酶、α-甘露糖苷酶和脲酶阴性。能利用L-阿拉伯糖、L-岩藻糖、D-葡萄糖、D-甘露糖醇、D-核糖和D-蔗糖作为唯一碳源生长。菌株L-4能耐4%的NaCl。
提取降解菌基因组DNA,用16S rDNA 通用引物对降解菌的16S rDNA进行扩增,得到长度约为1 329 bp的片段。将测序结果提交至NCBI数据库获得登录号。根据L-4与相关属种16S rRNA序列构建系统进化发育树(图 1),比较发现,菌株L-4与Paracoccus limosus同源性达97.8%,与该属Paracoccus denitrificans、Paracoccus marinus和Paracoccus aminophilus也分别有 97.7%、97.7% 和 97.4% 的相似性。因此,结合菌株形态和生理生化特征,将L-4归属到副球菌属(Paracoccus sp.)。

|
| 图 1 降解菌株 L-4 的系统发育树 |
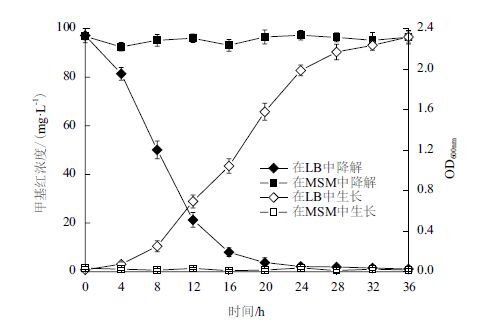
由图 2可知,菌株L-4不能以甲基红为唯一的碳源生长和降解甲基红,36 h时MSM培养基中L-4的OD600 nm 值未见明显增加,甲基红质量浓度也未见明显减少。但在LB培养基中,L-4 表现出较强的降解能力,16 h时培养液甲基红质量浓度已从97.11 mg/L下降至8.02 mg/L,降解率达91.74%,相应菌液的OD600 nm 值也从0.02上升至1.24。
|
| 图 2 L-4以甲基红为碳源的生长和降解 |
菌株L-4在不同温度降解甲基红结果(图 3)显示,当温度为25、30℃时,菌株对甲基红有较好的脱色能力,12 h时培养液甲基红的降解率分别为65.84%、78.89%,30℃为最适温度。在20℃及以下和35℃及以上,脱色效果较差,脱色率小于37%。

|
| 图 3 温度对L-4降解甲基红的影响 |
菌株L-4在不同pH下降解甲基红结果(图 4)显示,该菌在过酸(pH4-5)或过碱(pH8-9)条件下都不能很好地降解甲基红,12 h时甲基红降解脱色率小于21%。菌株L-4降解甲基红适宜pH值范围为6.0-7.0,12 h时甲基红降解率超过80%,pH6.0的降解效果最佳,脱色率达88.08%。

|
| 图 4 pH值对L-4降解甲基红的影响 |
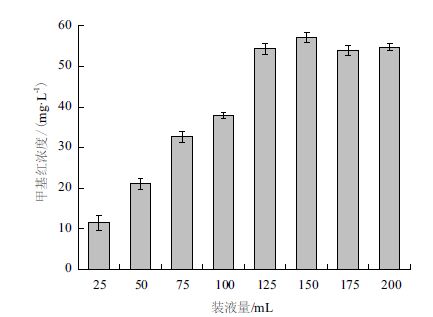
本实验以不同的装液量来反映通气量对菌株L-4降解甲基红的影响,结果如图 5所示。当装液量≤125 mL时,脱色率随着装液量的增加而减少,且装液量对L-4降解甲基红影响较大;装液量为25 mL时,降解率达到88.2%,而在125 mL处仅达到47.14%。但装液量继续增大时,培养液甲基红残留量未见明显增加,12 h时几组的甲基红降解率仍大于40%。
|
| 图 5 通气量对L-4降解甲基红的影响 |
菌株L-4在不同pH下降解甲基红的结果如图 6所示。本实验观察Zn2+、Co2+、Cu2+、Ag+、Al3+、Fe3+、Fe2+、Mg2+、Ca2+和Mn2+几种离子对菌株L-4降解脱色效果的影响,金属离子浓度为1 mmol/L。结果表明,Zn2+、Co2+、Cu2+、Ag+、Al3+、Fe3+、Fe2+ 7种金属离子对甲基红的降解有较强地抑制作用,几种金属离子下的甲基红降解率小于40%。而Mg2+、Ca2+和Mn2+ 对甲基红的降解无明显抑制作用,脱色率分别为78.92%、79.46%和78.79%。

|
| 图 6 金属离子对L-4降解甲基红的影响 |
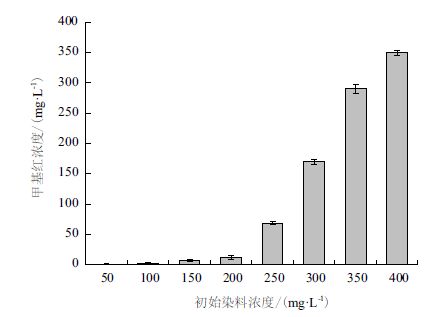
不同初始浓度对菌株L-4降解甲基红的影响如图 7所示。菌株L-4对甲基红的脱色率随甲基红的初始浓度的升高而降低。当初始质量浓度≤200 mg/L,24 h时,甲基红脱色率达到90%以上,50 mg/L时脱色率最高,达到98.53%,300 mg/L时,脱色率仍能达到43.35%。与其他偶氮染料降解微生物相比[11, 12, 13],菌株L-4对于高质量浓度甲基红,具有良好的脱色能力。但当浓度为400 mg/L时,脱色效果不佳,脱色率仅为12.51%,说明此时染料质量浓度可能已经超过了该菌株的耐受能力,降解酶活性受到了较强的抑制作用。
|
| 图 7 甲基红初始质量浓度对L-4降解甲基红的影响 |
随着印染、纺织等行业的迅速发展,染料废水逐年增加,其中偶氮染料废水产量最大。生物法被认为是目前最有前途的一种废水处理法[5, 6],而生物处理法的关键是高效的降解微生物的筛选。到目前为止有大量的偶氮染料脱色微生物从各种环境中被分离出来,而甲基红降解脱色菌株却较少见到报道[14, 15, 16]。本实验在长期受染料污染的污泥中分离获得一株高效降解甲基红的菌株L-4,该菌株能在16 h内使培养液100 mg/L甲基红降解率达91.74%,2 d内可使甲基红的降解率近达100%。
根据形态学、生理生化特性实验,将菌株L-4初步归属到副球菌属(Paracoccus sp.),这是首次从副球菌属分离到有甲基红降解能力的菌株,因此该菌株的分离丰富了甲基红降解的菌种资源。已报道的偶氮脱色细菌有好氧菌也有厌氧菌,但即便是好氧菌,脱色仍需厌氧环境[17, 18]。本实验中,菌株L-4的生长和对甲基红的降解脱色都是在好氧条件下,这可能是因为菌株L-4的细胞存在好氧性的偶氮染料降解脱色酶的缘故,因此,菌株L-4的分离将有助于进一步揭示偶氮染料的好氧脱色机制。
环境条件对菌株降解甲基红的影响实验表明,该菌株降解甲基红的适宜温度25-30℃,适宜pH值为6.0-7.0,Zn2+、Co2+、Cu2+、Ag+、Al3+、Fe3+、Fe2+ 对甲基红的降解有较强地抑制作用。但通气量对菌株L-4 影响较小,缺氧条件也可较好地降解甲基红,12 h时装液量≥125 mL实验组降解率仍大于40%,提示菌株L-4在缺氧条件也可较好的对甲基红降解脱色。
4 结论分离筛选得到一株能够有效降解甲基红的菌株L-4,初步鉴定该菌株为副球菌属(Paracoccus sp.)。该菌株不能以甲基红为唯一碳源生长和降解甲基红,在LB培养基中,16 h内使100 mg/L培养液甲基红降解掉91.74%,降解甲基红的适宜温度为25-30℃,适宜pH值为6.0-7.0,装液量≤100 mL时,脱色率能达到60%,装液量>100 mL,也在40%以上,L-4对高质量浓度甲基红具有良好的脱色能力,24 h,50 mg/L时,脱色率最高,达到98.53%。部分金属离子对该菌株降解甲基红有抑制作用,其中其中Cu2+抑制最明显,12 h,甲基红的降解率仅为30.07%。
| [1] | Chen G, Hang M, Chen L, et al. A batch decolorization and kinetic study of Reactive Black 5 by a bacterial strain Enterobacter sp. GY-1[J]. International Biodeterioration & Biodegradation, 2011, 65(6):790-796. |
| [2] | Patel Y, Mehta C, Gupte A. Assessment of biological decolorization and degradation of sulfonated di-azo dye Acid Maroon V by isolated bacterial consortium EDPA[J]. International Biodeterioration & Biodegradation, 2012, 75:187-193 |
| [3] | Azeem K, Muhammad A, Crowley DE. Accelerated decolorization of structurally different azo dyes by newly isolated bacterial strains[J]. Applied Microbiology and Biotechnology, 2008, 78(2):361-369 |
| [4] | Cui D, Li G, Zhao M, et al. Decolourization of azo dyes by a newly isolated Klebsiella sp. strain Y3, and effects of various factors on biodegradation[J]. Biotechnology & Biotechnological Equipment, 2014, 28(3):478-486 |
| [5] | 许玫英, 郭俊, 岑英华, 等. 染料的生物降解研究[J]. 微生物学通报, 2006, 33(1):138-143. |
| [6] | 廖欢, 严滨, 黄国和, 等. 一株酸性大红3R脱色菌的分离鉴定及其脱色性能研究[J]. 环境科学学报, 2013, 33(3):691-699. |
| [7] | 武春媛, 李勤奋, 周顺桂, 等. 一株嗜水气单胞菌HS01的偶氮还原脱色特性[J]. 微生物学通报, 2013, 40(6):959-967. |
| [8] | 陈晔, 陈刚, 陈亮, 等. 菌株Enterobactor sp. S8对不同结构偶氮染料脱色性能的影响[J]. 环境化学, 2011, 30(4):838-842. |
| [9] | 王慧, 周月霞, 柏仕杰, 等. 染料废水生物法处理技术的研究进展[J]. 厦门大学学报:自然科学版, 2008, 47(S2):286-290. |
| [10] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001. |
| [11] | 刘生浩, 史玉英, 娄无忌, 邵劲松. 偶氮染料降解菌L-6和L-D的分离及其降解特性的研究[J]. 南京农业大学学报, 1996, 19(2):45-49. |
| [12] | 杨东虎, 阚振荣. 偶氮染料直接大红GBE脱色细菌的筛选及研究[J]. 环境污染治理技术与设备, 2002, 3(12):51-53. |
| [13] | 阮晓东, 张惠文, 王振宇, 等. 红酵母YR-1对偶氮染料酸性红B的脱色研究[J]. 水处理技术, 2009, 35(12):38-43. |
| [14] | 卢婧, 余志晟, 张洪勋. 微生物降解偶氮染料的研究进展[J]. 工业水处理, 2013, 33(1):15-19. |
| [15] | Zhao M, Sun PF, Du LN, et al. Biodegradation of methyl red by Bacillus sp. strain UN2:decolorization capacity, metabolites characterization, and enzyme analysis[J]. Environmental Science and Pollution Research, 2014, 21(9):6136-6145. |
| [16] | Jadhav SU, Kalme SD, Govindwar SP. Biodegradation of Methyl red by Galactomyces geotrichum MTCC 1360[J]. International Biodeterioration & Biodegradation, 2008, 62(2):135-142. |
| [17] | 郑力文, 李彦春, 吴渝玉, 等. 皮革染料的生物降解研究进展[J]. 中国皮革, 2012, 41(11):54-58. |
| [18] | 杨清香, 贾振杰, 杨敏. 微生物染料脱色研究进展[J]. 微生物学通报, 2006, 33(4):144-148. |




