在微生物学研究中,高温菌也称嗜热菌或好热菌,具有嗜热和耐热的特性[1]。由于高温微生物及其活性物质可以在高温条件下行使功能,具有超常的生物学稳定性,能够实现一般生物技术难以达到的目的。高温菌的利用有助于突破当前生物技术领域中的一些局限,为提高生物技术能力开辟了重要途径,因此在生物技术领域具有重要的应用潜力,特别是嗜热酶作为酶制剂具有制备成本低、动力学反应快、热稳定性好等优点[2],在轻工、食品、化工等众多领域都得到了广泛应用[3]。
高温菌在地球上分布广泛,不仅存在于地热环境中,在人工高温环境、地下油层甚至空气中都曾发现有高温菌的存在,但通常分布在陆地温泉、海底热泉、地壳内部、酸性硫磺区等自然高温环境中及高温堆肥、烟囱、热水器、热污染河流等人工高温环境中[4]。本研究从经121℃灭菌20 min的斜面培养基中分离到一株高温菌CICC 10853,通过表型、生理生化、16S rRNA基因和recN基因序列分析的多相鉴定技术确定该菌株的分类学地位,旨在为进一步了解其生物学功能奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株CICC 10853分离于CICC实验室的斜面培养基。
1.1.2 R2A培养基酵母粉 0.5 g,蛋白胨 0.5 g,酪蛋白水解物0.5 g,葡萄糖 0.5 g,可溶性淀粉 0.5 g,丙酮酸钠 0.3 g,磷酸氢二钾 0.3 g,硫酸镁0.1 g,琼脂 15.0 g。蒸馏水 1.0 L,pH7.2。121℃高压蒸汽灭菌20 min。
1.2 方法 1.2.1 菌株分离与纯培养R2A培养基分装试管,121℃灭菌20 min,冷却至50-55℃摆斜面,凝固后置于37℃培养箱空置培养2 d,确认无菌。在56℃ 培养48 h,长出菌落后,利用R2A平板划线培养,挑取单菌落转接到新鲜的R2A斜面培养后于4℃保藏。
1.2.2 形态学观察将供试菌株接种于R2A平板上,56℃培养24 h。取新鲜菌体进行革兰氏染色并镜检,染色方法参照《常见细菌系统鉴定手册》[5]。同时进行扫描电镜切片并镜检、拍照。
1.2.3 16S rRNA基因序列分析利用细菌基因组DNA提取试剂盒(Tiangen公司)提取菌株CICC 10853基因组DNA,具体步骤参见试剂盒说明书。以基因组DNA为模板,利用通用引物F27/1492R扩增16S rRNA基因[6]。测序由北京诺赛基因组研究中心有限公司完成。测序结果用Chromas软件参照正反序列图谱人工校对,测序结果在EzTaxon数据库中进行比对[7],确定与已知近缘种序列的相似性。采用CLUSTAL W对CICC 10853及其若干近缘种16S rRNA基因序列进行多序列比对[8],并利用N-J法通过MEGA 5软件进行系统发育树分析[9]。
1.2.4 recN 基因序列分析以菌株CICC 10853的基因组DNA为模板,对靶基因recN(DNA修复和基因重组蛋白N亚基基因)进行扩增,PCR及反应条件参照[10]。纯化后的PCR产物由北京诺赛基因组研究中心有限公司进行测序。测序得到的结果在GenBank数据库中进行比对分析,并通过MEGA 5软件进行系统发育树分析[9]。
1.2.5 生理生化特征实验采用API 50CH及API 20E试剂条对CICC 10853 的碳源利用及其产酸情况、酶活性等生理生化特征进行检测,具体操作方法按试剂条使用说明书进行。生长温度实验和耐盐性实验依据《伯杰氏系统细菌学鉴定手册》[11](第2版)中地芽胞杆菌属相关内容,温度选择35℃、40℃、45℃、70℃和75℃,NaCl终浓度选择1%、2%、3%、4%和5%。
2 结果 2.1 形态学观察菌株CICC 10853在R2A培养基上,菌落黄色、不透明、圆形、表面光滑(图 1-A)。利用光学显微镜观察显示菌体细胞长杆状,单个或成链状排列。革兰氏染色阳性,有芽胞,芽胞椭圆或柱状、端生或次端生,膨大明显(图 1-B)。菌体电子显微镜观察,菌体长度2.0-3.0 μm,宽度0.4-0.6 μm,扫描电镜成像效果见图 1-C。

|
| 图 1 菌株CICC 10853形态学观察结果 |
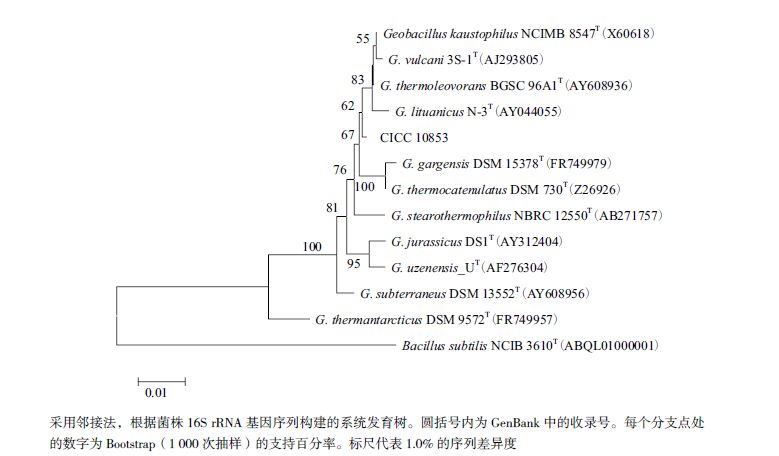
测序得到的菌株CICC 10853的16S rRNA基因序列信息提交至GenBank,获得登录号KP729021。以Bacillus subtilis NCIB 3610T(ABQL012016-2-1401)为外群,构建CICC 10853与相关近缘模式菌株的系统发育树(图 2)。
|
| 图 2 CICC 10853 16S rRNA基因系统发育分析 |
由系统发育分析可判断,CICC 10853应归属为地芽胞杆菌属(Geobacillus sp.),与好热地芽胞杆菌(Geobacillus kaustophilus)、火神地芽胞杆菌(G.vulcani)、立陶宛地芽胞杆菌(G.lituanicus)、噬热地芽胞杆菌(G.thermoleovorans)、加尔加泉地芽胞杆菌(G.gargensis)和热小链地芽胞杆菌(G.thermocatenulatus)等聚为一个系统发育分支,16S rRNA基因序列相似性均高于原核微生物种的界限98.65%[12]。Dinsdale等[13]根据API、脂肪酸成分、DDH等分析认为好热地芽胞杆菌(Geobacillus kaustophilus)、火神地芽胞杆菌(G.vulcani)、立陶宛地芽胞杆菌(G.lituanicus)、噬热地芽胞杆菌(G.thermoleovorans)应归为同一个种噬热地芽胞杆菌(G.thermoleovorans),另外加尔加泉地芽胞杆菌(G.gargensis)应为热小链地芽胞杆菌(G.thermocatenulatus)的同物异名。
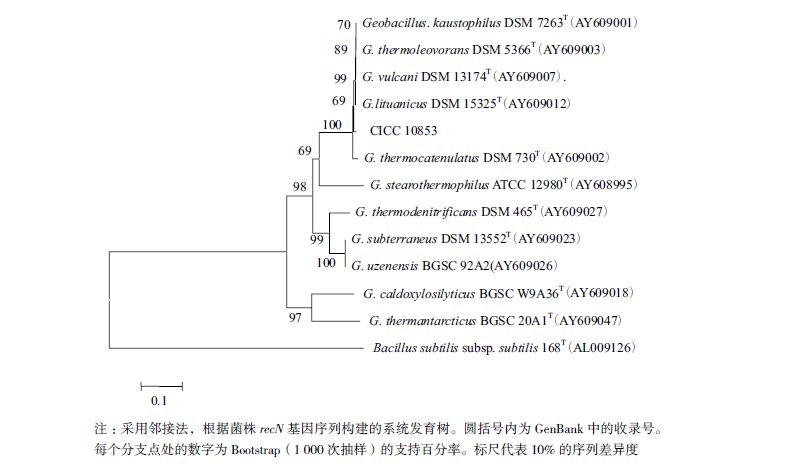
2.3 recN 基因序列分析recN 基因是地芽胞杆菌属内种间分子生物学鉴定的重要工具[10]。以菌株CICC 10853的基因组DNA为模版,扩增recN 基因,基因序列信息提交至GenBank,获得登录号KP729022。以Bacillus subtilis subsp. subtilis 168T(AL009126)为外群,构建CICC 10853与相关近缘模式菌株的系统发育树(图 3)。
|
| 图 3 CICC 10853 recN基因系统发育分析 |
recN 基因基因序列分析显示,菌株CICC 10853与好热地芽胞杆菌(Geobacillus kaustophilus)、火神地芽胞杆菌(G.vulcani)、立陶宛地芽胞杆菌(G.lituanicus)、噬热地芽胞杆菌(G.thermoleovorans)的recN基因序列相似度为98.9%,与热小链地芽胞杆菌(G.thermocatenulatus)的序列相似度为97.4%,而与其他近缘种的相似度均低于90%。CICC 10853与好热地芽胞杆菌(Geobacillus kaustophilus)、火神地芽胞杆菌(G.vulcani)、立陶宛地芽胞杆菌(G.lituanicus)、噬热地芽胞杆菌(G.thermoleovorans)的recN基因序列种间相似性均大于99%,这也进一步证明了Anna E. Dinsdale等人的结论。
因此,根据16S rRNA和recN 基因分析表明,CICC 10853应鉴定为噬热地芽胞杆菌(G.thermoleo-vorans)或热小链地芽胞杆菌(G.thermocatenulatus)。
2.4 生理生化鉴定菌株CICC 10853的酶活性、碳源利用及其产酸情况等生理生化特征结果详见表 1。结果显示菌株CICC 10853液化明胶,β-半乳糖苷酶反应阳性;能利用葡萄糖、果糖、核糖、D-木糖、半乳糖、甘露糖、淀粉、甘油、肌醇、甘露醇、α-甲基-D-葡萄糖甙、七叶灵等碳源物质,生长温度为45-70℃,培养基中NaCl终浓度1%时可生长,NaCl终浓度2%时不能生长。生理生化结果与噬热地芽胞杆菌(Geoba-cillus thermoleovorans)一致。
依据形态学观察、生理生化鉴定、16S rRNA 基因及recN基因序列分析,分离自斜面培养基的菌株CICC 10853被鉴定为噬热地芽胞杆菌(Geobacillus thermoleovorans)。
3 讨论2001年,Nazina等[14]提出将芽胞杆菌属16S rRNA系统发育群GROUP 5的嗜热菌群独立出来,形成一个新属地芽胞杆菌属。该属菌种表型相近,革兰氏染色呈阳性(或可变),菌体杆状,芽胞端生。生长温度范围37-80℃。大部分种在自然环境中广泛存在,在温泉、油田、火山口和堆肥等高温环境,甚至土壤常温环境和极地低温环境中均有报道[15]。地芽胞杆菌属正式发表的种共计19个,但近年来随着新种的发现和分子生物学的发展,原有种的分类学地位发生了很大变化,如脆弱地芽胞杆菌G. debilis归属到新属Caldibacillus sp.,命名为C. debilis;苍白地芽胞杆菌G. pallidus、脆弱地芽胞杆菌G. debilis转移到新属Caldibacillus sp.;喜温地芽胞杆菌Geobacillus tepidamans重新归属到无氧芽胞杆菌属Anoxybacillus sp.。好热地芽胞杆菌(G. kaustophilus)、火神地芽胞杆菌(G.vulcani)、立陶宛地芽胞杆菌(G. lituanicus)、噬热地芽胞杆菌(G. thermoleovorans)合并为一个种噬热地芽胞杆菌(G. thermoleovorans),同时加尔加泉地芽胞杆菌(G. gargensis)为热小链地芽胞杆菌(G. thermocatenulatus)的同物异名。截止目前该属仅存12个有效种,4个亚种[16]。
Zeigler[10]对68株地芽胞杆菌的recN 基因序列进行了分析,与16S rRNA基因相比,recN 基因在地芽胞杆菌种水平的鉴定区分度更高。本研究通过16S rRNA和recN 基因序列分析将菌株CICC 10853鉴定为噬热地芽胞杆菌(G. thermoleovorans)或热小链地芽胞杆菌(G. thermocatenulatus),菌株与噬热地芽胞杆菌(G. thermoleovorans)的recN 基因序列相似性(98.9%)高于热小链地芽胞杆菌(97.4%)。进一步综合表型、生理生化等分类特征,CICC 10853被鉴定为噬热地芽胞杆菌(G. thermoleovorans)这也进一步证明了Dinsdale等[13]的结论。
噬热地芽胞杆菌CICC 10853是从经121℃灭菌20 min的斜面培养基中分离获得,可以推测其耐高压蒸汽灭菌,121℃灭菌20 min不能将其彻底杀灭。该菌在40℃及以下温度不能生长,所以37℃空置培养时未能发现该菌的存在。此外,本研究针对CICC 10853进行碳源物质利用情况及相关酶的活性进行研究,确定其能液化明胶,同时具有β-半乳糖苷酶活性,能利用葡萄糖、果糖、核糖、半乳糖、甘露糖、淀粉及甘油等近20种碳源物质,为进一步开发该菌的生物学功能奠定重要基础。
4 结论依据多相鉴定技术,分离自斜面培养基的菌株CICC 10853被鉴定为噬热地芽胞杆菌(Geobacillus thermoleovorans)。
| [1] | 崔宗均, 路鹏, 于会泳, 张晋丰. 高温菌生物学特性的应用[J]. 微生物学杂志, 2003(4):28-31. |
| [2] | 曹军卫, 沈萍, 李朝阳. 嗜极微生物[M]. 武汉:武汉大学出版社, 2004. |
| [3] | 潘丽贞, 陆利霞, 熊晓辉. 嗜热菌产酶现状的研究[J]. 食品工业科技, 2012(3):422-424. |
| [4] | 和致中, 彭谦, 陈俊英. 高温菌生物学[M]. 北京:科学出版社, 2001. |
| [5] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001. |
| [6] | 张欣, 刘洋, 姚粟, 等. 1株分离自西沙诺尼果原浆细菌菌株CICC10881的鉴定及生物学特性研究[J]. 食品与发酵工业, 2014, 40(11):27-32. |
| [7] | Kim OS, Cho YJ, Lee K, et al. Introducing EzTaxon:a prokaryotic 16S rRNA Gene sequence database with phylotypes that represent uncultured species[J]. Int J Syst Evol Microbiol, 2012, 62:716-721. |
| [8] | Thompson JD, Higgins DG, GibsonTJ. CLUSTAL W:improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Res, 1994, 22:4673-4680. |
| [9] | Tamura K, Dudley J, Nei M, et al. MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)software version 4. 0[J]. Molecular Biology and Evolution, 2007, 24:1596-1599. |
| [10] | Zeigler DR. Application of a recN sequence similarity analysis to the identification of species within the bacterial genus Geobacillus[J]. Int J Syst Evol Microbiol, 2005, 55(3):1171-1179. |
| [11] | De Vos P, Garrity GM, Jones D, et al. Bergey’s manual of systematic bacteriology, second edition, volume three[M]. East Lansing:Michigan State University, 2009. |
| [12] | Kim M, Oh HS, Park SG, Chun J. Towards a taxonomic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J]. Int J Syst Evol Microbiol, 2014, 64:346-351 |
| [13] | Dinsdale AE, Halket G, Coorevits A, et al. Emended descriptions of Geobacillus thermoleovorans and Geobacillus thermocatenulatus[J]. Int J Syst Evol Microbiol, 2011, 61:1802-1810. |
| [14] | Nazina TN, Tourova TP, Poltaraus AB, et al. Taxonomic study of aerobic thermophilic bacilli:descriptions of Geobacillus subterra-neus gen. nov., sp. nov. and Geobacillus uzenensis sp. nov. from pet-roleum reservoirs and transfer of Bacillus stearothermophilus, Baci-llus thermocatenulatus, Bacillus thermoleovorans, Bacillus kausto-philus, Bacillus thermoglucosidasius and Bacillus thermodenitrifi-cans to Geobacillus as the new combinations G. stearothermophilus, G. [J]. International Journal of Systematic and Evolutionary Microbiology 2001, 51:433-446. |
| [15] | Marchant R, Banat IM. The Genus Geobacillus and Hydrocarbon Utilization//Handbook of Hydrocarbon and Lipid Microbiology[M]. Springer Berlain Heidelberg, 2010:1887-1896. |
| [16] | http://www. straininfo. net/taxa/3481/browser/euzeby |





