2.白云鄂博多金属资源综合利用省部共建国家重点实验室,包头 014010
2. The Jointed State Key Laboratory for Baiyun Obo Polymetallic Resources Comprehensive Utilization by Province and Ministry,Baotou 014010
嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferroox-idans)是微生物浸矿过程中最有应用价值的一个种,属革兰氏阴性菌,是专性化能自养菌,好氧嗜酸,主要以CO2为碳源,同时吸收磷、氮等无机营养元素来合成自身细胞所需物质[1]。它具有将亚铁氧化成三价铁,将低价硫化物氧化成硫酸的能力,因而能使金属从硫化矿中溶解,因此常用于浸矿菌种研究。而且微生物浸矿具有生产成本低、能耗低、投资少、设备简单、环境友好,特别是具有处理低品位的或复杂的多金属矿物等优点。目前微生物浸矿的应用正在引起传统矿物加工产业的重大变革,具有广阔的应用前景[2, 3, 4]。而A. ferrooxidans因其自身的特殊性在生物冶金中具有重要作用,其中的硫酸盐同化途径是由无机硫到有机硫代谢转化的关键过程。硫酸盐经过一系列同化反应,以还原型硫的形式被整合进入有机骨架,生成半胱氨酸(Cysteine,Cys)。Cys是众多具有重要生物学功能的代谢产物的前体,也就是产生的半胱氨酸可进一步参与其他体内代谢物质的合成。但是,目前我们对于Cys的具体作用机制及其操纵子调控机制不是很清楚。因此本研究以嗜酸氧化亚铁硫杆菌(A. ferrooxidans)为标准菌株ATCC 23270作为研究对象,采用基因组、总RNA的提取与纯化,反转录,琼脂糖凝胶电泳技术,SDS-PAGE,RT-qPCR技术以及生物信息学分析等实验方法或手段,对其硫酸盐同化相关基因的鉴定与分析,旨在达到初步确定A. ferrooxidans ATCC 23270的硫酸盐同化可能的基本代谢路径和探索Cys操纵子调控机制的目的。
1 材料与方法 1.1 材料菌株嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,A. ferrooxidans)为标准菌株ATCC 23270(中南大学友情提供,购自美国菌种保藏中心)。能源培养基则采用改进的9K培养基,在改进的9K培养基的基础上,添加S 5.0 g/L 或硫酸亚铁44.2 g/L。改进的9K培养基、K2Cr2O7标准液、硫磷酸混合液、75%乙醇(用DEPC处理过的水配制)、QIAGEN RNase-free水、RNase-free DNase I(QIAGEN,Valencia,CA)、引物由上海生工生物工程有限公司合成。北京艾德莱生物科技细菌基因组DNA快速提取试剂盒、BioFlux公司的Simply P 总RNA 提取试剂盒、RNA纯化试剂盒为QIGEN,RNeasy Mini Kit。HiTrap从通用电气医疗集团有限公司购买,E. coli菌株BL21(DE3)感受态细胞来自英杰生命技术有限公司,Taq DNA聚合酶,T4 DNA连接酶和限制性内切酶来自MBI Fermentas。
1.2 方法 1.2.1 生物信息学分析A. ferrooxidans ATCC 23270的全基因组的序列和注释从NCBI(http://www.ncbi.nlm.nih.gov/genome/1014)获得。使用源自UniProt数据库的BLAST对核苷酸和蛋白质序列进行序列相似性搜索,得到可能参与硫酸盐同化的基因。
1.2.2 A. ferrooxidans 菌体培养与收集菌株在含有硫酸亚铁的能源培养基中传代培养(约60-90 h),以Fe2+的氧化率来反应其菌体的生长状况,即重铬酸钾滴定法测定细菌是否达到对数生长期,达到对数期的菌液4 000 r/min、4℃离心20 min收集菌体。得到的菌体用pH2.0的硫酸溶液吹打混匀,重复洗涤3次,去掉细胞表面的铁矾沉积物。
1.2.3 A. ferrooxidans菌体的基因组、总RNA的提取与纯化A. ferrooxidans菌基因的提取按照北京艾德莱生物科技细菌基因组DNA快速提取试剂盒说明书进行。总RNA提取步骤按BioFlux公司的Simply P总RNA 提取试剂盒说明书进行。总RNA的纯化参照QIAGEN RNeasy Mini Kit 进行。Invitrogen第一链合成试剂盒反转录合成cDNA。
1.2.4 RT-PCR反应使用10%的cDNA(取上一步骤2 mL反应产物)用于PCR反应。PCR模板分别为:空白、RNA、DNA和cDNA。
(1)RT-PCR扩增引物:引物根据GenBank中公布的A. ferrooxidans ATCC 23270标准菌株的全基因组序列、通过Primer 5.0软件分析设计、由上海生工生物工程公司合成。引物序列见表 1。
(2)RT- PCR反应体系为:10×PCR缓冲液2.5 mL,50 mmol/L MgCl2 1.5 mL,10 mmol/L dNTP混合物0.5 mL,上游扩增引物(终浓度10 μmol/L)0.5 mL,下游扩增引物(终浓度10 μmol/L)0.5 mL,Taq DNA聚合酶(5 U/mL)0.25 mL,模板1 mL,灭菌蒸馏水16 mL。
(3)RT-PCR反应程序设置为:94℃下预变性3 min;94℃变性 45 s,58℃退火45 s,72℃延伸90 s,循环35次;72℃下延伸10 min;4℃下保存。
1.2.5 硫酸盐同化相关基因的表达和纯化硫酸盐同化途径相关基因包括来自A. ferrooxidans的腺苷酰转移酶,ATP硫酸化酶(CysD),腺苷酰硫酸还原酶(CysH),亚硫酸还原酶(CysJI),丝氨酸乙酰转移酶(CysE)和O-乙酰丝氨酸巯解酶(CysM)。按照文献[5, 6, 7, 8],表达和纯化重组基因cys J、cys M、cys H。重组蛋白的储备液用20 mmol/L的磷酸钾缓冲液保存,pH为7.4,含有5%的甘油和5 mmol/L的β-硫基乙醇,然后保存在-80℃冰箱中。洗脱液用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,使用Laemmli不连续缓冲体系。凝胶用考马斯亮蓝R-250染色。
1.2.6 酶活力的测定将ATPS与荧光素酶耦合测定酶的活力[9],根据Trüper等[10]的方法测定APS还原酶的活力。根据Warrilow等[11]的方法测定半胱氨酸合成酶的活力。根据改进的Ostrowski等[12]的方法测定R-FP的活力。根据Kredich等[13]的方法分析R-FP的活力。
2 结果 2.1 预测的A.ferrooxidans ATCC23270基因组中硫酸盐同化相关的基因在A. ferrooxidans ATCC 23270基因组注释里,有一些ORF被认为编码与硫酸盐同化相关的蛋白。图 1展示了所有这些假定的A. ferrooxidans基因,表 2说明其中一些基因可能的作用及功能。根据他们与已知基因的相似性,可以认为3个ORF(cys D-1、cys D-2、cys N)编码ATP硫酸化酶,两个ORF(cys NC-2和cys NC)编码潜在的腺苷酰硫酸激酶[14]。在硫酸盐同化途径中,ATP硫酸化酶催化无机硫酸盐同化途径中的第一步,由ATP提供能量,通过酶促反应活化硫酸盐,生成腺苷5'-磷酰硫酸(APS)和焦磷酸盐[15, 16],然后被腺苷5'-磷酰硫酸(APR)还原酶催化成亚硫酸盐,产物随即又被亚硫酸盐还原酶催化,生成的硫代谢产物很快被整合入O-乙酰丝氨酸(O-acetylserine)的氨基酸骨架中,最后在半胱氨酸合成酶催化下生成Cys[16]。在E. coli和其他细菌中这种活性需要两个蛋白,由cys D基因编码的催化亚基和由cys N基因编码的调节亚基[17]。相反,在真核细胞,古细菌和一些细菌(如B. subtilis)中这两个亚基是融合的。由APS激酶(cys C基因编码)催化的ATP依赖的APS磷酸化反应,进一步生成3'-磷酸腺苷-5'-磷酰硫酸(PAPS)[18]。在包括Mycobacterium和Pseudomonas的一些有机体中,cys C和cys N的产物是融合的[19]。
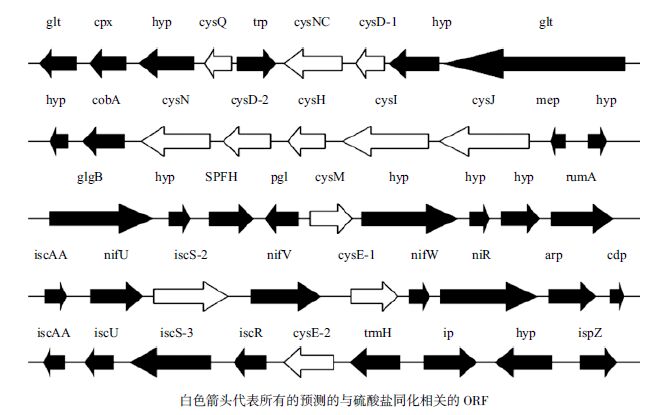
|
| 图 1 A. ferrooxidans ATCC 23270基因组中预测的硫酸盐同化基因 |
其中一个ORF可能编码APS还原酶或者PAPS还原酶(CysH),然而在这条代谢途径中有很多变体,并非所有的有机体都还原APS。植物,藻类和光合细菌利用APS,而细菌和真菌利用PAPS[20]。Kelley等[21]利用萤火虫的敏感的生物荧光系统,在Thiobacillus ferrooxidans中并没有得到PAPS与硫同化的代谢相关的证据。因此,我们尝试性地将其确定为APS还原酶。
两个ORF可能编码亚硫酸盐还原酶(SIR,CysJI),在E. coli中,这个复杂的酶由两种不同的多肽链组成,即α(CysJ)和 β(CysI),并含有一个α8β4结构。黄素蛋白α8,包含4个FAD和4个FMN辅因子,并含有NADPH-细胞色素c还原酶的活性。CysI是一个血红素蛋白,包含一个[4Fe-4S]簇和一个西罗血红素。黄素蛋白接受来自NADPH的电子,并将其传递到CysI,然后将亚硫酸盐还原为硫化物[22]。
半胱氨酸合成的最后一步与丝氨酸乙酰转移酶(SAT)和半胱氨酸合成酶相关,有两个ORF可能编码丝氨酸乙酰转移酶,cys E1和cys E2,它们都负责N-乙酰-L-丝氨酸的生成,并可能在Cys操纵子的调节中扮演重要角色。一个ORF可能编码OASS cys M基因,OASS利用吡哆醛-5'-磷酸(PLP)作为辅因子,是许多生物中PLP依赖的酶中β家族中的一员。
2.2 基因组DNA的提取由图 2所示,嗜酸氧化亚铁硫杆菌基因组条带在10 kb Marker的上方,大小符合理论值,条带完整、明亮、清晰、无拖尾现象而且无RNA污染,表明A. ferrooxidans的基因组可用于下游实验。

|
| 图 2 A.ferrooxidans基因组DNA电泳图 |
由图 3所示,嗜酸氧化亚铁硫杆菌的总RNA为清晰、完整的3个条带,符合原核生物的为23S RNA、16S RNA与5S RNA,总RNA提取纯化过程中无明显的RNase作用导致的降解,经Nano Drop紫外分光光度计检测,在波长为260 nm和280 nm处的消光系数OD260与OD280的比值均在1.80-2.00,说明总RNA的完整性与纯度均较好,mRNA降解较少,可用于后续实验研究。

|
| 图 3 A. ferrooxidans RNA电泳图 |
结果如图 4所示。其中,图 4-A显示,目的片段长度为261 bp,泳道4出现了扩增条带说明进行了共转录。图 4-B显示目的片段长度为256 bp,说明cys J与cys I进行了共转录。图 4-C显示,目的片段长度为202 bp,说明cys I与cys H进行了共转录。图 4-D显示,目的片段长度为199 bp,说明cys H与cys D-2进行了共转录。
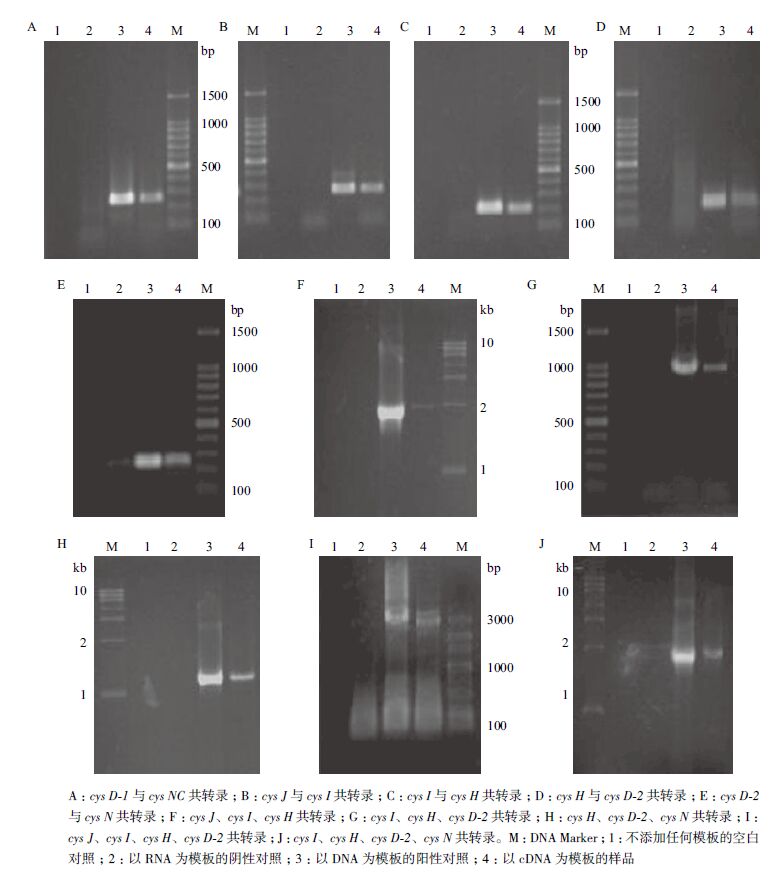
|
| 图 4 RT-PCR电泳图 |
图 4-E显示,目的片段长度为253 bp,说明cys D-2与cys N一起转录。图 4-F显示,目的片段长度为1941 bp,说明cys J、cys I、cys H一起转录。图 4-G显示,目的片段长度为962 bp,说明cys I、cys H、cys D-2一起转录。
图 4-H显示,目的片段长度为1 134 bp,说明cys H、cys D-2、cys N一起转录。图 4-I显示,目的片段长度为2 701 bp,说明cys J、cys I、cys H、cys D-2一起转录。图 4-J显示,目的片段长度为1897 bp,说明cys I、cys H、cys D-2、cys N一起转录。
2.5 A. ferrooxidans ATCC 23270的硫酸盐同化基因的重组用聚丙烯酰胺凝胶电泳检测的关键基因编码的相应蛋白质分的子量分别是,CysD-1为33.228 kD,CysH为28.203 kD,CysJ为66 kD,CysI为60 kD,CysE为28 kD,CysM为31.682 kD,大小与理论预测值相符,电泳分析结果(图 5)显示,其无明显杂带,表明其蛋白纯度较好,因此所纯化基因可用于后续的检测。

|
| 图 5 A. ferrooxidans ATCC 23270中假定的硫酸盐同化基因的SDS-PAGE结果 |
根据我们前文的预测和分析[24],ATP硫酸化酶由许多亚基组成,其中结构基因可能是cys D-1。我们纯化并测定了这个基因的活性,结果低于(3.0×102±10.91)U/mg。ATP硫酸化酶的活性可能是由亚基共同构成的。APS还原酶的活力是(5.0×103±25.68)U/mg。亚硫酸盐的比活力(α亚基CysJ)为(24.03±0.76)U/mL,将α亚基与β亚基(CysI)融合后,比活力提高到了(39.52±1.17)U/mL。丝氨酸乙酰转移酶(CysE-1)的比活力为(18.08±0.55)U/mL。O-乙酰丝氨酸巯解酶(CysM)的活力为(5.0×104±52.68)U/mg。根据酶的特性,纯化的关键基因具有相关酶的活性,但是活力很低,尤其是由许多亚基构成的酶。然而,这些数据能够有效地说明这些关键基因编码的酶表现出了半胱氨酸合成的催化功能。
2.7 A. ferrooxidans ATCC 23270可能的硫酸盐同化途径根据对A. ferrooxidans硫酸盐同化基因的分析和描述绘制出的可能的硫酸盐同化途径(图 8)。硫被转运进细胞后,首先以磷酸腺苷硫酸(APS)的形式被ATP硫酸化酶(由cys D和cys N编码)同化。然后APS被APS还原酶(由cys H编码)还原为亚硫酸盐,亚硫酸盐被NADPH-亚硫酸盐还原酶(由cys JI编码)还原为硫化物。最后,硫化物与O-乙酰丝氨酸反应,被O-乙酰丝氨酸巯解酶(由cys M编码)还原为H2S,O-乙酰丝氨酸是丝氨酸乙酰转移酶(由cys E编码)利用乙酰辅酶A将丝氨酸乙酰化所得。

|
| 图 8 A. ferrooxidans ATCC 23270可能的硫酸盐同化途径 |
通过生物信息学的分析,发现了6个可能的硫酸盐同化途径相关的关键基因cys JI、cys H、cys D-2、cys N、cys D-1和cys NC。在微生物的基因组中,功能相关的基因往往处于同一个转录元件中。原核生物中,功能相同的基因往往位于基因组的相邻位置成簇出现,甚至一同转录,如色氨酸操纵子和乳糖操纵子都是研究的比较清楚的操纵子。因此,我们用Reverse transcriptase PCR技术对Cys操纵子进行了研究。Cys操纵子是A. ferrooxidans中与重金属抗性密切相关的基因簇,它们可能编码了一个多功能酶或者他们的表达是相连的,本研究通过Reverse transcriptase PCR技术从转录水平上验证了Cys操纵子上相关基因的共转录情况。实验中以反转录形成的cDNA为模板,对Cys操纵子上的相关基因进行PCR扩增。由以上电泳结果表明,(1) 所有以基因组为模板的阳性对照均有与目的片段长度相同的扩增条带出现,说明A. ferrooxidans菌中存在这些基因。(2) 空白对照全部没有扩增条带出现说明PCR体系没有被污染。(3) 阴性对照全部没有出现扩增条带,说明提取到的总RNA中没有基因组的DNA污染,结果准确可信。即:cys D-1和cys NC共转录。Cys JI、cys H、cys D-2、cys N共转录。CysD是ATP硫酸化酶蛋白家族一员,有研究发现,在硫酸盐的代谢过程中,ATP硫酸化酶会与其他与硫代谢相关的酶一起组成一个多酶复合体[25, 26, 27]。生物信息学研究也证实了A. ferrooxidans中CysN和CysD位于同一个操纵子上,他们的复合体CysDN 共同参与了ATP硫酸化酶的催化反应[24]。
实验对嗜酸氧化亚铁硫杆菌硫酸盐同化相关基因进行分析,对其关键基因进行体外表达性质研究,结果表明,硫酸盐同化的基本代谢路径可能为:被运输到体内的硫酸盐首先被cys DN编码的ATP硫酸化酶激活为APS(adenosine-5'-phosphosulfate),随后被cys H基因编码的APS还原酶还原为亚硫酸盐,亚硫酸盐又被cys JI编码的亚硫酸盐还原酶还原为硫化物,最后硫化物与O-乙酰丝氨酸由cys M编码的半胱氨酸合成酶同化入半胱氨酸。在硫酸盐的同化途径中发挥关键作用的是4个关键酶:ATP硫酸化酶(ATPS)、APS还原酶、亚硫酸盐还原酶(SIR)、半胱氨酸合成酶,并且硫的代谢也是嗜酸氧化亚铁硫杆菌(A. ferrooxidans)非常重要的能量代谢,其包括硫的氧化与还原。因而对嗜酸氧化亚铁硫杆菌进行硫酸盐同化的研究,对嗜酸氧化亚铁硫杆菌硫的代谢会提供重要的支撑,同时对其各方面研究提供了一定的基础。
4 结论生物信息学分析结果表明,基因cys JI、cys H、cys D-2、cys N、cys D-1和cys NC均与A. ferrooxidans ATCC 23270菌株硫酸盐同化途径有一定的相关性。Cys操纵子上相关基因的共转录结果表明,cys D-1和cys NC共转录。Cys JI、cys H、cys D-2、cys N共转录。用聚丙烯酰胺凝胶电泳检测的关键基因编码的相应蛋白质分子量分别是CysD-1为33.228 kD,CysH为28.203 kD,CysJ为66 kD,CysI为60 kD,CysE为28 kD,CysM为31.682 kD,大小与理论预测值相符;在硫酸盐的同化途径中发挥关键作用的是4个关键酶:ATP硫酸化酶(ATPS)、APS还原酶、亚硫酸盐还原酶(SIR)、半胱氨酸合成酶。A. ferrooxidans硫酸盐同化的基本代谢路径可能为:被运输到体内的硫酸盐首先被cys DN编码的ATP硫酸化酶激活为APS(adenosine-5'-phosphosulfate),随后被cys H基因编码的APS还原酶还原为亚硫酸盐,亚硫酸盐又被cys JI编码的亚硫酸盐还原酶还原为硫化物,最后硫化物与O-乙酰丝氨酸由cys M编码的半胱氨酸合成酶同化入半胱氨酸。
| [1] | 邓恩建, 杨朝晖, 曾光明, 等. 氧化亚铁硫杆菌的研究概况[J]. 黄金科学技术, 2005, 13(5):8-12. |
| [2] | 张琛, 郑红艾, 周笑绿, 等. 生物浸出技术的发展及其电化学研究现状[J]. 金属矿山, 2014(12):122-128. |
| [3] | 孙慧, 谷亚冰, 马丽媛, 等. 浸矿微生物生物膜的形成与调控研究现状[J]. 湿法冶金, 2015, 34(2):83-87. |
| [4] | 杨显万, 沈庆峰, 郭玉霞. 微生物湿法冶金[M]. 北京:冶金工业出版社, 2003:4-9. |
| [5] | Zheng CL, Zhang YF, Liu YD, et al. Characterization and Reconstitute of a[Fe4S4]Adenosine 5'-phosphosulfate Reductase from Acidithiobacillus ferrooxidans[J]. Current Microbiology, 2009, 58(6):586-592. |
| [6] | Zeng J, Wang M, Zhang X, et al. Expression, purification and characterization of the sulfite reductase hemo-subunit, SiR-HP, from Acidithiobacillus ferrooxidans[J]. Biotechnol Lett, 2008, 30(7):1239-1244. |
| [7] | Zheng CL, Nie L, Qian L, et al. K30, H150, and H168 are essential residues for coordinating pyridoxal 5'-Phosphate of O-acetylserine sulfhydrylase from Acidithiobacillus ferrooxidans[J]. Curr Microbiol, 2010, 60:461-465. |
| [8] | 郑春丽, 李艳君, 钱林, 等. 嗜酸氧化亚铁硫杆菌半胱氨酸合成酶的表达、纯化及其性质鉴定[J]. 生物技术通报, 2011(3):180-184. |
| [9] | Karamohamed S, Nyren P. Real-time detection and quantification of adenosine triphosphate sulfurylase activity by a bioluminometric approach[J]. Anal Biochem, 1999, 271(1):81-85. |
| [10] | Trüper HG, Lynne AR. Purification and properties of adenylyl sulfate reductase from the phototrophic sulfur bacterium, Thiocapsa roseopersicina[J]. J Bacteriol, 1971, 108(3):1112-1121. |
| [11] | Warrilow AGS, Hawkesford MJ. Separation, subcellular location and influence of sulphur nutrition on isoforms of cysteine dynthase in spinach[J]. J Exp Bot, 1998, 49(327):1625-1636. |
| [12] | Ostrowski J, Barber MJ, Rueqer DC, et al. Characterization of the flavoprotein moieties of NADPH-sulfite reductase from Salmonella typhimurium and Escherichia coli:Physicochemical and catalytic properties, amino acid sequence deduced from the DNA sequence of CysJ and comparison with NADPH-cytochrome P-450 reductase[J]. J Biol Chem, 1989, 264:15726-15737. |
| [13] | Kredich, KM, Tomkins, GM. The enzymic synthesis of L-Cysteine in Escherichia coli and Salmonella typhimurium[J]. J Biol Chem, 1966, 241(21):4955-4965. |
| [14] | Valdes J, Veloso F, Jedlicki E, et al. Metabolic reconstruction of sulfur assimilation in the extremophile Acidithiobacillus ferrooxidans based on genome analysis[J]. BMC Genomics, 2003, 4(51):1-16. |
| [15] | Jaramillo ML, Abanto M, Quispe RL, et al. Cloning, expression and bioinformatics analysis of ATP sulfurylase from Acidithiobacillus ferrooxidans ATCC 23270 in Escherichia coli[J]. Bioinformation, 2012, 8(15):694-704. |
| [16] | Takahashi H, Kopriva S, Giordano M, et al. Sulfur assimilation in photosynthetic organisms:molecular functions and regulations of transporters and assimilatory enzymes[J]. Annu Rev Plant Biol, 2011, 62:157-184. |
| [17] | Kredich NM. Biosynthesis of cysteine in Escherichia coli and Salmonella[J]. Cellular and Molecular Biology, 1996:514-527. |
| [18] | Guédon E, Verstraete IM. Cysteine metabolism and its regulation in bacteria[J]. Microbiol Monographs, 2007, 5:195-218. |
| [19] | Pinto R, Tang QX, Britton WJ, et al. The Mycobacterium tuberculosis CysD and CysNC Genes form a stress-induced operon that encodes a tri-functional sulfate-activating complex[J]. Microbiology, 2004, 150(Pt6):1681-1686. |
| [20] | Kopriva S, Heinz R. Control of sulphate assimilation and glutathione synthesis:Interaction with N and C metabolism[J]. Journal of Experimental Botany, 2004, 55(404):1831-1842. |
| [21] | Kelley BC, Tuovinen OH, Donald Nicholasen DJ. Utilization of 35S-thiosulphate and an appraisal of the role of ATP sulphurylase in chemolithotrophic Thiobacillus ferrooxidans[J]. Arch Microbiol, 1976, 109:205-208. |
| [22] | Kredich NM. Biosynthesis of cysteine[M]// Neidhardt FC. Escherichia coli and Salmonella, Cellular and Molecular Biology. Washington DC:ASM Press, 1996:514-527. |
| [23] | Zheng CL, Chen MJ, Tao ZL, et al. Differential expression of sulfur assimilation pathway genes in Acidithiobacillus ferrooxidans under Cd2+ stress:evidence from transcriptional, enzymatic, and metabolic profiles[J]. Extremophiles, 2015, 19:429-436. |
| [24] | 钱林, 郑春丽, 柳建设. 嗜酸氧化亚铁硫杆菌ATP硫酸化酶的表达、纯化及性质鉴定[J]. 生物技术通报, 2012(6):136-140. |
| [25] | Rachel P, Quing XT, Warwick JB, et al. The Mycobacterium tuberculosis CysD and CysNC genes form a stress-induced operaon that encodes a tri-functional sulfate-activating complex[J]. Microbiology, 2004, 150:1681-1686. |
| [26] | Mathew C, Susanna L, John M, et al. Complex formation between recombinant ATP sulfurylase and APS reductase of Allium cepa[J]. FEBS Letters, 2007, 581:4139-4147. |
| [27] | Carla S, Christel V, Ismael H, et al. Identification of a third sulfate activation system in Sinorhizobium sp. strain BR816:the CysDN sulfate activation complex[J]. Applied and Environmental Microbiology, 2003, 69(4):2006-2014. |






