2.福建省食品微生物与酶工程重点实验室,厦门 361021
2. Key Laboratory of Food Microbiology and Enzyme Engineering of Fujian Province,Xiamen 361021
虾青素(3,3'-二羟基-4,4'-二β-胡萝卜素)是一种橙红色类胡萝卜素,发现于多种微生物和海洋动物中,由于其独特的共轭双键结构和羟基,使得其具有比β-胡萝卜素和番茄红素更高的抗氧化活性。研究还发现虾青素具有防皮肤癌、抗炎、抗胃癌活性、保肝、抗糖尿病、心血管疾病的预防、免疫反应、神经保护等作用,虾青素由于其独特的颜色和生物活性被广泛应用于水产养殖、医药、保健食品、化妆品等行业中,具有巨大的前景价值[1]。
法夫酵母(Phafia rhodozyma/ Xanthophyllomyces dendrorhous)属于真菌界、真菌门、半知菌亚门、担子菌纲、隐球酵母科、法夫酵母属[2, 3],因其能天然合成虾青素且具有发酵条件简单易实现工业化生产等优点而受到广泛关注。法夫酵母中虾青素合成途径经过学者们的研究已被报道[4, 5],但是其调控机理还未完全阐明。法夫酵母中虾青素合成途径先由甲羟戊酸途径(MVA)合成萜类化合物前体——异戊烯焦磷酸(IPP),IPP受异戊烯焦磷酸异构酶基因(idi)表达的异戊烯焦磷酸异构酶作用生成二甲基丙烯焦磷酸(DMAPP),之后DAMPP再结合两分子的IPP生成法尼基焦磷酸(FPP),FPP在牻牛儿基牻牛儿基焦磷酸合成酶基因(crtE)表达的牻牛儿基牻牛儿基焦磷酸合成酶的作用下合成类胡萝卜素合成前体——牻牛儿基牻牛儿基焦磷酸(GGPP)。GGPP之后再经过番茄红素环化酶基因(crtYB)表达的八氢番茄红素合成酶,和番茄红素环化酶及八氢番茄红素脱氢酶基因(crtI)表达的八氢番茄红素脱氢酶催化生成β-胡萝卜素,β-胡萝卜素在虾青素合成酶基因(crtS)表达的虾青素合成酶的作用下合成最终产物虾青素,其中虾青素合成酶需要细胞色素P450还原酶基因(crtR)基因表达的细胞色素P450还原酶作为其辅酶[6]。
近年来有学者利用基因代谢工程技术,对类胡萝卜素合成相关基因进行异源表达或过量表达研究法夫酵母中虾青素合成途径的代谢调控机理。Xie等[7, 8]通过组合策略在酿酒酵母中构建一个可调控表达tHMG,crtE,crtYB和crtI基因的β-胡萝卜素合成途径,使β-胡萝卜素产量提高300多倍,达到11 mg/g,之后又对前体FPP的上游、下游以及支路代谢流进行有序的调节,平衡类胡萝卜素合成途径中间产物的利用率,使得类胡萝卜素的细胞产率达到20.79 mg/g;Sören等[9]通过结合传统诱变和基因工程技术的手段,在诱变得到高产虾青素的法夫酵母菌株后过量表达tHMG、crtE、crtYB和crtS基因,最终得到一株虾青素细胞产率达9.1 mg/g的虾青素高产菌株;Shi等[10]通过比较不同温度对酿酒酵母产β-胡萝卜素以及相关基因的表达情况的影响,发现低温促进β-胡萝卜素的合成,同时相关基因的表达量也有少量提高;Csernetics等[11]通过在Mucor circinelloides中异源表达法夫酵母的crtS和crtR基因,总类胡萝卜素的含量得到提高,同时虾青素占总类胡萝卜素比例比单独表达crtS基因的高,说明crtR基因对crtS基因有协同促进作用。
本实验室前期筛选得到两株法夫酵母突变菌株,分别为JMU-VDL668和JMU-N3菌株,前者产虾青素,但是总类胡萝卜素细胞产率低。后者与前者相比积累较多的类胡萝卜素,但是不产虾青素。本研究从这两株特征突变菌株出发,通过对这两株菌的产类胡萝卜素特性以及类胡萝卜素合成相关基因的表达差异进行检测,在代谢过程和基因表达两个层面探索他们产类胡萝卜素特性差异的原因,为进一步阐明虾青素合成调控机理提供参考,同时也为后期对这两株菌进行定向改造提供思路。
1 材料与方法 1.1 材料 1.1.1 菌种JMU-VDL668和JMU-N3菌株由本实验室保藏。
1.1.2 培养基YPD培养基[12]:称取10 g酵母膏、20 g蛋白胨溶解于900 mL水中,121℃高压灭菌20 min,然后加入100 mL 200 g/L葡萄糖溶液(115℃高压灭菌15 min)。
1.2 方法 1.2.1 种子液的培养取-70℃保存的菌种,接种于装有30 mL YPD培养基的250 mL摇瓶中,接种量为1 mL,22℃、190 r/min 条件下于摇床中培养3 d得1代摇瓶种子。取1 mL 1代摇瓶种子液转接到新鲜的YPD培养基中,于相同的条件下培养48 h得到2代摇瓶种子。
1.2.2 摇瓶发酵培养将5 mL摇瓶种子液接入装有150 mL YPD培养基的500 mL摇瓶中,在22℃、190 r/min的条件下培养4 d,需要添加β-胡萝卜素的样品在设定的时间内添加4 mg/L β-胡萝卜素。每12 h取样一次。
1.2.3 生物量的测定先将离心管置于105℃烘至恒重,称重m1;取5 mL培养液加入离心管,离心弃上清,沉淀用蒸馏水洗涤两遍,最后置于105℃烘至恒重,称重m2;菌体干重m为m2、m1之差。
1.2.4 发酵液中残糖的测定采用DNS法[13](3,5-二硝基水杨酸法)测定发酵液中的还原糖。
1.2.5 总类胡萝卜素含量的测定采用二甲基亚砜(DMSO)法[2]破壁:取2.5 mL发酵液,离心后沉淀用蒸馏水洗涤2次,加入预热至75℃的二甲基亚砜2 mL,充分振荡摇匀后,加入5 mL乙醇振荡均匀,3 500 r/min离心5 min取上清液,用乙醇定容至10 mL。紫外分光光度计在474 nm波长下进行检测总类胡萝卜素[14]。
1.2.6 类胡萝卜素成分的测定使用Aglient 1200高效液相色谱仪(G1315 DAD检测器),Nova-Pak C18柱(3.9×150 mm,4 μm)检测类胡萝卜素中的不同成分,流速为1.0 mL/min,柱温30℃,柱压0-3 000 psi,进样量20 μL,检测波长474 nm。梯度条件如表 1所示,用虾青素、β-胡萝卜素和β-隐黄质(Si-mga)标准品制作标准曲线。
分别取24、36、48、60、72、84和96 h的发酵液,3 500 r/min,离心8 min收集法夫酵母菌体,然后用PBS缓冲液洗涤菌体两次,对离心收集到的菌体进行液氮研磨。取0.1 g粉末,根据TRI REAGENT总RNA提取试剂盒使用说明提取法夫酵母总RNA。采用RS232C蛋白分析仪测定RNA的浓度及OD260/OD280值,并用2%的普通琼脂糖凝胶电泳检测RNA完整性,样品保存于-70℃。利用TransScriptTM First-Strand cDNA Synthesis SuperMix(全式金)试剂盒对提取的RNA进行逆转录合成cDNA第一条链,作为后续实时定量PCR的模板。
1.2.8 引物的设计选取法夫酵母中类胡萝卜素合成相关基因crtE,crtYB,crtI,crtS和crtR基因进行实时定量检测,β-actin作为内参基因。根据NCBI数据库中法夫酵母β-actin,crtE,crtI,crtYB,crtS和crtR基因mRNA的序列,按照实时定量PCR引物设计原则[15],用Primer Premier 5.0软件设计引物并合成,引物序列见表 2。
选用TransStart Top Green qPCR Mix(全式金)试剂盒,按说明书建立20 μL反应体系:SYBR GreenⅠMix(2×)10 μL,上下游引物各0.3 μL,Dye I 0.4 μL,cDNA模板2 μL,ddH2O 7.4 μL;反应程序:94℃ 30 s,94℃ 5 s,60℃ 31 s,40个循环。反应在ABI 7300实时定量PCR仪上进行,每个处理设置3次重复,记录仪器输出的RQ值,以β-actin基因为内参基因,所有结果以2-∆∆CT法计算相对定量值。
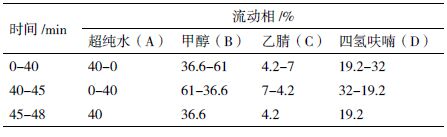
2 结果 2.1 JMU-VDL668和JMU-N3菌株不同培养时间细胞生长特性比较分析JMU-VDL668和JMU-N3菌株生物量随时间变化趋势(图 1-A),可知JMU-N3菌株生长旺盛,生长速率比JMU-VDL668菌株快,培养48 h生物量达到最大,为15.29 g/L,JMU-VDL668生物量最大可达12.22 g/L。48 h左右时JMU-VDL668和JMU-N3两株菌进入稳定期,生物量略有下降,可能是由于细胞在生长后期破裂自溶引起的。
从图 1-B中可以看出,JMU-N3菌株的耗糖速率大于JMU-VDL668菌株。在培养36 h时,两株菌培养基中的糖已基本耗尽,但对比这两株菌的生长曲线,自36-48 h还有较大幅度的细胞增长,可能是因为在培养前期,培养基中葡萄糖浓度较高,产生了克雷布特里效应,对酵母的呼吸产生抑制作用,使酵母在发酵过程中生成乙醇、甘油等糖代谢副产物,葡萄糖耗尽后,解除了克雷布特里效应,菌株开始利用乙醇或甘油等糖代谢产物,所以可以继续生长。随着培养基中的葡萄糖消耗完全,两株菌逐渐进入稳定期。
|
| 图 1 JMU-VDL668和JMU-N3菌株的细胞生长特性 |
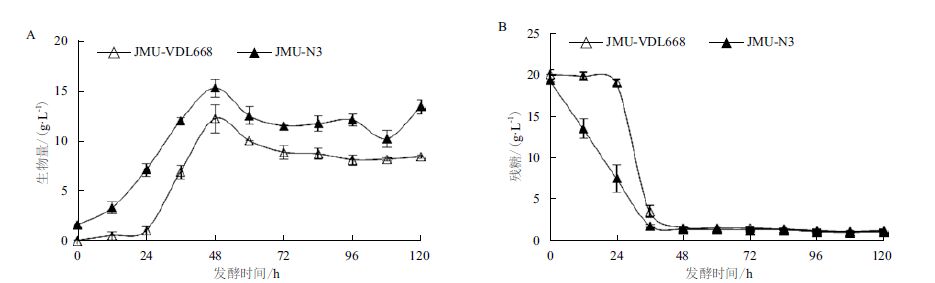
JMU-VDL668和JMU-N3菌株的产类胡萝卜素特效变化如图 2所示,JMU-VDL668菌株中的总类胡萝卜素细胞产率低于JMU-N3菌株,其中以虾青素为主。在整个发酵过程中,JMU-VDL668菌株中虾青素的细胞产率始终占总类胡萝卜素的80%以上,最高可达98.2%。在24-72 h期间JMU-VDL668菌株的总类胡萝卜素和虾青素均快速积累,随后一段时间内总类胡萝卜素和虾青素的细胞产率变化不大,其中虾青素细胞产率最高仅为0.25 mg/g。JMU-N3菌株中检测到β-胡萝卜素和β-隐黄质,但没检测到虾青素,积累的类胡萝卜素产物以虾青素前体物质β-隐黄质为主,最高可达0.31 mg/g,而β-胡萝卜素的细胞产率远低于其下游产物β-隐黄质。总类胡萝卜素细胞产率在0-108 h间不断积累,至108 h时最高达0.52 mg/g。β-隐黄质的积累和总类胡萝卜素积累的趋势类似,β-胡萝卜素在24 h处已达到最大积累量,仅为0.033 mg/g,随后一直保持稳定。
|
| 图 2 JMU-VDL668(A)和JMU-N3(B)菌株的产类胡萝卜素特性 |
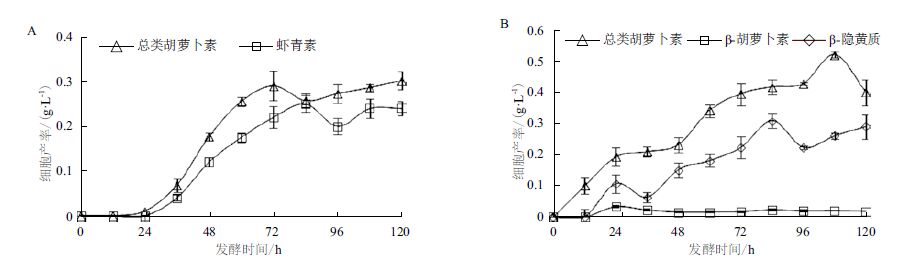
图 3显示,crtE、crtYB、crtI和crtS基因均有在JMU-N3和JMU-VDL668菌株中表达。JMU-N3菌株不产虾青素,却有检测到crtS基因的表达,而crtR基因则只在JMU-VDL668菌株中检测到。JMU-N3菌株中crtE基因的表达量在24-96 h均高于JMU-VDL668菌株,其中在72 h表达差异达到最大,到84 h表达差异显著下降,到96 h又有所提高;crtYB基因的表达在整个发酵过程都高于JMU-VDL668菌株,其中分别在48 h和96 h有较大的表达差异;crtI基因的表达量在24-96 h均高于JMU-VDL668菌株,其中在24 h表达差异最大;crtS基因的表达量也在整个发酵过程均高于JMU-VDL668菌株,其中在96 h时表达差异较大。总体来说,JMU-N3菌株中crtE、crtYB、crtI和crtS基因的表达水平均比JMU-VDL668菌株的表达水平高。
|
| 图 3 JMU-VDL668和JMU-N3菌株中虾青素合成途径相关基因的表达差异结果 |
分析JMU-VDL668菌株中产类胡萝卜素的特性可以看出,总类胡萝卜素含量低可能是限制JMU-VDL668菌株中虾青素产量提高的因素。因此本研究在JMU-VDL668菌株培养的不同时间点添加4 mg/L β-胡萝卜素,并检测添加24 h后该菌产类胡萝卜素的变化,采用SPSS软件进行差异显著性分析。结果(表 3)显示,与对照组相比,0 h添加β-胡萝卜素,培养24 h后JMU-VDL668菌株的总类胡萝卜素细胞产率提高到307 μg/g,β-胡萝卜素细胞产率提高8倍,虾青素细胞产率变化不大,表明0 h时JMU-VDL668菌株可以从外界摄入了β-胡萝卜素,但是β-胡萝卜素合成量的增加并不能提高虾青素的细胞产率。在发酵24 h和36 h添加时,添加组和对照组总类胡萝卜素细胞产率均在300 μg/g左右,添加组的不同类胡萝卜素的细胞产率与对照组相比均无显著差异,表明在这两个时间点时JMU-VDL668菌株不能从外界摄入β-胡萝卜素。在48 h添加时,两个实验组的类胡萝卜细胞产率无明显的差异,均大于400 μg/g,添加组的β-胡萝卜素细胞产率为对照组的2倍,虾青素细胞产率却比对照组低了33 μg/g。在72 h和96 h添加时,添加组的总类胡萝卜素细胞产率均在350 μg/g左右,高出实验组近50 μg/g,β-胡萝卜素和虾青素的细胞产率均大于对照组,其中在96 h添加β-胡萝卜素时JMU-VDL668菌株中虾青素的细胞产率比对照组提高了83%。
虾青素作为法夫酵母中的次级代谢产物,代谢途径复杂,合成虾青素的过程受多种机制的调控,其中类胡萝卜素合成关键酶基因的表达水平直接影响法夫酵母菌株中类胡萝卜素的合成,对类胡萝卜素的合成具有重要作用[16]。本研究通过对JMU-VDL668和JMU-N3菌株进行发酵,结果发现JMU-N3菌株的生长速率较快,生物量也高于JMU-VDL668菌株,葡萄糖的利用速率也比JMU-VDL668高,不过两株菌的细胞生长的整体趋势相差较小。两株菌产类胡萝卜素的特性发现JMU-N3菌株从发酵初期就迅速合成类胡萝卜素,而JMU-VDL668菌株则是24 h后才开始迅速合成。JMU-VDL668菌株中总类胡萝卜素细胞产率低于JUM-N3菌株,类胡萝卜素的成分以虾青素为主。JMU-N3菌株虽然积累较多的总类胡萝卜素,但是其中主要为β-隐黄质,未检测到虾青素的合成。对JMU-N3和JMU-VDL668菌株中类胡萝卜素合成相关基因的表达差异进行分析,发现两者存在较显著的差异,推测这两株菌产类胡萝卜素特性差异与类胡萝卜素合成相关基因的表达差异存在一定的相关性。
法夫酵母中与类胡萝卜素合成直接相关的关键酶基因有crtE、crtI和crtYB基因。Breitenbach等[17]在法夫酵母中过量表达crtE基因,其β-胡萝卜素的产量增加了接近2倍,但虾青素的含量却没有相应的提高;Miao等[18]发现在不同的生长时期,高产虾青素的法夫酵母菌株的crtE基因的表达水平高于野生型菌株2-8倍,crtE的表达水平与GGPP的产量呈正相关,提高crtE的表达量在一定范围内提高总类胡萝卜素的含量;Verdoes等[19]将crtYB基因连接到一个同源的gpd启动子上进行crtYB基因的过量表达,检测到β-胡萝卜素和海胆酮等产物的大量积累,由此推测可能是由于大量表达crtYB基因,导致更多的番茄红素环化酶被合成,促进了双环类胡萝卜素的生产;Verdoes等[19]发现过量表达crtI基因则使类胡萝卜素往单环途径合成;Visser等[20]发现法夫酵母由crtI基因表达的八氢番茄红素脱氢酶和crtYB基因表达的番茄红素环化酶之间的竞争结果决定番茄红素的代谢流是朝着β-胡萝卜素转化成虾青素的方向,还是通过3,4-二氢番茄红素生成HDCO。crtI基因的过量表达反而不利于双环番茄红素的大量积累,可能还需与crtYB基因协同调控才能起到促进虾青素合成的作用。从这些学者的研究中可以发现,在crtI与crtYB基因协同作用的情况下,总类胡萝卜素的含量与这3个基因的表达量呈正相关关系。本研究中JMU-N3菌株的crtE、crtI和crtYB基因的表达量整体均比JMU-VDL668菌株高,因此推测这些基因的高表达有可能是JMU-N3菌株中总类胡萝卜素细胞产率较JMU-VDL668菌株高的主要原因。
crtS基因作为目前为止发现的唯一一个催化β-胡萝卜素转化成虾青素过程中的基因,对于其表达的虾青素合成酶的作用是同时具有酮化和羟化的功能还是只有羟化的功能还没有定论[21, 22],但是通过基因敲除以及比较高产菌株与低产菌株发现,crtS基因的表达与虾青素产量存在正相关关系[18, 23];Ukibe等[24]在酿酒酵母中异源表达来自法夫酵母中的crtI、crtYB和crtS基因时发现没有虾青素生成,但是在共表达来自法夫酵母的crtR基因后则有虾青素合成,说明法夫酵母中crtS基因表达的虾青素合成酶对于crtR基因表达的细胞色素P450还原酶有选择特异性。crtS基因表达的虾青素合成酶需要由crtR基因表达的细胞色素P450还原酶作为辅酶来完成从β-类胡萝卜素到虾青素的转化[4],这些研究说明crtR基因对于虾青素的合成是必不可少的。在本研究中JMU-VDL668菌株中的crtS基因整体表达量比JMU-N3菌株低,而JMU-N3菌株虽然有较高的crtS基因表达量,但是未检测到crtR基因的表达,这个结果有可能是导致JMU-N3菌株不产虾青素的主要原因。
本研究还在不同时间点往JMU-VDL668菌株的培养基中添加β-胡萝卜素,结果发现在72 h和96 h添加时,JMU-VDL668菌株的虾青素细胞产率得到一定的提高,其中在96 h添加β-胡萝卜素时,JMU-VDL668菌株中虾青素的细胞产率与对照相比提高了83%,当吸收外界添加的β-胡萝卜素后其虾青素细胞产率就显著提高,一定程度在代谢水平上解释类胡萝卜素合成相关基因的低表达有可能导致总类胡萝卜素合成不足限制虾青素的合成。Krivoruchko、Verwaal等[25, 26]研究发现类胡萝卜素因其高疏水性,只能储存在膜系统中,如果大量积累的话会对细胞产生代谢压力,不利于细胞生长。在本研究中也发现不同时间点添加β-胡萝卜素时,添加组的总类胡萝卜素细胞产率总是在300-400 μg/g之间。因此推测在JMU-VDL668菌种中总类胡萝卜素的细胞产率可能存反馈调节机制,当JMU-VDL668自身合成的总类胡萝卜素细胞产率低于这个范围时,可以从环境中吸收β-胡萝卜素,当高于这个范围时则会受到反馈调节,抑制类胡萝卜素的合成。
通过对JMU-VDL668和JMU-N3株菌在代谢水平和基因表达水平的研究发现,这两株菌的产类胡萝卜素特性与类胡萝卜素合成相关基因的表达量可能存在一定的正相关关系,且JMU-VDL668菌株中总类胡萝卜素细胞产率在一定范围内,可能存在反馈调节机制。虽然通过提高类胡萝卜素合成相关基因的表达量可以提高总类胡萝卜素的产量,但是在微生物中,代谢产物的合成还受到转录后修饰,翻译水平,酶的活性、基因和酶之间的相互关系等多方面的调控。结合本研究的一些发现以及Xie等[7]的研究结果表明,有效的提高法夫酵母中虾青素含量不但要提高相关基因的表达水平,同时还需对法夫酵母中的虾青素合成相关代谢流以及不同类胡萝卜素合成相关基因之间的表达进行有序协调的控制。利用基因工程和代谢工程技术对法夫酵母菌株进行高效有目的性的改良还需对类胡萝卜素合成途径相关的调控机理进行更系统和深入的研究。
4 结论本研究通过比较JMU-VDL668和JMU-N3株菌中产类胡萝卜素特性,与类胡萝卜素合成相关基因表达差异之间的关系来研究法夫酵母中的类胡萝卜素合成的代谢调控机理。结果发现法夫酵母中类胡萝卜素的合成和类胡萝卜素合成相关基因的表达量存在一定的正相关关系,且crtR基因在虾青素合成中具有重要作用。JMU-VDL668菌株中合成类胡萝卜素相关基因的表达水平比JMU-N3菌株低,使得其总类胡萝卜素细胞产率低,不能为虾青素的合成提供足够的前体,限制虾青素的合成。而JMU-N3菌株中类胡萝卜素合成相关基因的表达水平比JMU-VDL668菌株高,使得其总类胡萝卜素细胞产率比JMU-N3菌株高,但是由于crtR基因得不到表达或者表达量低,使得其不能产虾青素。
| [1] | Ambati RR, Moi PS, Ravi S, et al. Astaxanthin:sources, extraction, stability, biological activities and its commercial applications—A Review[J]. Marine Drugs, 2014, 12(1):128-152. |
| [2] | Johnson EA, Lewis MJ. Astaxanthin formation by the yeast Phaffia rhodozyma[J]. Journal of General Microbiology, 1979, 115(1):173-183. |
| [3] | Johnson EA. Phaffia rhodozyma:colorful odyssey[J]. International Microbiology, 2003, 6(3):169-174. |
| [4] | Verdoes JC, Sandmann G, Visser H, et al. Metabolic engineering of the carotenoid biosynthetic pathway in the yeast Xanthophyllomyces dendrorhous(Phaffia rhodozyma)[J]. Applied and Environmental Microbiology, 2003, 69(7):3728-3738. |
| [5] | Schmidt I, Schewe H, Gassel S, et al. Biotechnological production of astaxanthin with Phaffia rhodozyma/Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2011, 89(3):555-571. |
| [6] | Tao L, Wilczek J, Odom JM, et al. Engineering a β-carotene ketolase for astaxanthin production[J]. Metabolic Engineering, 2006, 8(6):523-531. |
| [7] | Xie W, Liu M, Lv X, et al. Construction of a controllable β-carotene biosynthetic pathway by decentralized assembly strategy in Saccharomyces cerevisiae[J]. Biotechnology and Bioengineering, 2014, 111(1):125-133. |
| [8] | Xie W, Ye L, Lv X, et al. Sequential control of biosynthetic pathways for balanced utilization of metabolic intermediates in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2015, 28:8-18. |
| [9] | Gassel S, Breitenbach J, Sandmann G. Genetic engineering of the complete carotenoid pathway towards enhanced astaxanthin formation in Xanthophyllomyces dendrorhous starting from a high-yield mutant[J]. Applied Microbiology and Biotechnology, 2014, 98(1):345-350. |
| [10] | Shi F, Zhan W, Li Y, et al. Temperature influences β-carotene production in recombinant Saccharomyces cerevisiae expressing carotenogenic genes from Phaffia rhodozyma[J]. World Journal of Microbiology and Biotechnology, 2014, 30(1):125-133. |
| [11] | Cserneticsá, Tóth E, Farkas A, et al. Expression of Xanthophyllo-myces dendrorhous cytochrome-P450 hydroxylase and reductase in Mucor circinelloides[J]. World Journal of Microbiology and Biotechnology, 2014, 31(2):321-336. |
| [12] | 周德庆. 微生物学教程[M]. 北京:高等教育出版社, 1993. |
| [13] | 王俊丽, 聂国兴, 李素贞, 等. DNS法测定还原糖含量时最适波长的确定[J]. 河南农业科学, 2010(4):115-118. |
| [14] | 倪辉. 法夫酵母虾青素发酵条件的优化及提取与分析研究[D]. 杭州:浙江大学, 2005. |
| [15] | Bustin SA. The MIQE guidelines:minimum information for publication of quantitative real-time PCR experiments[J]. Clin Chem, 2009, 55(3):611-622. |
| [16] | Marcoleta A, Niklitschek M, Wozniak A, et al. Glucose and ethanol-dependent transcriptional regulation of the astaxanthin biosynthesis pathway in Xanthophyllomyces dendrorhous[J]. BMC Microbiol, 2011, 11:190. |
| [17] | Breitenbach J, Visser H, Verdoes JC, et al. Engineering of geranyl-geranyl pyrophosphate synthase levels and physiological conditions for enhanced carotenoid and astaxanthin synthesis in Xanthophyll-omyces dendrorhous[J]. Biotechnology Letters, 2011, 33(4):755-761. |
| [18] | Miao L, Chi S, Tang Y, et al. Astaxanthin biosynthesis is enhanced by high carotenogenic gene expression and decrease of fatty acids and ergosterol in a Phaffia rhodozyma mutant strain[J]. FEMS Yeast Research, 2011, 11(2):192-201. |
| [19] | Verdoes J, Krubasik P, Sandmann G, et al. Isolation and functional characterisation of a novel type of carotenoid biosynthetic gene from Xanthophyllomyces dendrorhous[J]. Molecular and General Genetics MGG, 1999, 262(3):453-461. |
| [20] | Visser H. Metabolic engineering of the astaxanthin-biosynthetic pathway of Xanthophyllomyces dendrorhous[J]. FEMS Yeast Research, 2003, 4(3):221-231. |
| [21] | Ojima K, Breitenbach J, Visser H, et al. Cloning of the astaxanthin synthase gene from Xanthophyllomyces dendrorhous(Phaffia rhodozyma)and its assignment as a β-carotene 3-hydroxylase/4-ketolase[J]. Molecular Genetics and Genomics, 2006, 275(2):148-158. |
| [22] | lvarez V, Rodríguez-Sáiz M, De La Fuente JL, et al. The crtS gene of Xanthophyllomyces dendrorhous encodes a novel cytochrome-P450 hydroxylase involved in the conversion of β-carotene into ast-axanthin and other xanthophylls[J]. Fungal Genetics and Biology, 2006, 43(4):261-272. |
| [23] | Lodato P, Alcaíno J, Barahona S, et al. Expression of the carotenoid biosynthesis genes in Xanthophyllomyces dendrorhous[J]. Biological Research, 2007, 40(1):73-84. |
| [24] | Ukibe K, Hashida K, Yoshida N, et al. Metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance[J]. Applied and Environmental Microbiology, 2009, 75(22):7205-7211. |
| [25] | Krivoruchko A. Opportunities for yeast metabolic engineering:Lessons from synthetic biology[J]. Biotechnology Journal, 2011, 6(3):262-276. |
| [26] | Verwaal R, Wang J, Meijnen JP, et al. High-level production of beta-carotene in Saccharomyces cerevisiae by successive transformation with carotenogenic genes from Xanthophyllomyces dendrorhous[J]. Applied and Environmental Microbiology, 2007, 73(13):4342-4350. |