2.中国农业科学院兰州畜牧与兽药研究所,兰州 730050
3.甘肃省牦牛繁育工程重点实验室,兰州 730050
2. Lanzhou Institute of Husbandry and Pharmaceutical Sciences,Chinese Academy of Agricultural Sciences,Lanzhou 730050
3. Key Laboratory of Yak Breeding Engineering,Lanzhou 730050
生长转化因子9(Growth differentiation factor 9,GDF9)和骨形态发生蛋白15(Bone morphogenetic protein 15,BMP15)都作为转化生长因子(TGF-β)超家族的成员,参与早期卵泡的生长和分化。1978年TGF-β由Delarco和Todaro在研究病毒时发现,它因具有促进单层培养的成纤维细胞转化并形成克隆而得名,TGF-β是目前发现最大的细胞内信号蛋白家族[1]。其成员以自分泌和旁分泌的形式参与细胞生物活性的调节[2, 3]。GDF9最早由Lee以TGF-β家族的保守区域为模板设计简并引物克隆得到,采用Northern blotting在小鼠卵巢中检测到mRNA表达[4]。而BMP15最早是在绵羊中发现的,Aaltonen[6]根据其基因的保守性首次克隆了小鼠的BMP15基因,后期以它为模板相继得到了人、大鼠及羊的BMP15的序列[5]。Aaltonen在卵母细胞中发现BMP15的特异性表达。研究初期认为它们表达模式相似且仅在动物卵巢组织特异性表达,后期经深入研究发现不同物种表达定位存在不同。对牛羊的研究发现GDF9在睾丸和下丘脑组织中也表达,同时对人的研究显示在非性腺组织也检测到GDF9的表达。表明GDF9不仅在卵母细胞的排卵过程中表达[7, 8]。后期有研究者对啮齿类动物研究发现GDF9在睾丸和下丘脑组织中也表达,同时对人的研究显示在非性腺组织也检测到GDF9的表达。BMP15也不仅在卵巢中表达,在人[6]和牛[9]睾丸及小鼠[10]垂体中均检测到微量表达。随着对GDF9和BMP15的深入研究表明这些生长因子可能潜在调节垂体和睾丸的功能,参与调节动物生殖过程[11]。
miRNA是一类非编码小分子RNA,长约20 nt,通过结合靶mRNA的3' UTR导致其或抑制翻译,参与调控转录后过程,进而参与生命进程。有研究表明,miRNA在卵巢及睾丸组织中参与调控。2007年Ro等[12]小鼠卵巢中克隆得到122个miRNA,并对其进行半荧光定量PCR分析,发现其在卵巢和睾丸组织中均表达,而后发现包含miR-ov15和miR-ov9共4个miRNA在卵巢中特异性表达。2008年Otsuka[13]发现Dicer(d/d)小鼠不育,将正常小鼠卵巢移植到此小鼠上可得到后代,将Dicer(d/d)小鼠卵巢移植到正常小鼠中无怀孕现象,说明卵巢发育是影响繁殖的关键因素。对Dicer(d/d)小鼠研究发现,miR-17-5p和let-7b影响黄体血管长度和数量,将其注射到Dicer(d/d)小鼠中可恢复黄体血管生成,但不能使胎儿发育,可能还有其他miRNA共同参与调节。Tang等[14]在Dicer基因敲除小鼠卵泡中检测到有些mRNA和蛋白质高分度表达,说明敲除Dicer基因可减少成熟miRNA产生,可减少靶mRNA的降解和翻译抑制作用。Byrne[15]研究发现miR-125a可靶调节Ped基因调控小鼠胚胎发育。
牦牛作为高寒地区的特有牛种,主要分布于青海、西藏、四川、甘肃和云南等高寒草原区[16]。牦牛具有适应能力强,耐粗饲,耐寒冷等特点,从而可在含氧量低,牧草季节短,气候寒冷的条件下生存繁衍,它也是一种经济价值很高的物种,可为当地牧民提供肉、奶、皮及役力等生活生产资料。
牦牛属于单胎动物,一胎一犊且世代间隔较长的特点极大地限制了牦牛的数量,以期采用常规的遗传选择法进行优化提高双胎率进展缓慢。加大与排卵数相关主效基因的研究,这是提高繁殖性能最直接且有效的方法。目前关于GDF9和BMP15影响动物繁殖力的研究逐渐增多,但关于GDF9、BMP15在牦牛生殖过程中的研究有限。因此,本研究对牦牛GDF9、BMP15基因外显子区克隆并进行相关生物信息学分析,旨在为进一步开展牦牛GDF9、BMP15基因的研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 组织样、细菌菌株和载体用于本研究的牦牛样品采自于甘肃省大通牦牛育种场。用常规的酚氯仿提取法提取血样中基因组DNA;利用TRizol法提取各组织中的总RNA;大肠杆菌E.coli DH5α购自TIANGEN公司;pGEM-T easy克隆载体购自Promega公司。
1.1.2 分子生物学试剂DNA提取试剂盒、琼脂糖凝胶回收试剂盒、质粒提取试剂盒、Taq酶、IPTG和Amp均购于TIANGEN公司;TRizol Reagent购自Invitrogen公司;荧光定量试剂盒SYBR Premix Ex TaqTM II购自TaKaRa。
1.1.3 引物设计与合成根据GenBank已知的牦牛GDF9(NW_005393189)和BMP15(NW_005393997)基因序列分别设计克隆引物、表达引物。根据TargetScan预测得到miRNA设计表达引物,引物(表 1)由英潍捷基贸易有限公司合成。
健康成年牦牛血液组织为材料,使用DNA提取试剂盒提取牦牛总DNA,利用紫外分光光度计测定260 nm 波长下OD值,检测浓度和纯度。
1.2.2 RNA的提取组织样品采自3头青海牦牛均为雌性,根据厂商说明利用TRizol法提取各组织中的总RNA,使用琼脂糖凝胶电泳检测其质量,Thermo公司的NanoDrop 2000检测其浓度及纯度。
1.2.3 反转录根据TaKaRa反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser说明依次进行,但miRNA实时荧光定量表达研究所用反转录引物采用反转录引物混合液,各取1 μL RT primer加到78 μL ddH2O中均匀混合用作反转录引物混合液。GDF9和BMP15基因在各组织中的表达以β-actin为内参,扩增条件:95℃ 30 s,95℃ 5 s,60℃ 30 s,65℃ 5 s,72℃ 45 s,40个循环。bta-miR-193a-3p和bta-miR-193b表达以U6为内参基因,扩增条件:95℃ 30 s,95℃ 5 s,58℃ 30 s,72℃ 45 s,45个循环。
1.2.4 GDF9和BMP15基因的克隆琼脂糖凝胶电泳检测PCR 产物,利用DNA凝胶回收试剂盒回收,琼脂糖凝胶电泳检测回收物质量。再将回收产物连接pGEM-T easy载体,T4连接酶16℃过夜连接,以此构建重组质粒。将重组质粒转化感受态细胞E.coli DH5α,37℃震荡培养60 min后,涂布于含有Amp和IPTG等成分的LB 固体培养基,培养基37℃过夜培养。挑取白色阳性菌落接种于LB液体培养基过夜培养。提取质粒双酶切鉴定,将鉴定为阳性的菌落送至公司测序。
1.2.5 GDF9和BMP15基因序列的生物信息学分析 1.2.5.1 理化性质分析采用ExPASy(http://www.expasy.org/)等软件进行生物信息学分析,包括开放阅读框,氨基酸组成,等电点,疏水性质等理化性质,信号肽,跨膜区,磷酸化位点;运用SOPMA(http://nhjy.hzau.edu.cn/kech/swxxx/jakj/dianzi/Bioinf7/Expasy/Expasy8.htm)和SWISS-MODEL(http://www.swissmodel.expasy.org/)软件预测蛋白质的二级和三级结构。
1.2.5.2 进化分析运用Clust W软件进行多序列同源性比对,NCBI数据库分别下载GDF9和BMP15基因编码蛋白的序列,其中包括人(NP_005251.1;NP_005439.2),小鼠(XP_006532283.1;NP_0338-87.1),猪(NP_001001909.1;NP_001005155.1),山羊(NP_001272637.1;NP_001272517.1),狗(XP_005626415.1;XP_003640322.1),骆驼(XP_01097-9701.1;XP_010996367.1),黄牛(XP_010805521.1;NP_001026922.1),水牛(XP_006050617.1;XP_00-6059547.1),熊猫(XP_002912947.1;XP_0029305-52.1),狒狒(NP_001162234.1;XP_003917771.1)和牦牛共11个物种,运用MEGA5.10软件基于邻位归并法(NJ法)构建系统发生树。
1.2.6 GDF9和BMP15基因靶标miRNA预测运用TargetScan在线预测软件(http://www.targetscan.org/),以GDF9和BMP15基因作为靶基因,参数为系统默认,预测靶定此基因的miRNA。
2 结果 2.1 牦牛GDF9和BMP15基因的序列分析以大通牦牛血液总DNA为模板扩增GDF9基因两个外显子区,PCR产物电泳结果(图 1)显示,得到两条清晰的条带,大小分别是500 bp和1 265 bp,与预期目的条带相符,测序后得到长度分别为411 bp(位于1-411 bp处)和1 082 bp(位于410-1 491 bp处)的两条核苷酸序列,拼接后得到完整外显子区序列(图 2)。运用在线BLAST比对测序得到序列与公布的GDF9 mRNA序列只有1个碱基(位于112位)的差异,相似性达99%,具有较高的同源性,初步认为得到序列是牦牛GDF9外显子区序列。

|
| 图 1 牦牛GDF9和BMP15基因PCR扩增产物的电泳图 |

|
| 图 2 牦牛GDF9基因编码蛋白序列 |
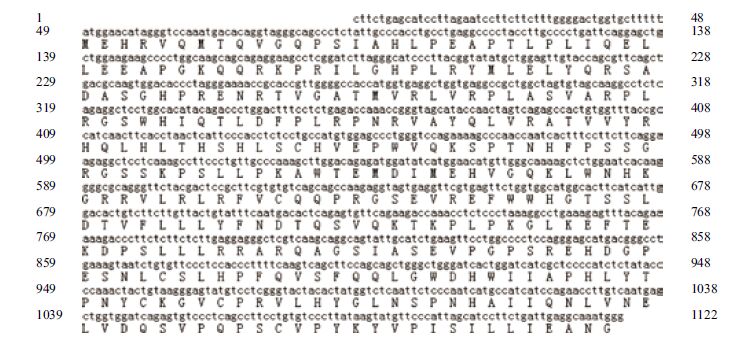
|
| 图 3 牦牛GDF9基因编码蛋白序列 |
以大通牦牛血液总DNA为模板扩增BMP15基因外显子区,PCR产物电泳结果(图 1)显示,得到两条清晰大小分别是450 bp和1 055 bp的片段,结果与预期相似,测序得到长度分别为323 bp(位于1-323 bp处)和802 bp(位于321-1 122 bp处)的两条核苷酸序列,拼接后得到外显子区序列如图 3。运用在线BLAST比对得到序列与公布的BMP15 mRNA序列相似性高达100%,初步认为得到序列是牦牛BMP15外显子区序列。
2.2 牦牛GDF9和BMP15蛋白的生物信息学分析 2.2.1 牦牛GDF9和BMP15基因编码蛋白一级结构序列分析运用在线ExPASy 软件(http://www.expasy.org/)分析牦牛GDF9基因编码蛋白理化性质,此蛋白分子量为51.947 6 kD,理论等电点pI=8.99。含有20种氨基酸,其中Leu以11.3%最多且远高于其他氨基酸,Trp以1.5%最少。通过ORF Finder软件对所得序列进行开放阅读框分析,得到长为1 362 bp的开放阅读框,编码453个氨基酸,编码蛋白为亲水性蛋白。SignalP 4.1预测信号肽表明,该基因编码蛋白质含有一个信号肽,切割位点位于25和26位氨基酸之间。TMHMM预测无跨膜区,非跨膜蛋白。GDF9基因编码蛋白15个潜在磷酸化位点。
运用在线ExPASy 软件分析牦牛BMP15基因编码蛋白理化性质,此蛋白分子量为40.838 9 kD,理论等电点pI=9.62。含有20种氨基酸,其中Leu以11.7%最多远高于其他氨基酸,Cys和Met以1.7%最少。有长为1 119 bp的开放阅读框,编码372个氨基酸。无信号肽、跨膜区,为非跨膜蛋白。磷酸化位点预测显示,BMP15基因编码蛋白共有6个潜在磷酸化位点。
2.2.2 牦牛GDF9和BMP15基因编码蛋白二级和三级结构序列分析运用SOPMA在线软件预测GDF9二级结构。结果(图 4)显示,该基因编码蛋白二级结构中无规则卷曲占据最多,而β转角最少,其中α螺旋区为138个氨基酸,延伸链为76个氨基酸,β转角为23个氨基酸,无规则卷曲为216个氨基酸,分别占30.36%、16.78%、5.08%和47.68%。利用SwissModel进行同源建模预测牦牛GDF9基因编码蛋白三级结构,结果如图 5所示。

|
| 图 4 牦牛GDF9基因编码蛋白二级结构分析 |

|
| 图 5 牦牛GDF9基因编码蛋白三级结构预测 |
运用SOPMA在线软件预测BMP15二级结构结果(图 6)显示,该基因编码蛋白二级结构与GDF9相似,其中α螺旋区为99个氨基酸占27.65%,延伸链为67个氨基酸占18.72%,β转角为29个氨基酸占8.10%,无规则卷曲为163个氨基酸占45.53%。同源建模预测牦牛BMP15基因编码蛋白三级结构,结果如图 7所示。

|
| 图 6 牦牛BMP15基因编码蛋白二级结构分析 |

|
| 图 7 牦牛BMP15基因编码蛋白三级结构预测 |
运用MEGA5.10软件基于NJ法分别构建GDF9和BMP15基因系统发生树,结果(图 8,图 9)表明,牦牛GDF9和BMP15基因均与黄牛亲缘关系最近,与水牛次之。
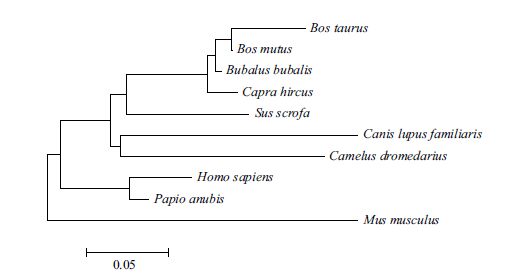
|
| 图 8 牦牛GDF9基因编码蛋白系统发育树(NJ法) |
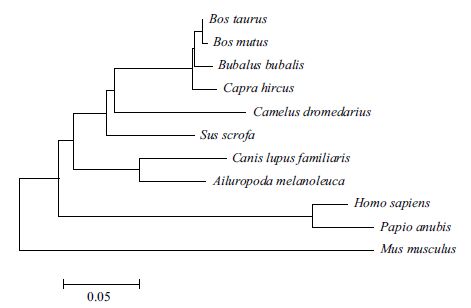
|
| 图 9 牦牛BMP15基因编码蛋白系统发育树(NJ法) |
采用RT-PCR技术分别对心、肾、肝、肌肉、胰、脾、卵巢和子宫等八种组织进行差异表达分析(图 10)。以GDF9在肌肉中的表达量为内对照,GDF9在卵巢和子宫中表达相对较高,在胰和脾中不表达,BMP15仅在卵巢中表达。
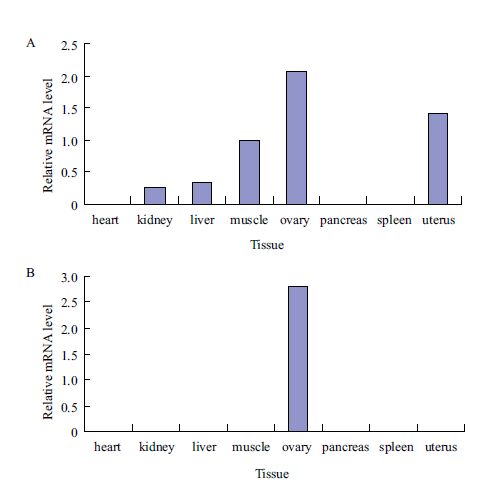
|
| 图 10 牦牛GDF9(A)和BMP15(B)基因在各组织 表达量 |
运用TargetScan在线软件预测,GDF9共预测得到28个miRNA,BMP15无结果。本研究选择属于microRNA-193家族的bta-miR-193a-3p和bta-miR-193b进行研究,采用RT-PCR技术分别对筛选得到的两个miRNA在心、脾、肺、肾和子宫5种组织进行差异表达分析,以bta-miR-193a-3p在脾中的表达量为内对照,结果见图 11。bta-miR-193a-3p整体表达量低于bta-miR-193b,但脾中表达量相对较高,且显著高于其他组织,在心、肺和子宫中均不表达。bta-miR-193b在心和肾中未检测到表达,在肺中的表达量显著低于脾和子宫中。

|
| 图 11 bta-miR-193a-3p(A)和bta-miR-193b(B)牦牛各组 织中表达量 |
近年来,对于GDF9和BMP15基因的研究备受关注,已有研究证明GDF9和BMP15影响羊繁殖力,其中GDF9通过旁分泌的方式影响卵泡的生长分化,而BMP15则是主要借助卵泡发育过程中抑制FSH受体在颗粒细胞中的表达来发挥调节作用,它们之间同源性较高且结构相似,功能上表现出协同效应。
本研究运用生物信息学方法预测了牦牛GDF9和BMP15基因编码蛋白的结构和功能。通过对其二级结构预测可知GDF9的α螺旋占30.36%、延伸链16.78%、β转角5.08%,无规则卷曲47.68%,BMP15的α螺旋占27.65%,延伸链18.72%,β转角8.10%,无规则卷曲45.53%,从而形成高级结构发挥其特定功能,均完成了三维建模。它们分别作为TGF-β家族中GDF 和BMP亚家族成员参与细胞生物活性的调节,因其一级和二级结构相似于家族成员,其功能也具有相似性。有研究表明转录起始位点二级结构稳定性决定翻译起始效率,稳定性越高表达率越低[17]。而对绵羊的研究发现GDF9突变形成突变杂合体,使其表达量降低致使卵巢排卵数增加引起多胎现象[18]。原因之一可能是牦牛二级结构不如绵羊稳定使其多胎现象少于绵羊。但牦牛GDF9和BMP15基因编码蛋白质真正的生物学功能有待于进一步研究。利用编码氨基酸序列同其他10个物种进行聚类分析并构建系统发育树,从物种之间的进化关系可看出牦牛GDF9和BMP15基因编码蛋白与黄牛最为接近,符合动物之间的分类地位。
GDF9和BMP15表达模式相似,研究初认为两者仅在卵巢中表达,经过深入研究发现不同物种之间有所区别。Fitzpatrick[19]在对大鼠和小鼠的研究中发现GDF9仅在卵巢、睾丸和下丘脑中表达,子宫中未检测到表达,而后期在对人的研究中发现,在性腺和非性腺组织,如垂体、子宫和骨髓中也检测到GDF9的表达。Elis[20]发现鸡BMP15在卵巢和其他组织中均有表达。Clelland[21]对斑马鱼的研究发现,BMP15在卵巢和睾丸中高表达,而在心脏、肝脏、肌肉、肠道和脑组织中也表达。本研究检测牦牛GDF9和BMP15在各组织中表达情况,发现GDF9基因不仅在卵巢和子宫中表达,在肝脏和肌肉中也检测到表达,而BMP15仅在卵巢中表达;但GDF9和BMP15均主要在性腺组织中高表达。
miRNA在卵泡生成、排卵、卵母细胞成熟和黄体功能等方面起到重要作用[13]。目前对于miRNA影响繁殖力的研究主要集中于对卵巢周期排卵影响。Fiedle等[22]研究发现经过hCG处理前后的颗粒细胞,有13个miRNA差异表达,其中miR-132和miR-212经处理后表达量明显上调,后经研究确定miR-132和miR-212可通过结合寡核苷酸阻碍cAMP介导的成熟miRNA表达与功能。2010年Yao[23]曾用TFG-β1处理小鼠腔前颗粒细胞后发现miR-224表达量明显上调,后经TFG-β超家族Ⅰ型受体抑制剂阻断效应物Smad2/3磷酸化处理后,发现上调作用减弱,表明TFG-β1/Smads通路可调节miR-224的表达,发现miR-224可通过靶定Smad4增加颗粒细胞增生和细胞雌二醇释放,而内源性miR-224的抑制能够阻碍由TFG-β1介导的颗粒细胞增生。Yao[24]研究发现孕酮分泌过程中,经FSH处理12 h后,miR-29a和miR-30d表达量明显下降,处理48 h后表达量又显著增加。有研究表明micro-193家族成员miR-193b可通过靶定GRB7蛋白,侵袭人子宫内膜腺癌细胞系HEC-1B,抑制GRB7蛋白表达从而参与子宫内部调节[25]。通过对micro-193家族的bta-miR-193a-3p和bta-miR-193b进行表达量分析,发现子宫作为影响产仔数的关键因素之一,bta-miR-193a-3p在子宫中无表达,在脾和肾中表达量相对较高,而bta-miR-193b在子宫中表达量较高,推测bta-miR-193b可能总用于靶定GDF9基因,为调控牦牛多胎性的miRNA。
4 结论牦牛GDF9基因克隆得到两个片段长分别411 bp和1 082 bp,共编码453个氨基酸;BMP15基因克隆得到片段长分别为323 bp和802 bp,共编码372个氨基酸,系统进化分析表明牦牛GDF9和BMP15均和黄牛亲缘关系最近,结果符合理论。
GDF9在卵巢和子宫中表达相对较高,BMP15仅在卵巢中表达。预测GDF9和BMP15的靶定miRNA,对micro-193家族的bta-miR-193a-3p和bta-miR-193b进行表达量分析发现bta-miR-193a-3p整体表达量低于bta-miR-193b,但脾中表达量相对较高,显著高于其他组织。bta-miR-193b在心和肾中未检测到表达,在肺中的表达量显著低于脾和子宫中。推测bta-miR-193b可能作用于靶定GDF9基因,参与牦牛多胎性的调控。
| [1] | Massague J, Blain SW, Lo RS. TGFbeta signaling in growth control, cancer, and heritable disorders[J]. Cell, 2000, 103(2):295-309. |
| [2] | Peng C. The TGF-beta superfamily and its roles in the human ovary and placenta[J]. Journal of Obstetrics and Gynaecology Canada, 2003, 25(10):834-844. |
| [3] | Knight PG, Glister C. TGF-13 superfamily members and ovarian follicle development[J]. Reproduction, 2006, 132(2):191-206. |
| [4] | McPherron AC, Lee SJ. GDF-3 and GDF-9:two new members of the transforming growth factor-beta superfamily containing a novel pattern of cysteines[J]. Journal of Biological Chemistry, 1993, 268(5):3444-3449. |
| [5] | Dube JL, Wang P, Elvin J, et al. The bone morphogenetic protein 15 gene is X-linked and expressed in oocytes[J]. Molecular Endocrinology, 1998, 12(12):1809-1817. |
| [6] | Aaltonen J, Laitinen MP, Vuojolainen K, et al. Human growth differentiation factor 9(GDF-9)and its novel homolog GDF-9B are expressed in oocytes during early folliculogenesis[J]. Journal of Clinical Endocrinology & Metabolism, 1999, 84(8):2744-2750. |
| [7] | Bodensteiner K, Clay C, Moeller C, et al. Molecular cloning of the ovine growth/differentiation factor-9 gene and expression of growth/differentiation factor-9 in ovine and bovine ovaries[J]. Biology of Reproduction, 1999, 60(2):381-386. |
| [8] | Jayawardana BC, Shimizu T, Nishimoto H, et al. Hormonal regulation of expression of growth differentiation factor-9 receptor type I and II genes in the bovine ovarian follicle[J]. Reproduction, 2006, 131(3):545-553. |
| [9] | Pennetier S, Uzbekova S, Perreau C, et al. Spatio-temporal expression of the germ cell marker genes MATER, ZAR1, GDF9, BMP15, and VASA in adult bovine tissues, oocytes, and preimplantation embryos[J]. Biology of Reproduction, 2004, 71(4):1359-1366. |
| [10] | Otsuka F, Shimasaki S. A novel function of bone morphogenetic protein-15 in the pituitary:selective synthesis and secretion of FSH by gonadotropes[J]. Endocrinology, 2002, 143(12):4938-4941. |
| [11] | Juengel JL, Bodensteiner KJ, Heath DA, et al. Physiology of GDF9 and BMP15 signalling molecules[J]. Animal Reprod Sci, 2004, (82-83):447-460. |
| [12] | Ro S, Song R, Park C, et al. Cloning and expression profiling of small RNAs expressed in the mouse ovary[J]. RNA, 2007, 13(12):2366-2380. |
| [13] | Otsuka M, Zheng M, et al. Impaired microRNA proce-ssing causes corpus luteum insufficiency and infertility in mice[J]. The Journal of Clinical Investination, 2008, 118(5):1944-1954. |
| [14] | Tang KF, Song GB, Shi YS, et al. Dicer knockdown induces fibronectin-1 expression in HEK293T calls via induction of Egr1[J]. Biochimica et Biophysica Acta, 2010, 1800(3):380-384. |
| [15] | Byrne MJ, Warner CM. MicroRNA expression in preimplantation mouse embryos from Ped gene positive compared to Ped gene negative mice[J]. Journal of Assisted Reproduction and Genetic, 2008, 25(5):205-214. |
| [16] | 郭宪, 阎萍, 曾玉峰, 等. 中国牦牛遗传资源现状分析[J]. 中国畜禽种业, 2008, 1:60-62. |
| [17] | Desmit MH, Van DJ. Control of translation by mRNA secondary str-ucture in Escherichia coli. A quantitative analysis of literature date[J]. Journal of Molecular Biology, 1994, 244(2):144-155. |
| [18] | Hanrahan JP, Greqan SM, Mulsant P, et al. Mutations in the genes for oocyte-derived growth factors GDF9 and BMP15 are associated with both increased ovulation rate and sterility in Cambridge and Belclare sheep(Ovis aries)[J]. Biology of Reproduction, 2004, 70(4):900-909. |
| [19] | Fitzpatrick SL, Sindoni DM, Shuqhrue PJ, et al. Expression of growth differentiation factor-9 messenger ribonucleic acid in ovarian and nonovarian rodent and human tissues[J]. Endocrinology, 1998, 139(5):2571-2578. |
| [20] | Elis S, Dupont J, Couty I, et al. Expression and biological effects of bone morphogenetic protein-15 in yhe hen ovary[J]. Journal of Endocrinology, 2007, 194(3):485-497. |
| [21] | Clelland E, Kohli G, Campbell RK, et al. Bone morphogenetic protein-15 in the zebrafish ovary:complementary deoxyribonucleic acid cloning, genomic organization, tissue distribution, and role in oocyte maturation[J]. Endocrinology, 2006, 147(1):201-209. |
| [22] | Fiedler SD, Carletti MZ. Hormonal regulation of MicroRNA expression in periovulatory mouse mural granulose cells[J]. Biol Reprod, 2008, 79(6):1030-1037. |
| [23] | Yao G, Yin M, Lian J, et al. Micro-224 is involved in transforming growth factor-beta-mediated mouse granulose cell proliferation and granulose cell function by targeting Smad4[J]. J Mol Endocrinol, 2010, 24(3):540-551. |
| [24] | Yao N, Yang BQ, et al. Follicle-stimulating hormone regulation of microRNA expression on progesterone production in cultured rat granulose cell[J]. Endocrine, 2010, 38(2):158-166. |
| [25] | 李荣, 陈雪梅, 何俊琳, 等. Has-miR-193b抑制人子宫内膜腺癌细胞株HEC-1B侵袭能力[J]. 第三军医大学学报, 2011, 33(15):1594-1597. |





