肝癌是威胁人类健康的重大疾病,其患病率和致死率在我国逐年增加,如何有效地预防和治疗肝癌目前仍是临床上亟待解决的难题[1]。肿瘤细胞转移是指细胞穿破组织屏障侵入周边组织,并通过淋巴液和血液循环到达靶位点后形成新的肿瘤。肿瘤细胞的恶性程度与转移能力成正比[2, 3]。阻断肿瘤细胞的转移是治疗肿瘤的主要方向之一。肿瘤细胞的迁移行为受到多种因素调控,多种细胞旁分泌或肿瘤细胞自分泌的趋化/细胞因子对肿瘤细胞的迁移行为都会产生关键的调控作用[4]。深入了解各种化学因子对肝癌细胞迁移行为的影响及其机理将对肝癌的临床治疗提供帮助。
溶血磷脂酸(Lysophosphatidic acid,LPA)作为一种多功能生物活性磷脂,能够参与调控包括细胞迁移、增殖、分化以及存活能力等在内的多种生物学行为,广泛存在于大多数组织中。目前已发现6种不同的LPA受体(LPA receptor,LPAR),分别命名为LPAR1-6,在细胞中发挥着各自不同的作用,且广泛参与LPA影响癌细胞生物学行为的过程[5-7]。近来的研究发现,LPA高表达于卵巢癌和腹膜癌等癌症患者的血清和腹水中,推测LPA同癌症的发生发展密切联系[8, 9]。但LPA是否调控肝癌细胞迁移行为,是否导致肝癌恶化加速尚不明晰。据此,本文主要研究LPA对两种转移程度不同的肝癌细胞迁移能力的影响,并试图阐明在LPA影响肝癌细胞迁移过程中起调控作用的LPAR种类,旨为临床上肝癌的治疗和靶向抗肿瘤药物的研发提供参考。
1 材料与方法 1.1 材料 1.1.1 肝癌细胞高转移性人肝癌细胞株MHCC97H,购于上海东方肝胆研究所;低转移性人肝癌细胞株HepG2,由中国人民解放军第三军医大学基础部提供。
1.1.2 主要试剂、耗材高糖DMEM培养基和小牛血清购于Gbico公司;LPA购于Aladdin生化科技股份有限公司;Ki16425购于Selleck公司;LPAR1-6及GAPDH引物合成于Invitrogen公司;RNA提取试剂盒购于Bio Teke公司;反转录试剂盒和PCR试剂盒购于TaKaRa公司;结晶紫粉末购于Sigma Aldrich公司;Transwell小室购于Millipore公司;细胞培养板购于Beaver公司;细胞计数板购于上海精工公司。
1.2 方法 1.2.1 细胞培养MHCC97H和HepG2细胞复苏后,采用完全高糖DMEM培养基(含10%小牛血清,100 U/mL青霉素及100 U/mL链霉素)于37℃,5% CO2 +95%空气的饱和湿度培养箱中进行常规培养。待细胞生长到铺满细胞瓶底面80%左右,用0.25%胰酶消化进行传代。
1.2.2 细胞迁移分析采用Transwell法分析细胞的迁移能力。取对数生长期的MHCC97H和HepG2细胞,饥饿处理12 h后用胰酶消化制成2×105个/mL浓度的细胞悬液。在无菌24孔细胞培养板中分别加入含LPA终浓度依次为0、0.1、1、10和50 µmol/L的无血清培养基600 µL,并将小孔孔径为8 µm的Transwell小心置入孔板内,于Transwell上室加入100 µL浓度为2×105个/mL的细胞悬液。在采用Ki16425处理的抑制实验中,需提前对细胞采用含10 µmol/L Ki16425的无血清培养基处理30 min,再将处理后的细胞加入Transwell上室,添加含10 µmol/L LPA的无血清培养基600 µL;其对照组和LPA组细胞分别加入同体积的含LPA终浓度为0 µmol/L和10 µmol/L的无血清培养基。将细胞培养板放置于孵箱中静置培养12 h后取出,小心拭去Transwell上室未迁移的细胞,采用结晶紫染色液进行染色,倒置风干后于倒置相差显微镜下随机选取4个视野进行拍照,统计分析视野中迁移的细胞数目,计算细胞的相对迁移倍数。
1.2.3 细胞增殖分析采用细胞计数法检测细胞增殖情况。取对数生长期的细胞制成悬液,以1×106个/孔接种到六孔板中培养24 h后,换无血清培养基饥饿12 h,然后每孔依次加入含LPA终浓度为0、0.1、1、10和50 µmol/L的无血清培养基2 mL培养12 h。消化制成细胞悬液,对每孔细胞进行细胞计数。
1.2.4 LPAR的mRNA表达分析采用RT-PCR检测细胞中LPAR在mRNA水平的表达。取对数生长期的细胞制成悬液,以2×106个/孔接种到六孔板中,培养24 h后弃去培养基,分别按照BioTeke说明书提取两种细胞的总RNA,按照TaKaRa说明书进行cDNA第一链合成,并将所得产物进行PCR扩增。所用引物序列如下表 1所示。反应条件:95℃预变性5 min,95℃ 30 s,60℃ 30 s,72℃ 1 min,35个循环;72℃延伸10 min。对所得PCR产物进行2%琼脂糖凝胶电泳,分析两种细胞中LPAR1-6的表达。
实验结果以平均值±标准差(x±s)表示,采用Student's t-test进行两组数据间的统计分析,定义P < 0.05为具有显著性差异。
2 结果 2.1 LPA对肝癌细胞迁移行为的影响采用Transwell法检测了0-50 µmol/L LPA作用下,两种细胞迁移能力的变化情况。
如图 1所示,不同浓度的LPA作用12 h后均能明显促进MHCC97H细胞的迁移能力,并且在0-10 µmol/L浓度作用下促迁移效果呈现剂量依赖关系,在LPA的浓度达到10 µmol/L时促迁移现象最为明显,实验组细胞的迁移能力达到对照组的3倍。虽然50 µmol/L LPA作用组较之10 µmol/L作用组对细胞迁移能力的促进作用有所下降,但也能明显促进MHCC97H细胞的迁移能力,为对照组的2倍。值得注意的是,在相同的实验条件下,LPA对低转移性肝癌细胞HepG2的迁移能力没有明显影响(图 2)。
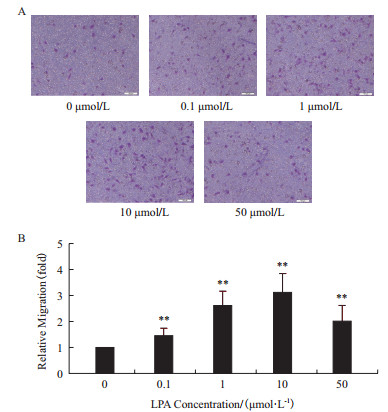
|
| 图 1 不同浓度的LPA对高转移性肝癌细胞MHCC97H迁移能力的影响 A:Transwell法检测细胞的迁移(标尺=100 µm);B:MHCC97H细胞迁移统计图(**P < 0.01,n=4) |

|
| 图 2 LPA浓度对低转移性肝癌细胞HepG2迁移能力的影响 A:Transwell法检测细胞的迁移(标尺=100 µm);B:HepG2细胞迁移统计图(n=4) |
为了排除在LPA促肝癌细胞迁移的过程中细胞增殖对结果产生的影响,采用细胞计数法检测了在不同浓度的LPA作用12 h后细胞增殖能力的变化情况。结果(图 3)显示,不同浓度的LPA作用12 h后对MHCC97H和HepG2细胞的增殖均没有产生明显影响。
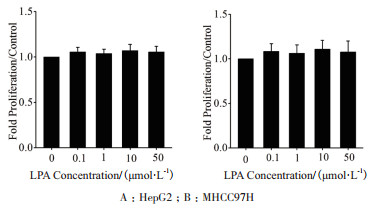
|
| 图 3 LPA浓度的对两种肝癌细胞增殖的影响(n=4) |
为了研究两种不同转移能力肝癌细胞响应LPA促迁移作用的差异是否源于两种细胞上LPAR表达的不同,分别检测了两种细胞中LPAR1-6在mRNA水平的表达情况。实验结果(图 4)显示,在高转移肝癌细胞MHCC97H中表达LPAR1、LPAR2、LPAR5和LPAR64种LPA受体,缺失了LPAR3和LPAR4的表达;在低转移肝癌细胞HepG2中表达LPAR2、LPAR3、LPAR4、LPAR5和LPAR6五种受体,缺失了LPAR1的表达。

|
| 图 4 两种不同转移能力肝癌细胞中LPA受体的表达 H:HepG2;M:MHCC97H |
进一步采用LPAR1的特异抑制剂Ki16425处理MHCC97H细胞,阻断LPA与LPAR1的结合后发现,在Transwell实验中,Ki16425能够明显抑制LPA诱导的MHCC97H细胞的迁移(图 5)。
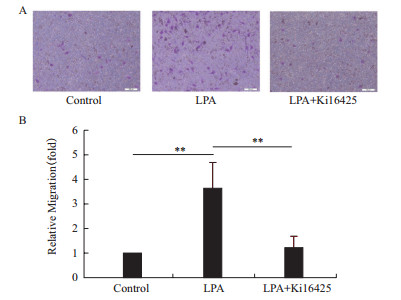
|
| 图 5 Ki16425抑制LPA诱导的MHCC97H细胞迁移 A:Ki16425对MHCC97H细胞迁移的抑制作用(标尺=100 µm);B:MHCC97H细胞迁移统计图(**P < 0.01,n=4) |
本文研究了LPA对两种转移程度不同的人肝癌细胞迁移能力的影响,实验结果表明,LPA仅能诱导高转移性的肝癌细胞MHCC97H的迁移,这与大多数文献关于LPA对肿瘤细胞迁移能力的影响结果相符。例如,Shida等[10]的研究报道,LPA能够显著诱导结肠癌细胞DLD1的迁移能力;同样,Du等[11]在对乳腺癌细胞MDA-MB-231的研究中也发现了相似的结果。尽管人们对LPA影响相关肿瘤细胞迁移能力有了一定的认识,但目前LPA影响不同转移能力肿瘤细胞的迁移行为还鲜有报道[12, 13]。我们的研究发现,LPA对高转移性的肝癌细胞MHCC97H的迁移能力有明显促进作用,但对低转移性肝癌细胞HepG2的迁移并没有产生明显的影响,该实验结果提示转移能力不同的肿瘤细胞的迁移行为对LPA的响应可能存在差异。
LPA与其受体结合是细胞生物学行为响应LPA的前提。由于两种不同转移能力肝癌细胞对LPA的促迁移作用表现出不同的响应方式,因此,为了探明造成这种差异的具体原因,我们采用RT-PCR技术检测了两种细胞中LPAR1-6的表达情况。实验结果表明,两种细胞中LPAR的表达模式不同,MHCC97H表达LPAR1、LPAR2、LPAR5和LPAR6,不表达LPAR3和LPAR4。而HepG2表达LPAR2-6,不表达LPAR1,提示这种响应差异很可能来自于细胞间表达LPAR的不同。在这6种相关的LPAR中,LPAR1能够通过耦联的G蛋白激活下游多条信号通路来刺激细胞内黏着斑和伪足的形成、细胞骨架的重排[14],同时,抑制细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的堆积[15],从而促进细胞的迁移。因此,大量的研究认为LPAR1对细胞的迁移起主要介导作用,在对人肝癌细胞SK-Hep1[16]、结肠癌细胞DLD1[10]、前列腺癌细胞PC3[17]等癌细胞的研究中均证实了这一观点。有趣的是,LPAR1在肿瘤组织中的表达普遍高于健康组织,表达丰度同组织的恶性程度呈正比[18],且某些不响应LPA促迁移作用的癌细胞中普遍缺失了LPAR1的表达,这可能解释了低转移性的肝癌细胞HepG2中不表达LPAR1的原因[19]。当然,目前也有研究报道在某些肿瘤细胞中,LPA的促迁移作用不是通过LPAR1进行传导的,例如,Kato等[20]对仓鼠胰腺癌细胞的研究工作就表明LPA的促迁移行为是通过LPAR3进行传导的,并且在敲除LPAR1后有利于细胞响应LPA的作用;Yamada等[21]在对人恶性胸膜间皮瘤细胞的研究中也发现,LPAR2调控了LPA的促迁移信号,LPAR1并不参与其中。为了明确两种肝癌细胞迁移响应LPA的差异是否与LPAR1相关,我们进一步利用LPAR1的特异性抑制剂Ki16425阻断MHCC97H细胞中LPA R1与LPA的结合,结果发现LPA对MHCC97H细胞迁移促进作用消失。因此,我们可以初步判定,在MHCC97H中LPAR1介导了LPA对细胞迁移的诱导作用,而HepG2不响应LPA的促迁移作用很可能源于该细胞中缺失了LPAR1的表达。
我们的研究表明,不同转移能力的细胞对LPA的响应可能存在差异。就肝癌细胞而言,高转移性的肝癌细胞细胞响应LPA的促迁移作用,而低转移性的肝癌细胞不响应LPA的作用,这与Sokolov等[22]的研究结果相似。我们的研究结果为LPA影响不同转移能力癌细胞的迁移行为以及该过程中涉及到的可能分子机理提供了实验参考。由于目前我们只针对两种高低转移能力不同的肝癌细胞系进行了研究,并未涉及到更多转移能力不同的细胞间比较,加之癌细胞种类繁杂,这种响应差异与细胞转移程度的关联是否存在规律性,还需进一步的研究验证。
4 结论LPA可显著促进高转移性肝癌细胞MHCC97H的迁移,但对低转移性肝癌细胞HepG2的迁移行为没有明显影响,这种影响差异与两种细胞表达LPAR谱系不同有关。HepG2细胞缺失LPAR1的表达可能是其不响应LPA促迁移作用的重要原因。
| [1] | Ahmedin J, Freddie B, Center MM, et al. Global cancer statistics. Ca Cancer J Clin, 2011, 61 (2): 69–90. DOI:10.3322/caac.v61:2 |
| [2] | Sun J, Luo Q, Liu L, et al. Biomechanical profile of cancer stem-like cells derived from MHCC97H cell lines. J Biomech, 2016, 49 (1): 45–52. DOI:10.1016/j.jbiomech.2015.11.007 |
| [3] | Bhattacharya S, Darjatmoko SR, Polans AS, et al. Resveratrol modulates the malignant properties of cutaneous melanoma through changes in the activation and attenuation of the antiapoptotic protooncogenic protein Akt/PKB. Melanoma Res, 2011, 21 (3): 180–187. DOI:10.1097/CMR.0b013e3283456dfc |
| [4] | Luo Z, Wang Q, Lau WB, et al. Tumor microenvironment :the culprit for ovarian cancer metastasis. Cancer Lett, 2016, 377 (2): 174–182. DOI:10.1016/j.canlet.2016.04.038 |
| [5] | Liona-Minguez S, Ghasssemian A, Helleday T. Lysophosphatidic acid receptor (LPAR) modulators :the current pharmacological toolbox. Prog Lipid Res, 2015, 58 : 51–75. DOI:10.1016/j.plipres.2015.01.004 |
| [6] | Liu Y, An S, Ward R, et al. G protein-coupled receptors as promising cancer targets. Cancer Lett, 2016, 376 (2): 226–239. DOI:10.1016/j.canlet.2016.03.031 |
| [7] | Leblanc R, Peyruchaud O. New insights into the autotoxin/LPA axis in cancer development and metastasis. Exp Cell Res, 2015, 333 (2): 183–189. DOI:10.1016/j.yexcr.2014.11.010 |
| [8] | Celine P, Simon O, Saulnier-Blache B. Lysophosphatidic acid synthesis and release. Prostaglandins, 2001, 64 (1-4): 1–10. |
| [9] | Mills GB, Moolenaar WH. The emerging role of lysophosphatidic acid in cancer. Nat Rev Cancer, 2003, 3 (8): 582–591. DOI:10.1038/nrc1143 |
| [10] | Shida D, Kitayama J, Yamaguchi H, et al. Lysophosphatidic acid enhances the metastatic potential of human colon carcinoma DLD1 cells through LPA1. Cancer Res, 2003, 63 (7): 1706–1711. |
| [11] | Du J, Sun C, Hu Z, et al. Lysophosphatidic acid induces MDAMB-231 breast cancer cells migration through activation of PI3K/PAK1/ERK signaling. PLoS One, 2010, 5 (12): e15940. DOI:10.1371/journal.pone.0015940 |
| [12] | Willier S, Butt E, Grunewald TG. Lysophosphatidic acid (LPA) signalling in cell migration and cancer invasion :a focussed review and analysis of LPA receptor gene expression on the basis of more than 1700 cancer microarrays. Biol Cell, 2013, 105 (8): 317–33. DOI:10.1111/boc.2013.105.issue-8 |
| [13] | Herrema H, Czajkowska D, Theard D, et al. Rho kinase, myosin-Ⅱ, and p42/44 MAPK control extracellular matrix-mediated apical bile canalicular lumen morphogenesis in HepG2 cells. Mol Biol Cell, 2006, 17 (7): 3291–3303. DOI:10.1091/mbc.E06-01-0067 |
| [14] | Ji WC, Herr DR, Noguchi K, et al. LPA receptors :subtypes and biological actions. Annu Rev Pharmacol Toxicol, 2010, 50 (1): 157–86. DOI:10.1146/annurev.pharmtox.010909.105753 |
| [15] | Guo R, Kasbohm EA, Arora P, et al. Expression and function of lysophosphatidic acid LPA1 receptor in prostate cancer cells. Endocrinology, 2006, 147 (10): 4883–4892. DOI:10.1210/en.2005-1635 |
| [16] | Park SY, Jeong KJ, Panupinthu N, et al. Lysophosphatidic acid augments human hepatocellular carcinoma cell invasion through LPA1 receptor and MMP-9 expression. Oncogene, 2011, 30 (11): 1351–1359. DOI:10.1038/onc.2010.517 |
| [17] | Hao F, Tan M, Xu X, et al. Lysophosphatidic acid induces prostate cancer PC3 cell migration via activation of LPA1, p42 and p38α. Biochim Biophys Acta, 2007, 1771 (7): 883–892. DOI:10.1016/j.bbalip.2007.04.010 |
| [18] | Yamada T, Sato K, Komachi M, et al. Lysophosphatidic acid in malignant ascites stimulates motility of human pancreatic cancer cells through LPA1. J Biol Chem, 2004, 279 (8): 6595–6605. |
| [19] | Komachi M, Tomura H, Malchinkhuu E, et al. LPA1 receptors mediate stimulation, whereas LPA2 receptors mediate inhibition, of migration of pancreatic cancer cells in response to lysophosphatidic acid and malignant ascites. Carcinogenesis, 2009, 30 (3): 457–465. DOI:10.1093/carcin/bgp011 |
| [20] | Kato K, Yoshikawa K, Tanabe E, et al. Opposite roles of LPA1 and LPA3 on cell motile and invasive activities of pancreatic cancer cells. Tumour Biol, 2013, 33 (5): 1739–1744. |
| [21] | Yamada T, Yano S, Oqino H, et al. Lysophosphatidic acid stimulates the proliferation and motility of malignant pleural mesothelioma cells through lysophosphatidic acid receptors, LPA1 and LPA2. Cancer Sci, 2008, 99 (8): 1603–1610. DOI:10.1111/cas.2008.99.issue-8 |
| [22] | Sokolov E, Eheim AL, Ahrens WA, et al. Lysophosphatidic acid receptor expression and function in human hepatocellular carcinoma. J Surg Res, 2013, 180 (1): 104–113. DOI:10.1016/j.jss.2012.10.054 |





