2. 广西民族大学 广西林产化学与工程重点实验室,南宁 530006
2. Guangxi Key Laboratory of Chemistry and Engineering of Forest Products, Nanning 530006
生物多糖(Polysaccharide)是由多个单糖分子缩合、失水而成,是一类分子结构复杂且数量庞大的糖类物质,广泛分布于动物、植物和微生物中[1]。其中,微生物的种类和数量庞大,是研究生物多糖的重要来源。微生物多糖可分为胞内多糖和胞外多糖[2],其中微生物胞外多糖因具有产量高、性质稳定且易与菌体分离等特点备受关注。微生物的胞外多糖主要包括黏附在其表面的荚膜多糖(Capsular polysaccharide,CPS)和合成分泌到环境介质中的胞外多糖(Extracellular polysaccharides,EPS)。海洋细菌因其特有的高盐浓度、高压、高温差、寡营养和高毒性浓度等特殊环境,具有产生结构新颖、功能独特的新型活性多糖的潜力[3]。如日本学者Umezawa[4]对167株海洋细菌所产EPS进行抗肿瘤活性的筛选发现,6%的菌株其EPS具有明显的抗肿瘤活性。
广西北部湾为半封闭大海湾,特殊的地理和气候环境使得该海域微生物资源丰富且复杂多样,具有产生新型活性多糖的潜力。王英等[5]发现,来源于红树林的真菌PH1008 EPS可刺激小鼠脾细胞增殖,并促进NK细胞杀伤能力。梁静娟等[6]从广西北部湾红树林泥样中筛选到一株短小芽孢杆菌Bacillus pumilus PLM4,该菌EPS对人喉癌细胞Hep22、肝癌细胞BEL27404和舌癌细胞TCA8123的生长都具有抑制作用。基于以上研究,广西北部湾海洋细菌所产胞外多糖具有多种生物活性,应用前景良好。为了进一步探究广西北部湾海洋细菌胞外多糖及其生物学活性,本研究对来源于北部湾相关样品通过LB-苯胺蓝固体培养基进行产胞外多糖细菌的筛选和分离以及PCR等方法的鉴定,通过MTT法初步研究其EPS的抗肿瘤活性,以期获得具有良好生物活性的细胞胞外多糖,为北部湾海洋细菌资源的开发和利用奠定基础。
1 材料与方法 1.1 材料 1.1.1 样品用于分离产EPS细菌的样品取自北海和钦州两地的近海水样(2 m深左右水样)和茅尾海红树林泥样(地面下50 cm深左右泥样),样品保存于4℃备用。
1.1.2 培养基LB-苯胺蓝固体培养基:酵母粉5.0 g,氯化钠5.0 g,蛋白胨10.0 g,琼脂18-20 g水溶苯胺蓝5.0 g,蒸馏水500 mL,人工海水500 mL,pH7.4-7.6。LB-培养基:酵母膏5.0 g,氯化钠5.0 g,蛋白胨10.0 g,琼脂18-20 g,蒸馏水500 mL,人工海水500 mL,pH7.4-7.6。摇瓶培养基:蔗糖4 g,酵母粉3 g,CaCO3 0.1 g,蒸馏水500 mL,人工海水500 mL,pH7.4-7.6。以上培养基均121℃,30 min灭菌处理。
1.1.3 主要试剂氯仿、正丁醇、葡萄糖、苯酚、浓硫酸等均为国产分析纯;DMEM培养液购自Gibco公司),RPMI-1640培养液为Thermo公司产品,碳酸氢钠和台酚蓝均为Sigma公司产品,青霉素、链霉素、噻唑蓝(MTT)均为Amresco公司产品。
1.1.4 引物参照Anna等[7]设计针对16S rDNA引物,引物序列如下:GM5F:5'-CCTACGGGAGGCA-GCAG-3',907R:5'-CCGTCAATTCCTTTGAGTTT-3',预期的目标片段长度为590 bp,引物由北京六合华大基因科技有限公司合成。
1.2 方法 1.2.1 细菌初筛、纯化及保存将采集的泥样或水样用无菌海水稀释成10-1、10-2、10-3、10-4、10-5、10-6六种不同稀释度,分别取100 μL均匀涂布于LB-苯胺蓝固体平板中,于30℃恒温箱中培养48 h。挑选出颜色较深、厚度较大、粘稠度较大的菌落,划线接种于LB固体培养基进行纯化。最后进行单一菌落斜面固体培养基培养,30 %无菌甘油进行菌种保存,并做标记。
1.2.2 菌种复筛菌种经LB斜面培养基复苏,30℃培养24 h。菌落转接种于25 mL LB液体培养液中,30℃,180 r/min摇床振荡培养9 h,得到细菌种子液。取种子液1.5 mL接种于48.5 mL摇瓶培养基中,27℃,180 r/min振荡培养36 h,得到发酵液。复筛采用摇瓶发酵产糖量分析法,即取发酵液10 mL于50 mL离心管中,加入等体积的2 mol/L NaOH,静置20 min后离心(12 000 r/min,30 min);取上清,用3 mol/L HCl调pH至接近6.0后3000 r/min离心30 min;目测EPS沉淀量,选出沉淀明显的菌株,用于后续EPS含量测定。
1.2.3 EPS含量测定方法采用苯酚-硫酸法[8]测定EPS含量,以葡萄糖为标准,按常规方法制作葡萄糖标准曲线。
1.2.4 细菌种属鉴定细菌种属鉴定采用16S rDNA序列分析法。细菌DNA的提取:取适量菌体加入50 μL Lysis for microorganism to Direct PCR溶液中混匀,后将EP管置于80℃水浴锅中热变性15 min后,8 000 r/min离心1 min,取4 μL上清液作为PCR反应的模板。
PCR反应体系:12.5 μL 2×Taq mix,6.5 μL无菌水,4 μL模板DNA,引物各2 μL,总体积25 μL。PCR程序:94℃预变性3 min,94℃变性1 min,50℃退火1.5 min,72℃延伸3 min,30个循环;72℃延伸6 min。
产物经1 %的琼脂糖凝胶电泳进行鉴定,阳性PCR产物经纯化送到北京华大基因公司深圳分公司进行测序。序列于NCBI数据库比对,采用MEGA5.0绘制遗传进化树。
1.2.5 EPS的粗提取苯酚-硫酸法获得的粗多糖,采用常规的Sevage法[9]去除杂蛋白,获得的纯化样品经双光束紫外光可见分光光度计对200-400 nm波段进行扫描,观察260 nm和280 nm处的蛋白吸收峰有无峰值来检测蛋白质是否去除干净。
1.2.6 多糖分子量的测定及红外光谱分析多糖样品分子量及纯度采用Waters高效凝胶色谱仪测定,色谱柱为Waters Μltrahydrogel Linear 7.8×300,并通过2414示差检测器进行测定。首先,用不同分子量的标准葡聚糖(含4.4 kD,9.9 kD,21.4 kD,43.5 kD,124 kD,196 kD,277 kD)制作标准曲线,其次根据样品的洗脱体积与标准曲线对照求出样品分子量,最后根据出峰情况判定样品纯度。同时将3.0 mg经sevage法纯化的胞外多糖样品与KBr一同压片进行红外扫描检测,初步分析多糖的结构和化学键。
1.2.7 EPS细胞毒性检验纯化的多糖溶液经0.22 μm过滤除菌,滤液经含10%胎牛血清的DMEM完全培养基分别配置成10、30、50、100、300和500 μg/mL 6种不同的浓度备用。
运用MTT能与活细胞产生蓝色结晶的原理来检测胞外多糖对Vero细胞的毒性[10]:将Vero细胞(浓度为1×106/mL)以50 μL/孔传至96孔细胞培养板,再分别加入BHc-09不同浓度的胞外多糖溶液50 μL/孔,并设置空白对照,每组均设5个复孔。培养板放置于37℃,5% CO2培养箱中培养48 h后,于每孔加入20 μL MTT(5 mg/mL),继续培养4 h后取出,于各孔加入150 μL二甲基亚砜,置摇床上低速震荡10 min,酶标仪测吸光度,检测波长为490 nm,参考波长为630 nm。
1.2.8 EPS对肿瘤细胞体外增殖的抑制作用常规复苏并培养HeLa细胞,待长满细胞瓶后用胰酶处理,改良RPMI-1640完全培养基调整细胞浓度至1×106/mL并以50 μL/孔传至96孔细胞培养板,再分别加入不同浓度的BHc-09胞外多糖溶液50 μL/孔,并设置空白对照,每组均设5个复孔。培养板放置于37℃,5% CO2培养箱中培养,并于24 h、48 h、64 h三个时间段观察细胞形态,64 h后取出于每孔加入20 μL MTT(5 mg/mL),继续培养4 h后取出,于各孔加入150 μL二甲基亚砜,置摇床上低速震荡10 min,酶标仪测吸光度,检测波长为570 nm,参考波长为630 nm。计算多糖对肿瘤细胞的抑制率(IR)[11]。IR=(1-实验孔吸光度/对照孔吸光度)×100%。
2 结果 2.1 产EPS细菌的筛选结果经过LB-苯胺兰培养基初筛最终获得167株产胞外多糖(EPS)的细菌。通过发酵培养基复筛,最终获得1株EPS产量较高的菌株,命名为BHc-09,其EPS产量达到0.306 mg/mL。
2.2 细菌种属鉴定以BHc-09菌体裂解物为模板,通过PCR扩增,获得590 bp的目的产物,与预期的目的片段大小相符。测序得到的BHc-09 16S rDNA序列于NCBI数据库中的应用程序blast,将所得的16S rDNA基因序列进行相似性比对,结果BHc-09与弧菌(Vibrio)相似性为99%,将BHc-09 16SrDNA序列与部分弧菌菌株及其它菌属的相应序列绘制遗传进化树(图 1),发现BHc-09与弧菌属亲缘关系最近,同属于一个分支中,因此,确定BHc-09为弧菌属。

|
| 图 1 BHc-09菌的遗传进化树 |
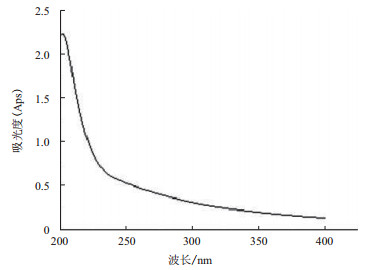
将经过Sevage法除蛋白后的EPS溶液进行紫外吸收检测,结果(图 2)显示,该EPS溶液在260 nm和280 nm处均无吸收峰,表明通过Sevage法已经除干净粗多糖中的杂蛋白。经高效凝胶滲透色谱检测,BHc-09弧菌所产EPS分子质量约为184.5 kD(图 3),BHc-09弧菌所产EPS溶液色谱图显示单峰,样品纯度较高。
|
| 图 2 粗纯化多糖的紫外扫描曲线 |

|
| 图 3 BHc-09细菌所产EPS的高效凝胶渗透色谱 |
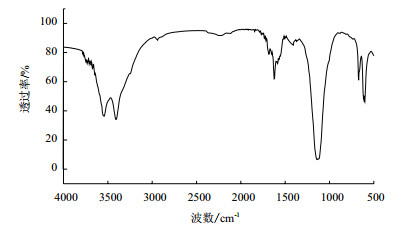
红外分析结果(图 4)表明,BHc-09 EPS具有多糖的特征吸收峰:3401-3405 cm-1处为糖类多羟基中O-H伸缩振动峰;2935-2942 cm-1出现弱吸收峰,为C-H伸缩振动峰;1623 cm-1为结晶水中O-H弯曲振动吸收峰或C=O伸缩振动峰;1407-1419 cm-1是C-H变角振动吸收峰;1126 cm-1为C-O变角振动峰。除此之外,多糖在1685 cm-1处有吸收峰,该峰为糖醛酸吸收峰,说明多糖中具有糖醛酸基团。此外,多糖未出现S=O及C-O-S的吸收峰,表明这种多糖结构内无硫酸根基团。
|
| 图 4 BHc-09细菌所产EPS的红外色谱图 |
BHc-09 EPS对细胞的毒性实验结果(表 1)表明,BHc-09 EPS在10-500 μg/mL的浓度范围内对Vero细胞没有直接毒性。通过MTT的作用,Vero细胞在多糖浓度升高的情况下,细胞A490nm值略微增高,但与对照组比,差异性不显著(P > 0.05)。此外,通过倒置显微镜的观察,实验组与对照组在细胞形态和生长趋势上没有差别。
BHc-09 EPS对HeLa细胞体外增殖的抑制作用结果,如表 2。当BHc-09 EPS浓度为100 μg/mL、300 μg/mL和500 μg/mL时,其抑制率分别为60.8 %、89.8 %和92.7 %,且与对照组的差异性非常显著(P < 0.01);浓度为50 μg/mL时,其抑制率为28.4 %,与对照组差异性显著(P < 0.05);浓度为10 μg/mL和30 μg/mL时,抑制率为18.3 %和19.3 %,且差异性不显著。此外,倒置显微镜的观察也发现,当多糖浓度达到100 μg/mL时,可以观察到肿瘤细胞细胞变圆,形态不饱满,细胞呈拉丝状,当浓度达到300 μg/mL,肿瘤细胞大部分开始漂浮、成团和死亡,极少一部分贴壁,浓度为500 μg/mL,细胞漂浮、成团和死亡更为严重,而低浓度下HeLa细胞形态及生长情况与对照组差别不大。分析表明,BHc-09胞外多糖对HeLa细胞的体外增殖具有抑制作用,且在高浓度区抑制作用明显。
海洋细菌EPS无毒副作用,具有生产周期短、成本低廉及显著的生物活性[12]等优点,因此,从海洋细菌中探索新的具有生物学活性的多糖和多糖复合物,已成为海洋药物开发的热点。广西北部湾地区地理和气候独特,微生物资源丰富且复杂多样,为研究海洋细菌胞外多糖奠定了基础。从广西北海近海海域和钦州茅尾海红树林采集的样品中共分离出167株具有产EPS的海洋细菌,从中筛选出一株EPS产量达到0.306 mg/mL的海洋弧菌BHc-09,其多糖产量与马波等[13]进行海洋细菌M4产EPS发酵条件优化后48 h的产糖量相当。因此,BHc-09属于产量较高的产EPS海洋弧菌,其EPS的分子量为184.5 kD,对Vero细胞无毒副作用,对肿瘤细胞系HeLa细胞有抑制生长作用。
有资料表明,大肠杆菌、根瘤菌、多粘芽孢杆菌等细菌多糖均具有抑制肿瘤细胞生长、诱导细胞凋亡及增强免疫功能[12]等作用。Marjut等[14]证实大肠杆菌荚膜多糖经O-硫酸化后可有效抑制癌细胞的转移。Zhao等[15]证实根瘤菌胞外多糖可抑制荷肉瘤180、肝癌22和艾氏腹水癌中肿瘤细胞的进一步增殖,促进单核细胞和淋巴细胞的增殖和吞噬能力,具有较强的抗肿瘤活性。本研究初步的结果表明,海洋弧菌BHc-09 EPS也具有抑制HeLa细胞系增殖的作用,显示了初步的抑制肿瘤细胞效果,该多糖是否能抑制其它肿瘤细胞系的增殖有待于进一步的研究。此外,目前针对产多糖弧菌的研究主要是在弧菌表面的荚膜多糖和其细胞壁成分脂多糖方面,与这些被证明具有良好的免疫活性的多糖相比,从弧菌菌内产生的并分泌到胞外的多糖的研究较少,且BHc-09的特殊来源,其抗肿瘤活性如何有待于进一步深入的研究。
微生物胞外多糖的生物活性与其自身的结构密切相关,这类多糖大多由多种单糖按一定比例组成杂多糖,其中以葡萄糖、半乳糖和甘露糖为主,另外还含有葡萄糖醛酸、半乳糖醛酸、氨基糖和丙酮酸等。研究通过红外光谱分析表明,BHc-09海洋弧菌胞外多糖产物具有多糖特征吸收峰,并含有糖醛酸。据研究报道,多糖的抗氧化性与其糖醛酸含量呈正相关[16],因此,BHc-09海洋弧菌EPS产物可能具有一定的抗氧化活性。此外,BHc-09海洋弧菌EPS产物的分子量高达184.5 kD,有研究[17]表明,分子量高于90 kD的多糖具有较强的免疫学活性,因此,BHc-09 EPS的其他活性有待于进一步研究。
4 结论本研究分离获得了一株高产EPS的海洋弧菌BHc-09,其分子量为184.5 kD,结构中含有糖醛酸成分,BHc-09胞外多糖具有抗肿瘤细胞系Hela细胞增殖的作用。
| [1] | 刘洁, 李文香, 王文亮, 等. 生物多糖研究进展. 山东农业科学, 2011(5): 98–101. |
| [2] | 魏培莲. 微生物胞外多糖研究进展. 浙江科技学院学报, 2002, 14(2). |
| [3] | 孙海红, 毛文君, 钱叶苗, 等. 海洋微生物活性胞外多糖的研究进展. 海洋科学, 2011(11): 134–138. |
| [4] | Umezawa H, Okami Y, Kurasawa S, et al. Marinactan, antitumor polysaccharide produced by marine bacteria. Journal of Antibiotics, 1983, 36 (5): 471–477. DOI:10.7164/antibiotics.36.471 |
| [5] | 王英, 贝宁, 王永霞, 等. 红树林真菌PH1008胞外多糖增强小鼠免疫功能的研究. 食品研究与开发, 2015(12): 16–18. |
| [6] | 梁静娟, 王松柏, 庞宗文, 等. 海洋细菌Bacillus pumilus PLM4产抗肿瘤多糖的发酵条件优化研究. 广西农业生物科学, 2006(03): 256–260. |
| [7] | Clarke A, Kirby R, Rose PD. Molecular microbial ecology of lignocellulose mobilisation as a carbon source in mine drainage wastewater treatment. Water Sa, 2007, 30 (6): 11–12. |
| [8] | Mishra A, Jha B. Microbial Exopolysaccharides[M]. Springer Berlin Heidelberg, 2013. |
| [9] | 郭丹钊, 黄为一. 一株葡糖杆菌胞外多糖的体外抗氧化活性及其组成研究. 南京农业大学学报, 2005(2): 50–54. |
| [10] | 赵嘉惠, 张华屏, 王春芳. MTT法在检测细胞增殖方面的探讨. 山西医科大学学报, 2007(3): 262–263. |
| [11] | 戴碧涛, 蒋纪恺, 等. 苦参碱联合抗肿瘤药抑制K562细胞增殖的研究. 第三军医大学学报, 2005(5): 392–394. |
| [12] | 林俊, 李萍, 陈靠山. 近5年多糖抗肿瘤活性研究进展. 中国中药杂志, 2013(8): 1116–1125. |
| [13] | 马波, 陈桂光, 李玮, 等. 产胞外多糖海洋细菌M4的发酵动力学研究. 现代食品科技, 2006(3): 32–34. |
| [14] | Marjut B, Anni W, Katri H, et al. O-Sulfated bacterial polysaccharides with low anticoagulant activity inhibit metastasis. Semin Thromb Hemost, 2007, 33 (5): 547. DOI:10.1055/s-2007-982087 |
| [15] | Zhao L, Chen Y, Ren S, et al. Studies on the chemical structure and antitumor activity of an exopolysaccharide from Rhizobium sp.N613. Carbohydrate Research, 2010, 345 (5): 637–643. DOI:10.1016/j.carres.2009.11.017 |
| [16] | 申明月, 聂少平, 等. 茶叶多糖的糖醛酸含量测定及抗氧化活性研究. 天然产物研究与开发, 2007, 19(5): 830–833. |
| [17] | Ohno N, Miura T, Miura NN, et al. Structure and biological activities of hypochlorite oxidized zymosan. Carbohydrate Polymers, 2001, 44 (4): 339–349. DOI:10.1016/S0144-8617(00)00250-2 |





