2. 西安市疾病预防控制中心,西安 710043;
3. 西安工程大学环境与化学工程学院,西安 710048
2. Xi'an Center for Disease Control and Prevention, Xi'an 710043;
3. College of Environmental & Chemistry Engineering, Xi'an Polytechnic University, Xi'an 710048
土壤重金属污染是当前全球重要的环境问题之一,污染土壤中的重金属不仅严重破坏生态环境平衡,还会通过生物链进入人体,直接危及人类健康[1, 2]。锌(Zn)主要通过矿产开采和冶炼加工进入土壤环境和水环境,机械制造以及镀锌生产、仪器仪表、有机合成和造纸等工业排放也会造成锌污染[3]。研究表明,人体锌含量过高会引起中毒、抑制体格及胸腺发育,摄入过量的锌更会引起胃肠炎、贫血、胰腺损伤,降低人体的免疫功能,导致体内多元系统功能紊乱甚至死亡[4-6]。
当前,锌污染土壤的修复方法大致可分为物理、化学以及生物修复三大类。其中,物理修复和化学修复由于工程量大、运行费用高、操作复杂,且易引起土壤肥力减弱、造成二次污染等,越来越不适宜采用[7]。而利用生物修复技术治理土壤污染有着成本低廉、环境效果佳、扰动小的特点,逐渐成为新的研究热点[8]。近年来,利用环境友好型微生物处理土壤中的重金属发展迅速[9, 10],抗性细菌能够通过特异性生物吸附、富集活化等多种方式降解重金属,尤其适用于治理土壤低浓度或大面积重金属污染。因此,有针对性的筛选抗锌菌株,研究探索其抗锌机制,对于农田土壤环境中锌污染的治理具有深远意义[11-13]。本研究从采自商洛铅锌矿污染的土壤中筛选出对重金属Zn等具有较强抗性的菌株,研究其菌株形态、生理生化特性及抗重金属特性,旨在寻找更加高效经济的微生物修复材料,为重金属污染土壤的可持续治理提供理论基础。
1 材料与方法 1.1 材料 1.1.1 材料与试剂土壤样品采集自陕西省商洛市商州区黑龙口镇铅锌矿区周边农田,取15 cm处土样20 g,装入无菌样品袋内,于4℃保存备用。
培养基:NaCl 10.0 g,蛋白胨10.0 g,酵母浸粉5.0 g,去离子水1 000 mL,pH7.2-7.4,121℃、30 min湿热灭菌;若制备固体培养基需加入20 g/L琼脂。
重金属溶液:用去离子水将ZnSO4·7H2O配制成0.4 mol/L的母液,将Pb(NO3)2、CuSO4·5H2O、K2CrO4、CdCl2分别配制成0.1 mol/L的母液,121℃、30 min灭菌。所用试剂均为分析纯。
1.1.2 主要仪器隔水式培养箱GH500(北京科伟永兴仪器有限公司),立式压力蒸汽灭菌锅LDZX-50KBS(上海申安医疗器械厂),摇瓶培养箱TS-2102(上海天呈实验仪器制造有限公司),高速冷冻离心机GL-20G-H(上海安亭科学仪器厂),原子吸收光谱仪(Thermo Fisher iCE3000),722型紫外可见分光光度计(上海菁华科技仪器有限公司),基因扩增仪(TProfessional Standard Gradient 96),Biolog自动微生物鉴定系统(Gen III Microstation)。
1.2 方法 1.2.1 抗锌微生物的分离筛选抗锌微生物的筛选采用金属离子梯度压力驯化法。取5 g土样加入100 mL终浓度为2 mmol/L Zn2+的液体培养基中,30℃、150 r/min摇床培养3 d后,取5 mL培养液转接至新鲜含Zn2+的液体培养基中培养,Zn2+浓度梯度依次为4、8、16和20 mmol/L。在固体培养基平板(Zn2+浓度为20 mmol/L)上反复划线纯化,直至分离得到抗性较高的单菌落ZS2,并观察菌落生长状况。
1.2.2 菌株ZS2的鉴定 1.2.2.1 形态学与Biolog微生物鉴定系统鉴定将筛选到的菌株划线接种于固体培养基平板上,30℃培养72 h,观察菌落形态。
采用Biolog微生物鉴定系统进行初步鉴定时,先参照《伯杰氏细菌鉴定手册(第九版)》[14]与《常见细菌系统鉴定手册》[15]对获得的菌株进行革兰氏染色、氧化酶实验及接触酶实验,确定菌株类型。再通过Biolog分析细菌对糖、醇、酸等71种碳源(以水作空白对照)的利用情况和对23种化学敏感物质的反应,从而对菌株进行鉴定[16, 17]。
1.2.2.2 系统发育学分析提取菌株DNA,并作为模板进行16S rRNA的PCR扩增。16S rRNA基因PCR扩增引物为:27F(5'-AGAGTTTGATCCTGGCTCA-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')。扩增条件为:94℃预变性5 min;94℃变性1 min,55℃退火45 s,72℃延伸2 min,30个循环;72℃延伸10 min。
纯化基因扩增产物,委托上海生工生物有限公司进行测序,通过Blast比对分析所得序列与GenBank数据库中已有的细菌16S rRNA序列的相似性,运用ClustalX和MEGA 5.1软件构建系统发育树。
1.2.3 菌株ZS2在不同Zn2+浓度的生长实验配制Zn2+浓度分别为0、4、8、16和32 mmol/L的100 mL液体培养基,每瓶加入1 mL新鲜菌株种子液,30℃、150 r/min摇床培养。每隔5 h测定在菌株0-30 h内发酵液OD600值,用以确定菌株ZS2在不同Zn2+浓度下的生长曲线,每组处理设置3个重复。
1.2.4 菌株ZS2对其他重金属耐受性实验参照不同重金属对微生物的毒性浓度[18],将新鲜菌株种子液接种于单一及复合重金属(Zn2+2 mmol/L、Pb2+2 mmol/L、Cu2+1.5 mmol/L、Cr6+2 mmol/L、Cd2+1.5 mmol/L)的液体培养基中,显微镜下观察其生长状况。
1.2.5 菌株ZS2对Zn2+的吸附特性将活化24 h的菌株ZS2种子液按1%的浓度接种入Zn2+浓度为2、4、10 mmol/L的液体培养基,对照组不接种。30℃、150 r/min摇床培养,于6 h、12-72 h(间隔12 h),10 000 r/min离心5 min条件下去除菌体并收集上清液,利用原子吸收仪测定其中的Zn2+含量。每份样品设3个重复。Zn2+吸附率(P)按照下列公式进行计算:P=(C0-C)/ C0×100%。式中,C0为原培养液中Zn2+浓度(mmol/L),C为菌体生长后培养液中Zn2+浓度。
2 结果 2.1 菌株的鉴定 2.1.1 菌株的形态学观察通过光学显微镜观察发现,ZS2菌体大小约为(0.3-1.0)μm×(2.0-2.5)μm,杆状。在固体培养基上,菌落呈圆形,乳白略带淡黄色,凸起,表面湿润,边缘光滑,不透明,极易挑起。
|
| 图 1 菌体ZS2光学显微镜照片 |
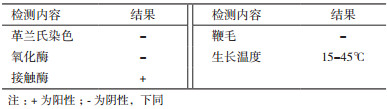
菌株ZS2常规生理生化特征分析结果(表 1)表明,菌株ZS2为革兰氏阴性细菌,有鞭毛,生长温度为15-45℃,氧化酶反应阴性、接触酶反应阳性;可以有效地利用19种碳源,对利福霉素SV、万古霉素、盐酸胍、氯化锂等不敏感,可在1% NaCl、1%乳酸钠、pH6等条件下生长。根据其对不同底物的利用能力,Biolog鉴定结果(表 2)表明,菌株ZS2与不解糖假苍白杆菌(Pseudochrobactrum asaccharolyticum)的相似性Similarity(SIM)为0.637。
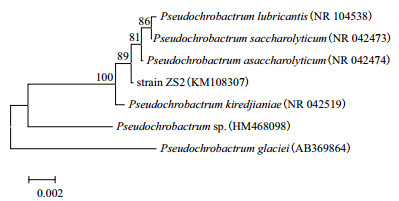
将菌株ZS2的16S rRNA序列(扩增长度为1 371 bp),通过GenBank进行序列分析和同源性比对。结果表明,菌株ZS2序列与Pseudochrobactrum asaccharolyticum的16S rRNA序列同源性为99%。序列已提交NCBI的GenBank数据库,登录号为KM108307(图 2)。
|
| 图 2 菌株ZS2的16S rRNA序列的系统发育树 |
图 3所示为菌株ZS2在Zn2+浓度梯度为0、4、8、16和32 mmol/L下的生长曲线。随着Zn2+浓度逐渐增大,菌株生长逐渐受到抑制,但是均能完成正常的新陈代谢过程。但当Zn2+增大至32 mmol/L时,ZS2不能正常生长。
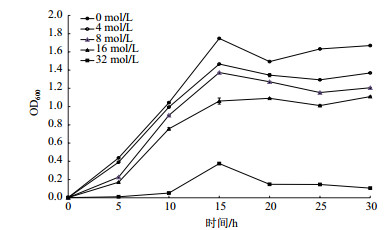
|
| 图 3 不同Zn2+浓度下菌株ZS2生长曲线 |
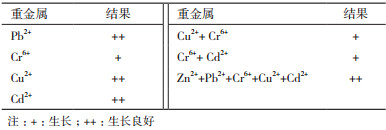
通过研究菌株ZS2对单一及复合重金属(Zn2+2 mmol、Pb2+2 mmol/L、Cu2+1.5 mmol/L、Cr6+2 mmol/L、Cd2+1.5 mmol/L)的抗性,结果(表 3)表明菌株ZS2除能抗锌以外,还能在单一重金属及复合重金属培养基中生长,其中在含Pb2+、Cu2+、Cd2+及5种金属离子的混合溶液中生长良好。
菌株ZS2对Zn2+的去除性能如图 4可知,Zn2+浓度为2.0、4.0和10.0 mmol/L时,菌株ZS2对Zn2+的吸附率随时间增加逐渐提高。6-24 h内,菌株处于对数生长期,菌株快速繁殖且活力强,吸附率提高较快;24 h后菌株进入稳定期,吸附率增长较慢。3 d后,2.0、4.0和10.0 mmol/L浓度条件下,菌株对Zn2+的吸附率分别为55.25%、40.75%和33.11%。

|
| 图 4 菌株ZS2对Zn2+的吸附率 |
土壤微生物是表征土壤生态系统结构和维持生态系统稳定性的重要构成[19],不仅可以代谢土壤中的动植物残体,还调节土壤有机质和其他有害化合物的分解、生物化学循环和土壤结构形成[20]。土壤中的抗性菌株可以有效的结合重金属离子,改变重金属与土壤的结合形态,有针对性的进行土壤修复[21, 22]。随着采矿业及制造业的发展,土壤重金属污染逐渐向多元化发展[19, 23],利用环境友好型微生物、微生物-植物共存系统相互促进作用对污染土壤进行生物修复逐渐成为环境科学领域研究热点。近年来,国内外研究耐重金属微生物取得一定进展,不仅研究发现了多种具有不同重金属抗性的菌株[24-27],还探索了运用微生物治理重金属污染的不同机理和途径,如利用耐性微生物进行生物吸附、通过微生物基因构建转基因植物、利用植物根系-微生物协同治理等[28]。
微生物吸附法作为一种新兴的处理技术,能够利用微生物本身的化学成分及结构特性吸附重金属离子,在治理重金属锌污染方面应用广泛[29]。王慧萍等[30]分离自铜矿污染土的鞘氨醇单胞菌属DX-T3-03,对锌具有抗性,耐Zn2+浓度为25 mmol/L;樊霆等[31]从锌尾砂坝土壤中分离到一株黄曲霉(Aspergillus flavus),可富集水源中的Zn2+;李进等[32]从铅锌矿区分离到一株虫生轮枝菌,其生长菌株对Zn2+的去除率为87.7%。
假苍白杆菌属由Peter等[33]于2007年自海洋中发现以来,从环境中分离出假苍白杆菌属抗性细菌鲜有报道。龙冬艳等[34]从铬污染土壤中获得Cr(VI)还原菌株Pseudochrobactrum sp. LY10,应用于Cr污染治理中。Mergeay等[35]学者分类指出,抗锌细菌为耐锌浓度超过10 mmol/L的细菌;本研究从应用角度出发,首次筛选获得假苍白杆菌属高抗锌细菌ZS2,为复合重金属污染土壤的Zn2+生物修复研究提供了重要研究材料;然而菌株ZS2在土壤生态系统中是否为优势种及其抗性机理、效力还有待进一步研究阐明。
4 结论本研究采用浓度梯度筛选法分离获得一株高抗锌细菌,鉴定为不解糖假苍白杆菌Pseudochrobactrum asaccharolyticum ZS2。该菌株不仅能在高浓度Zn2+条件下稳定生长,还具有重金属多重抗性,可在含Pb2+、Cu2+、Cr6+、Cd2+的单一或混合培养基中生长,表明该菌株可应用于重金属复合污染土壤的生物修复。此外,该菌株对低浓度Zn2+吸附速度快、吸附率高,对大面积中低浓度Zn2+污染土壤的修复富有潜力。
| [1] | 郭世鸿, 侯晓龙, 邱海源, 等. 基于形态学分析铅锌矿不同功能区土壤重金属元素的分布特征及污染评价. 地质通报, 2015, 34(11): 2047–2053. |
| [2] | 陈怀满. 土壤中化学物质的行为与环境质量[M]. 北京: 北京大学出版社, 2002. |
| [3] | Klimek B. Effect of long-term zinc pollution on soil microbial community resistance to repeated contamination. Bull Envrion Contam Toxicol, 2012, 88 (4): 617–622. DOI:10.1007/s00128-012-0523-0 |
| [4] | Yang X, Lv YJ, Huang KL, et al. Zinc inhibits aflatoxin B1-induced cytotoxiciity and genotoxicity in human hepatocytes (HepG2 cells). Food and Chemical Toxicology, 2016, 92 : 17–25. DOI:10.1016/j.fct.2016.03.012 |
| [5] | 陈朋利, 何作顺. 铅与锌作用的研究. 微量元素与健康研究, 2012, 29(1): 67–69. |
| [6] | 皮江, 叶红艳, 杨启荣, 等. 锌对免疫、生殖与神经系统的影响. 科技创新导报, 2010, 16: 252–253. |
| [7] | 陈玉真, 王峰, 王果, 等. 土壤锌污染及其修复技术研究进展. 福建农业学报, 2012, 27(8): 901–908. |
| [8] | 杨卓, 李术娜, 李博文, 等. 接种微生物对土壤中Cd、Pb、Zn生物有效性的影响. 土壤学报, 2009, 46(4): 670–675. |
| [9] | Carlos G, Itzia A. Phytoextraction :a cost-effective plant based technology for the removal of metals from the environment. Bioresource Technology, 2001, 77 (3): 229–236. DOI:10.1016/S0960-8524(00)00108-5 |
| [10] | Gavrilescu M. Removal of heavy metals from the environment by biosorption. Engineering in Life Sciences, 2004, 3 : 219–232. |
| [11] | 吴方猛, 何怀东, 颜君岚, 等. 细菌菌株MS1的铅锌抗性和吸附性能研究. 华南师范大学学报, 2012, 44(3): 116–119. |
| [12] | 金忠民, 沙伟, 刘丽杰, 等. 铅镉抗性菌株JB11强化植物对污染土壤中铅镉的吸收. 生态学报, 2014, 34(11): 2900–2906. |
| [13] | 金忠民, 郝宇, 刘丽杰, 等. 一株铅镉抗性菌株的分离鉴定及其生物学特征. 环境工程学报, 2015, 9(7): 3551–3557. |
| [14] | RE布坎南, NE吉本斯. 伯杰细菌鉴定手册[M]. 第8版. 北京: 科学出版社, 1984. |
| [15] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [16] | 朱海针, 龙凯, 梁永红. Biolog技术监测淡豆豉发酵炮制过程中微生物种类动态变化. 中国实验方剂学杂志, 2015, 21(17): 14–17. |
| [17] | Athanasia G, Tekerlekopoulou, Maria T, et al. Modelling of bioogical Cr removal in draw-fill reactor using microorganisms in suspended and attacted growth system. Water Research, 2013, 47 (2): 623–636. DOI:10.1016/j.watres.2012.10.034 |
| [18] | 张汉波, 郑月, 曾凡, 等. 几株细菌的重金属抗性水平和吸附量. 微生物学通报, 2005, 32(3): 24–29. |
| [19] | 滕应, 黄昌勇. 重金属污染土壤的微生物生态效应及修复研究进展. 土壤与环境, 2002, 11(1): 85–89. |
| [20] | 赵李宁. 污染土壤生态修复技术研究. 资源节约与环保, 2015, 4: 149–150. |
| [21] | Van KN, Lee JU. Catalytic effect of activated charcoal on microbial extraction of arsenic and heavy metals from mine tailings. Geosciences Journal, 2014, 18 (3): 355–363. DOI:10.1007/s12303-013-0067-2 |
| [22] | Francis AJ, Dodge CJ. Anaerobic microbial dissolution of transition and heavy metal oxides. Applied and Environmental Microbiology, 1988, 54 (4): 1009–1014. |
| [23] | 王秀丽, 徐建民, 姚槐应, 等. 重金属铜、锌、铅复合污染对土壤环境微生物群落的影响. 环境科学学报, 2003, 3(1): 22–27. |
| [24] | 金羽, 曲娟娟, 李影, 等. 一株耐铅细菌的分离鉴定及其吸附特性研究. 环境科学学报, 2013, 33(8): 2248–2255. |
| [25] | 郭照辉, 单世平, 张德元, 等. 1株高耐镉菌株的分离与鉴定及16S rDNA序列分析. 湖南农业大学学报:自然科学版, 2014, 40(2): 207–210. |
| [26] | 廖佳, 冯冲凌, 李科林, 等.耐性真菌HA吸附铅、锌的影响因素及吸附机理研究, 2015, 42(2):254-263. http://www.cnki.com.cn/Article/CJFDTotal-WSWT201502005.htm |
| [27] | 王海鸥, 钟广蓉, 王立曼, 等. 一株耐铜细菌的鉴定及富集特性的研究. 环境工程学报, 2011, 5(10): 2380–2384. |
| [28] | 李樊, 刘义, 孙伟峰, 等. 利用微生物治理重金属污染的几种途径. 生物技术通报, 2010, 9: 48–51. |
| [29] | 王建龙, 韩英健, 钱易. 微生物吸附金属离子的研究进展. 微生物学通报, 2000, 27(6): 449–452. |
| [30] | 王慧萍, 谢学辉, 柳建设. 抗锌细菌Sphingomonas sp.DX-T3-03分离、鉴定及性质. 微生物学通报, 2010, 37(10): 1495–1500. |
| [31] | 樊霆, 张颖慧, 李定心, 等. 一株耐锌真菌CTB430-1分离鉴定及其富集特性. 激光生物学报, 2013, 22(5): 453–458. |
| [32] | 李进, 冯冲凌, 李科林, 等. 抗铅锌功能菌生长菌株和干菌体吸附Pb2+、Zn2+性能优化及机理分析. 微生物学通报, 2015, 42(7): 1224–1233. |
| [33] | Peter K, Holger S, Birgit H, et al. Description of Pseudochrobactrum kiredjianiase sp.nov. International Journal of Systematic and Evolutionary Microbiology, 2007, 57 (4): 755–760. DOI:10.1099/ijs.0.64714-0 |
| [34] | Long D, Tang X, Cai K, et al. Cr (VI) reduction by a potent novel alkaliphilichalotolerant strain Pseudochrobactrum saccharolyticum LY10. J Hazard Matre, 2013, 256-257 : 24–32. DOI:10.1016/j.jhazmat.2013.04.020 |
| [35] | Mergeay M, Nies D, Schlegel HG, et al. Alcaligenes eutrophus CH34 is a facultative chemolithotroph with plasmid-bound resistance to heavy metals. J Bacteriol, 1985, 162 (1): 328–362. |