2. 中国科学院天津工业生物技术研究所 系统微生物工程重点实验室 天津 300308
2. Key Laboratory of Systems Microbial Biotechnology, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308
透明质酸(Hyaluronic acid,HA)是一种高分子量酸性黏多糖,广泛应用于医疗、化妆品及食品行业[1, 2]。工业生产广泛采用兽疫链球菌(Streptoc-occus equi subsp. zooepidemicus)发酵产透明质酸[3]。近年来,多株兽疫链球菌的全基因组测序完成并公布[4, 5],为揭示兽疫链球菌的基因功能进而优化HA的发酵生产奠定基础。遗传操作系统是揭示基因功能的有效工具,目前可用于兽疫链球菌的高效诱导表达系统未见报道。因此,构建可在兽疫链球菌中高效诱导基因表达的遗传操作系统对其基因功能研究及从分子生物学角度优化兽疫链球菌HA发酵生产具有重要意义。
兽疫链球菌是一种革兰阳性菌,部分革兰阳性菌中已有较为成熟的基因诱导表达系统,如用于产气荚膜梭菌的乳糖调控基因表达系统[6],用于枯草芽孢杆菌的木糖诱导表达系统[7],及用于乳酸菌的乳酸链菌素(nisin)调控的基因表达系统[8]等。然而,这些诱导系统能否用于兽疫链球菌,兽疫链球菌本身是否存在相似功能的元件可用于构建诱导表达系统,目前还不清楚。
关于兽疫链球菌蔗糖操纵子的研究较为清楚[9],主要由scrR基因、scrB基因和scrA基因组成。scrR编码GalR-LacI家族的蔗糖操纵子抑制子;scrB编码蔗糖-6-磷酸水解酶,该酶可将胞内蔗糖-6-磷酸水解成果糖和葡萄糖-6-磷酸;scrA编码蔗糖特异性磷酸转运系统(PTS)的ⅡABC组分复合物EnzⅡScr可将蔗糖转变为蔗糖-6-磷酸。研究发现蔗糖可诱导兽疫链球菌突变菌株scrA基因的表达,该诱导受scrR基因产物调控[10],因此可尝试利用此功能构建蔗糖调控诱导表达系统。
对于工业生产菌株,基因功能研究的最终目的是通过发酵提高目标产品的产量。HA发酵一般采用兽疫链球菌分批发酵[11-13],HA积累导致发酵液黏度迅速上升,限制基质中物质、能量传递,菌体生长受到较大程度抑制,生产效率低下;部分研究者采用连续发酵虽能缩短发酵时间,节省生产成本,但也受到产品不稳定等因素限制[14];因此,建立一种HA高效发酵模式迫在眉睫。有研究曾报道一种基于分批和分批补料的两步发酵策略,用于协调菌体生长和HA合成的竞争关系[15]。如今两步发酵模式受到越来越多的关注,因而探究一种基于基因可控表达的两步发酵策略具有重大意义。
本研究基于蔗糖可诱导scrA基因高水平转录的原理,以透明质酸合成酶编码基因hasA作为报告基因,构建和比较蔗糖、乳糖、木糖和乳酸链球菌素(nisin)诱导表达系统,并依据葡萄糖效应对蔗糖代谢产生影响的特性,建立一种以蔗糖为诱导物的可控的HA发酵模式,以期解除HA积累对发酵液传质的影响,并协调菌体生长和HA合成的竞争关系。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒实验所用菌株、质粒如表 1所示,大肠杆菌和枯草芽孢杆菌在Luria-Bertani(LB)培养基中37℃条件下培养,兽疫链球菌在THY培养基中37℃条件下培养[16],乳酸菌在M17培养基中37℃条件下培养。大肠杆菌与兽疫链球菌的壮观霉素使用浓度分别为50 mg/L和100 mg/L。
限制性内切酶、Taq酶,反转录试剂盒均购自TaKaRa公司;UltraSYBR Mixture购自北京康为生物科技有限公司;T4 DNA连接酶购自全式金公司;PCR纯化试剂盒、琼脂糖凝胶回收试剂盒、质粒小提试剂盒,均购自北京天根生化公司;壮观霉素、发酵培养基成分及化学试剂均购自上海生工生物工程有限公司。
1.1.3 THB-G培养基(g/L)牛肉浸粉10.0,胰蛋白胨20.0,NaHCO3 2.0,NaCl 2.0,Na2HPO4 0.4。
1.1.4 发酵培养基(g/L)MgSO4·7H2O 0.4,酵母浸出物3.5,K2HPO4 2.0,酪蛋白胨10.0,NaCl 1.5。
1.2 方法 1.2.1 质粒构建本实验所用引物如表 2所示。基于重叠延伸PCR技术[17](gene splicing by overlap ex-tension PCR,简称SOE PCR)构建pLH201载体。以兽疫链球菌ATCC39920基因组DNA为模板,scrR-F/scrR-R和Pscr-F/Pscr-R为引物,分别扩增scrR基因(1 237 bp)及PscrA(365 bp),两个片段通过重叠PCR方法连接形成1 582 bp的片段,经限制性内切酶酶切回收后,连接到pLH200质粒的Sph I/SalI酶切位点。采用相同方法构建乳糖、木糖、nisin诱导表达质粒,其模板分别为兽疫链球菌ATCC39920的基因组DNA,枯草芽孢杆菌168的基因组DNA,乳酸乳球菌CV56的基因组DNA;所用引物分别为lacR-PlacA-F/lacR-PlacA-R、xylR-PxylA-F/xylR-PxylA-R、NisK-NisR-F/NisK-NisR-R、PnisA-F/PnisA-R;最终获得质粒pLH202、pLH203和pLH204。
RNA提取参照Mangan等[18]建立的方法。RNA反转录按照TaKaRa公司反转录试剂盒说明步骤进行。选取编码甘油醛-3-磷酸脱氢酶(GAPDH)的基因作对照。荧光定量PCR实验参照北京康为生物科技有限公司UltraSYBR Mixture产品说明书规定条件实施。
1.2.3 转化与诱导表达系统分析兽疫链球菌感受态细胞的制备及电转化采用实验室常用的标准程序[17]。带有hasA基因的诱导表达质粒通过电转化方式转入ΔhasA菌株,经THY液体培养后,划线于THY-G平板(添加适宜浓度的诱导物),37℃培养24 h后观察其表型。
1.2.4 两步法发酵5 L发酵罐,装液量3 L,接种量8%(W/V),转速200 r/min,温度37℃,通气量1.5 vvm,pH用6 mol/L NaOH自动控制在7.0。第一阶段(0-12 h)向发酵培养基中添加初始浓度为30 g/L的葡萄糖,第二阶段(12-24 h)葡萄糖消耗殆尽,添加初始浓度为20 g/L的蔗糖。
1.2.5 分析方法葡萄糖、乳酸残留量采用生物分析传感仪测定。蔗糖残留量利用间苯二酚化学检测法测定[19]。生物量通过紫外分光光度法检测每2 h的OD值确定。
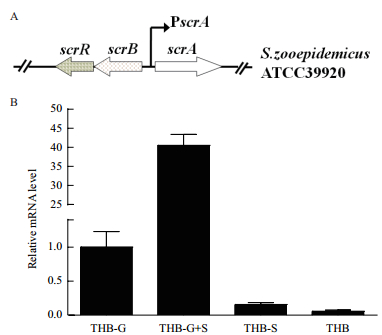
2 结果 2.1 兽疫链球菌ATCC39920蔗糖操纵子结构及不同碳源对其转录调节分析兽疫链球菌ATCC39920蔗糖操纵子结构如图 1-A所示,由蔗糖操纵子抑制子基因(scrR)、蔗糖-6-磷酸水解酶基因(scrB)及蔗糖PTS转运系统ⅡABC编码基因(scrA)组成,scrR和scrA基因具有相反的转录方向。接种ATCC39920菌株于不同THB-G液体培养基中培养,分别为未添加糖类(THB-G)、仅添加蔗糖(THB-G+S)、添加葡萄糖和蔗糖(THB+S)、仅添加葡萄糖(THB),荧光定量PCR分析发现scrA基因在未添加糖源时转录,添加蔗糖时高水平转录,添加葡萄糖和同时添加两种糖时scrA基因转录水平极低(图 1-B),表明葡萄糖阻遏蔗糖操纵子中scrA基因的转录,蔗糖促进该基因转录。
|
| 图 1 兽疫链球菌中蔗糖操纵子结构与转录水平分析 A:蔗糖操纵子示意图;B:兽疫链球菌ATCC39920中scrA基因在不同糖源条件下转录水平分析。THB-G:未添加糖源;THB-G+S:添加蔗糖(10 g/L);THB+S:同时添加葡萄糖和蔗糖(各10 g/L);THB:添加葡萄糖(10 g/L) |
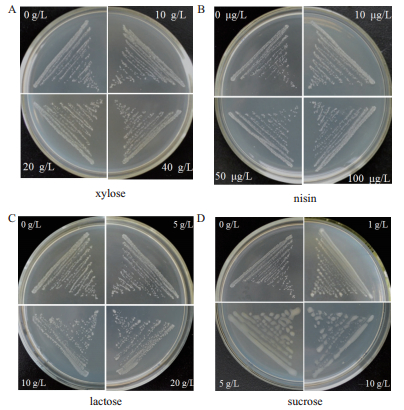
突变株(ΔhasA/pLH203、ΔhasA/pLH204,ΔhasA/pLH202、ΔhasA/pLH201)分别划线于添加不同浓度木糖、nisin、乳糖及蔗糖的THB-G固体平板上,37℃恒温静置24 h,观察菌落形态,如表 3和图 2所示。综上研究表明蔗糖诱导表达系统在兽疫链球菌ATCC39920胞内可高效诱导基因表达。
|
| 图 2 四种诱导表达系统经不同浓度诱导物诱导效果 A:ΔhasA/pLH203菌株经木糖诱导后表型观察;B:ΔhasA/pLH204菌株经nisin诱导后表型观察;C:ΔhasA/pLH202菌株经乳糖诱导后表型观察;D:ΔhasA/pLH201菌株经蔗糖诱导后表型观察 |
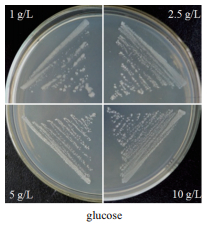
ΔhasA/pLH201突变株分别划线于添加浓度为1、2.5、5和10 g/L葡萄糖的THB-G(均含有10 g/L蔗糖)固体平板上,37℃恒温静置24 h,观察菌落形态。如图 3所示,添加1、2.5、5和10 g/L的葡萄糖于含有10 g/L蔗糖的培养基中,均可抑制蔗糖诱导表达系统的诱导效果。
|
| 图 3 ΔhasA/pLH201菌株经葡萄糖抑制后表型观察(蔗糖10 g/L) |
培养基中葡萄糖浓度高于2.5 g/L,蔗糖不能诱导菌株表达产生HA,故蔗糖诱导表达系统受葡萄糖效应的影响。应用此效应可建立一种基因可控表达模式,即用蔗糖诱导系统诱导目的基因表达,在特定阶段添加浓度高于2.5 g/L的葡萄糖沉默目的基因表达,从而达到揭示基因功能或调整代谢流的目的。
2.4 基于蔗糖诱导表达系统的透明质酸两步发酵策略初探ΔhasA/pLH201突变株具有蔗糖诱导、葡萄糖抑制hasA表达的特性,且HA对蔗糖的得率系数高于葡萄糖,因此尝试两步法分批培养ΔhasA/pLH201突变株的发酵模式。如图 4-A所示,0-12 h(仅添加葡萄糖)ΔhasA与ΔhasA/pLH201菌株生长趋势基本一致,ΔhasA/pLH201突变株生物量达2.4 g/L;12-24 h(添加蔗糖),两株菌均有二次生长情况,ΔhasA/pLH201突变株生物量为2.7 g/L,ΔhasA生物量达到2.9 g/L。

|
| 图 4 ΔhasA与ΔhasA/pLH201发酵过程中的生物量、HA产量、残糖量以及乳酸产量变化 A:ΔhasA与ΔhasA/pLH201突变株生长曲线;B:ΔhasA与ΔhasA/pLH201突变菌株透明质酸含量;C:ΔhasA与ΔhasA/pLH201突变菌株乳酸含量;D:ΔhasA与ΔhasA/pLH201突变菌株残糖含量。○:hasA基因功能缺失菌株;∆:ΔhasA包含蔗糖诱导hasA基因表达质粒 |
检测整个发酵过程中HA产量变化,结果(图 4-B)显示,ΔhasA菌株几乎不产HA;ΔhasA/pLH201突变株前12 h(以葡萄糖为唯一糖源)不产HA,添加蔗糖后HA产量迅速提高,且20 h后趋于稳定,终浓度达到3.4 g/L,表明基于蔗糖诱导表达系统的HA两步发酵策略高效可用。
发酵过程中乳酸产量变化如图 4-C所示,菌体生长前期两株菌乳酸产量基本一致,进入稳定期后呈现出明显差别,ΔhasA/pLH201突变株乳酸终产量达36.1 g/L,与ΔhasA相比降低7.3%,表明乳酸产量与HA产量呈现负相关,乳酸过度积累抑制HA产生。
糖源消耗是一个重要指标(图 4-D),ΔhasA/pLH201与ΔhasA菌株糖源消耗趋势基本相同。进入对数期后,葡萄糖含量均急剧下降且12 h时葡萄糖均已基本耗尽;添加蔗糖均约有2 h糖源利用延滞,14 h后蔗糖含量迅速下降,24 h蔗糖均已基本耗尽,糖源消耗与物质积累保持一致。
3 讨论近年来HA的开发应用范围越来越广,针对兽疫链球菌基因功能及发酵模式的研究逐渐成为热点。由于传统发酵方式产HA具有人力、物力、财力消耗较大,溶氧受到较大程度限制[11],高耗能[20],产品不稳定[14]且生产效率低(菌体生长受抑制、副产物乳酸产量过高)[19]等缺点,仅仅通过发酵条件优化等方式提高HA产量收效甚微,因而越来越多研究者转向分子生物学研究,试图通过对兽疫链球菌实施分子改造以提高HA产量。然而单一分子改造也未能产生预期效果,因此期望以分子改造为手段获得发酵模式的改变,进而提高HA产量。
在革兰阳性菌中,Hartman等[6]成功构建了可用于产气荚膜梭菌的乳糖调控基因表达系统,Nariya等[7]构建用于枯草芽孢杆菌的木糖诱导表达系统,Mierau等[8]构建用于乳酸菌的乳酸链菌素(nisin)调控的基因表达系统,但是关于这些系统能否用于兽疫链球菌的研究未见报道。本研究成功构建乳糖、木糖及nisin调控的诱导表达系统,系统可行性分析表明乳糖诱导系统调控基因表达效率低,木糖、nisin诱导系统不工作。木糖不发挥作用,可能由于木糖自身缺乏木糖磷酸化PTS转运系统且不能通过其它途径(如ABC转运系统)进入细胞内发挥诱导作用;nisin诱导系统不工作的原因可能是nisin缺乏进入兽疫链球菌内的有效途径或者nisK-nisR二元系统在兽疫链球菌内不可用。乳糖诱导效率低可能由于塔格糖-6-磷酸既是诱导物,也是乳糖代谢过程中的一种中间产物,在以乳糖为唯一糖源时很快被分解利用,并无一定的累积量用于诱导表达,也可能是兽疫链球菌内乳糖代谢效率较低,PlacA启动子活性较低,导致hasA基因未能高水平表达。鉴于上述3种系统在兽疫链球菌中均不可用,本研究基于Guzman等[9]的研究,以蔗糖操纵子为基础构建蔗糖诱导表达系统,可在兽疫链球菌内严谨且高效调控基因表达。
蔗糖诱导表达系统可在兽疫链球菌内严谨高效表达,相关实验表明蔗糖诱导hasA基因表达且葡萄糖效应沉默其表达,因而建立一种基于基因可控表达的两步发酵模式,用以消除发酵过程中HA积累对发酵液传质的影响,以期获得高密度菌体,提高透明质酸产量。两步法发酵过程中,hasA基因缺失促使兽疫链球菌丧失荚膜合成能力,溶氧和基质传递速率增大,但菌体浓度只是略有提高。产生此效果的可能原因是敲除hasA基因导致HA合成途径中某些物质积累,此类物质积累过量可抑制细菌生长繁殖。此外兽疫链球菌荚膜是大分子量酸性黏多糖(典型阴离子聚电解质),带大量负电荷[21],荚膜缺失引起细胞表面理化性质改变,并影响细胞对部分阳离子吸收利用,从而限制细菌生长繁殖。后续将深入研究ΔhasA的生理生化特性,试图解除限制其生长繁殖的因素,获得高密度菌体,并结合两步发酵模式,有望显著提高HA产量。
4 结论本研究从兽疫链球菌出发,成功构建4种诱导表达系统,并以蔗糖高效诱导表达系统为基础实现兽疫链球菌内基因可控表达的两步发酵,HA终产量达到3.4 g/L。
| [1] | Esposito E, Menegatti E, Cortesi R. Hyaluronan-based microspheres as tools for drug delivery: A comparative study. International Journal of Pharmaceutics, 2005, 288 : 35–49. DOI:10.1016/j.ijpharm.2004.09.001 |
| [2] | Tian WM, Zhang CL. Hyaluronic acid hydrogel as Nogo-66 receptor antibody delivery system for the repairing of injured rat brain: In vitro. Journal of Controlled Release, 2005, 102 : 13–25. DOI:10.1016/j.jconrel.2004.09.025 |
| [3] | Sugahara K, Schwartz NB, Dorfman A. Biosynthesis of hyaluronic acid by Streptococcus. Journal of Biological Chemistry, 1979, 254 (14): 6252–6261. |
| [4] | Beres SB, Sesso R, Pinto SWL, et al. Genome sequence of a lancefield group C Streptococcus zooepidemicus strain causing epidemic nephritis: new information about an old disease. PLoS One, 2008, 3 (8): e3026. DOI:10.1371/journal.pone.0003026 |
| [5] | Ma Z, Geng J, Zhang H, et al. Complete genome sequence of Streptococcus equi subsp. zooepidemicus strain ATCC35246. Journal of Bacteriology, 2011, 193 (19): 5583–5584. DOI:10.1128/JB.05700-11 |
| [6] | Hartman AH, Liu H, Melville SB. Construction and characterization of a lactose-inducible promoter system for controlled gene expression in Clostridium perfringens. Applied and Environmental Microbiology, 2011, 77 (2): 471–478. DOI:10.1128/AEM.01536-10 |
| [7] | Nariya H, Miyata H, Kuwahara T, et al. Development and characterization of a xylose-inducible gene expression system for Clostridium perfringens. Applied and Environmental Microbiology, 2011, 77 (23): 8439–8441. DOI:10.1128/AEM.05668-11 |
| [8] | Mierau I, Kleerebezem M. 10 years of the nisin-controlled gene expression system (NICE) in Lactococcus lactis. Applied Microbiology and Biotechnology, 2005, 68 : 705–717. DOI:10.1007/s00253-005-0107-6 |
| [9] | Guzman LM, Belin D, Carson MJ, et al. Tight regulation, modulation, and high-level expression by vectors containing the arabinose PBAD promoter. Journal of Bacteriology, 1995, 177 (14): 4121–4130. DOI:10.1128/jb.177.14.4121-4130.1995 |
| [10] | Sato Y, Yamamoto Y, Suzuki R, et al. Construction of scrA: : lacZ gene fusions to investigate regulation of the sucrose PTS of Streptococcus mutans. FEMS Microbiology Letters, 1991, 79 : 339–346. DOI:10.1111/fml.1991.79.issue-2-3 |
| [11] | Kim JH, Yoo SJ, Gil GH, et al. Selection of a Streptococcus equi mutant and optimization of culture condition for the production of high molecular weight hyaluronic acid. Enzyme and Microbial Technology, 1996, 19 : 440–445. DOI:10.1016/S0141-0229(96)00019-1 |
| [12] | Kim SJ, Park SY, Kim CW. A novel approach to the production of hyaluronic acid by Streptococcus zooepidemicus. Journal of Microbiology and Biotechnology, 2006, 16 : 1849–1855. |
| [13] | Krahulec J, Krahulcova J. Increase in hyaluronic acid production by Streptococcus equi subsp. zooepidemicus strain deficient in β-glucuronidase in laboratory conditions. Applied Microbiology and Biotechnology, 2006, 71 : 415–422. DOI:10.1007/s00253-005-0173-9 |
| [14] | Chong BF, Blank LM, Mclaughlin R, et al. Microbial hyaluronic acid production. Applied Microbiology and Biotechnology, 2005, 66 : 341–351. DOI:10.1007/s00253-004-1774-4 |
| [15] | Liu L, Du G, Chen J, et al. Enhanced hyaluronic acid production by a two-stage culture strategy based on the modeling of batch and fed-batch cultivation of Streptococcus zooepidemicus. Bioresource Technology, 2008, 99 : 8532–8536. DOI:10.1016/j.biortech.2008.02.035 |
| [16] | Sun X, Yang D, Wang Y, et al. Development of a markerless gene deletion system for Streptococcus zooepidemicus: functional characterization of hyaluronan synthase gene. Applied Microbiology and Biotechnol, 2013, 97 (19): 8629–8636. DOI:10.1007/s00253-013-5058-8 |
| [17] | Ho SN, Hunt HD, Horton RM, et al. Site-directed mutagenesis by overlap extension using the polymerase chain reaction. Gene, 1989, 77 (1): 51–59. DOI:10.1016/0378-1119(89)90358-2 |
| [18] | Mangan J, Sole K, Mitchison D, et al. An effective method of RNA extraction from bacteria refractory to disruption, including mycobacteria. Nucleic Acids Research, 1997, 25 (3): 675–676. DOI:10.1093/nar/25.3.675 |
| [19] | Liu L, Wang M, Du GC, et al. Enhanced hyaluronic acid production of Streptococcus zooepidemicus by an intermittent alkaline-stress strategy. Letters in Applied Microbiology, 2008, 46 : 383–388. DOI:10.1111/lam.2008.46.issue-3 |
| [20] | Chong BF, Nielsen LK. Aerobic cultivation of Streptococcus zooepidemicus and the role of NADH oxidase. Biochem Eng J, 2003, 16 : 153–162. DOI:10.1016/S1369-703X(03)00031-7 |
| [21] | 刘彤. 透明质酸及其在化妆品中的应用. 广州化工, 2009, 37(8): 71–73. |