2. 农业部华南热带农业环境重点实验室,广州 510642;
3. 广东省普通高等学校农业生态与农村环境重点实验室,广州 510642
2. Key Laboratory of Tropical Agro-Environment, Ministry of Agriculture, South China Agricultural University, Guangzhou 510642;
3. Key Laboratory of Agro-ecology and Rural Environment of Guangdong Regular Higher Education Institutions, South China Agricultural University, Guangzhou 510642
近年来,重金属污染事件频发,如血铅事件、铬渣污染事件及镉大米事件等[1],对社会造成了巨大的经济损失,同时给人类的健康带来了潜在的危害。传统的物理化学修复方法去除环境中的重金属污染物花费的费用相对较高,容易造成二次污染等问题[2]。与之比较,微生物修复方法在治理重金属污染方面展现出其菌种的来源丰富、低成本、无二次污染等方面的优势,具有较大的应用前景[3]。其中,针对细菌的吸附和解毒机制研究较多,Huang等[4]研究表明细菌B.cereusRC-1对Cd2+的吸附由细胞表面吸附和内部积累共同作用下完成的,表面吸附是被动,快速且不消耗能量;内部积累则是主动缓慢,需要能量且依赖于细菌的代谢调控系统[5]。
细菌对重金属的吸附解毒过程和机制是非常复杂的,往往是通过多种机制来共同对抗重金属的毒害作用。本文从细胞结构的角度,将整个吸附和解毒机制分三类:(1)细胞外部沉淀机制,通过分泌胞外物质改变环境条件等使重金属发生沉淀作用;(2)细胞表面吸附机制,通过各种作用将重金属离子吸附固定在细胞表面,减少细胞内部的吸收。这个过程涉及到络合、配位、离子交换、无机微沉淀、氧化还原及静电吸附等多种吸附机制[6];(3)细胞内部解毒机制,该过程较为复杂,涉及到重金属的运输和解毒机制等[7]。Chakraborty等[8]研究发现,细菌Pseudomonas aeruginosa JP-11对Cd进行细胞表面吸附的同时,细胞内部的Cd抗性基因czcABC表达水平也显著提高。
目前,用来研究重金属微生物修复机制的主要有真菌、藻类、放线菌、细菌等。本文针对细菌对重金属的吸附和解毒机制,从细胞外部、细胞表面和细胞内部等三方面概述其相关研究的进展,并探讨进一步可能发展的方向。
1 细胞外部沉淀机制细胞外部沉淀机制,本文指微生物通过分泌某些物质释放到环境中,通过改变环境的条件等使重金属离子发生沉淀作用,从而减少重金属离子对微生物的毒害作用。它与细胞表面吸附机制不同之处是发生在外界环境中。例如,环境中的某些细菌,如Bacillus brevis和Pseudomonas sp.,在重金属胁迫下,通过释放多糖、脂类、蛋白质等胞外分泌物来沉淀重金属离子[9]。如硫酸盐还原菌CL4通过释放甘油使锌发生沉淀,Acidithiobacillus ferrooxidans分泌硫化氢来沉淀铜[10]。有研究指出,胞外多糖被细菌分泌到溶液中后,可以与重金属离子发生络合作用[11]。如Pseudomonas fluorescens BM07分泌的生物高分子可以通过羟基、羧基等官能团使Hg、Cd、Zn等重金属离子发生沉淀[12]。此外,一些细菌则是通过释放胞外分泌物来提高环境的pH,从而促进重金属离子形成氢氧化物沉淀[13]。如Streptococcus sp.通过分泌脂肪分解酵素来提高溶液pH,使重金属离子发生絮凝沉淀,从而大大降低重金属离子对它的毒害[14]。由此可见,细胞外部吸附机制是细菌去除环境中重金属离子的常见机制之一。
2 细胞表面吸附机制针对细菌对重金属的吸附机制,大多数研究集中在细胞表面。重金属离子通过与细菌表面某些物质发生作用,尤其是与细胞壁组分和胞外聚合物,最终被固定在细胞表面。该过程涉及到的机制主要包括离子交换、表面络合、氧化还原、无机微沉淀和静电作用等。
2.1 离子交换机制离子交换机制指微生物细胞表面含有的一些离子与环境中重金属离子发生交换作用,从而吸附固定重金属离子[15]。李辉等[16]、刘瑞霞等[17]研究发现Bacillus cereus、Micrococcus luteus对Cd(Ⅱ)和Cu(Ⅱ)吸附过程中,伴随着K+、Ca2+、Na+和Mg2+等阳离子的大量释放,表明离子交换作用促进了这两种细菌对Cd和Cu的吸附固定;Ye等[15]发现细菌Stenotrophomonas maltophilia对Cu(Ⅱ)进行生物积累的同时,伴随着K+、Mg2+和Ca2+的释放。嗜麦芽窄食单胞菌在吸附Cu(Ⅱ)和Cd(Ⅱ)的同时,伴随着Cl-、PO43-、SO42-、Na+、NH4+、K+和Ca2+等离子释放[18]。以上这些研究表明,离子交换机制是细菌表面吸附主要机制之一(图 1),其中有些离子,如K+、Na+、Mg2+、Ca2+、Cl-、PO43-、SO42-和NH4+等在细菌吸附重金属的过程中起到了一定的作用。
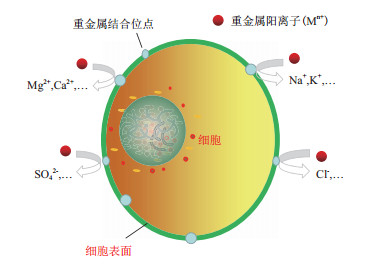
|
| 图 1 离子交换机制 |
重金属离子与微生物表面蛋白质、多糖、脂类等物质上的化学基团(如羧基、羟基、磷酰基、酰胺基、硫酸脂基、氨基和巯基等)相互作用,形成金属络合物,被吸附固定在细胞表面[19]。刘红娟等[20]探讨蜡状芽孢杆菌RC积累Cd(Ⅱ)前后细胞壁表面化学基团的变化情况发现,RC的细胞壁上参与络合作用的化学官能团主要有-OH、-NH、-CO和-COOH。Bahari等[21]用蜡状芽孢杆菌SZ2对As(Ⅲ)进行吸附固定的实验,则发现只有-OH和-NH参与了As(Ⅲ)的生物吸附过程。此外,不同的细菌吸附不同的重金属参与络合的官能团不尽相同。杨洲平等[22]在粗毛栓菌吸附Pb(Ⅱ)过程中,发现起吸附作用的官能团主要是-OH、-COOH、-SH和-PO4。Joo等[23]发现绿脓假单胞菌ASU 6a参与Zn(Ⅱ)的生物吸附的官能团主要是-OH、-NH、-CO和-COOH。而Bai等[24]则发现枯草芽孢杆菌DBM细胞表面的-OH、-NH、-CO、-COOH和-PO4与Pb(Ⅱ)发生络合作用。这些研究表明,-OH、-NH、-CO、-COOH、-SH和-PO4等细胞表面官能团在细菌吸附重金属的过程中起到了重要作用。
2.3 氧化还原机制氧化还原机制主要发生在一些多价态的重金属离子上。重金属胁迫下细菌对外界做出反应,如分泌一些氧化还原酶等,使重金属离子从高毒转化为低毒的价态并固定在细胞表面,从而保护自身,维持细胞正常的生理代谢[25]。如恶臭芽孢杆菌通过分泌Cr-还原酶到细胞表面,将细胞表面高毒性的Cr(Ⅵ)还原为低毒性的Cr(Ⅲ)[26]。有研究指出锰还原细菌可以将Mn4+还原成为Mn3+等,并固定在细胞表面,从而降低重金属对菌体的毒害。此外,Valenzuela等[25]和Fan等[27]从高砷污染河流的沉积物中分离出砷氧化菌,并发现这些菌株能将细胞表面的As(Ⅲ)氧化为更加稳定的As(Ⅴ)。以上研究表明,在面对Cr、Mn和As等多价态重金属的胁迫下,细菌往往会通过氧化还原机制来缓解重金属的毒害作用。
2.4 无机微沉淀机制无机微沉淀机制主要指微生物使重金属离子形成无机晶体沉淀,并积累在其细胞表面上,从而吸附固定重金属[28]。刘瑞霞等[14]研究Micrococcus luteus吸附Cu(Ⅱ)过程发现,当溶液pH值较高时,Cu2+会形成氢氧化物微沉淀沉积在细胞表面。Li等[28]发现Bacillus cereus细胞壁上的生物聚合物和银离子发生复杂的化学作用,使重金属以晶体微沉淀的方式存在于细胞表面。进一步来讲,Bai等[24]通过X射线衍射分析确定了Bacillus subtilis DBM对Pb(Ⅱ)的生物吸附过程中细胞表面形成了Pb5(PO4)3OH、Pb5(PO4)3Cl和Pb10(PO4)6(OH)2等晶体微沉淀。由此可见,无机微沉淀机制在细菌细胞表面吸附固定重金属的过程中扮演着重要角色。
值得注意的是,静电作用也是细胞表面吸附机制之一。李辉等[13]研究蜡状芽孢杆菌SY对Cd的吸附过程中发现,静电吸附对Cd的固定起到了一定的作用。同样,Shan等[29]发现Bacillus subtilis通过静电作用吸附Cu、La等重金属。
3 细胞内部解毒机制细菌表面在吸附固定重金属的同时,有一部分重金属通过离子转运通道进入到细胞内,为了使自身不受重金属离子的毒害,细菌需要能量和新陈代谢系统的调控。该过程主要分为两部分,第一部分是重金属离子的转运,即排至细胞外;第二部分是内部固定转化作用。目前认为的内部解毒机制主要有:促进重金属离子外流即外排作用;阻止重金属离子内流;重金属的转化作用;细胞内部的隔离作用(区域化作用)等[30-32]。这些机制的主要作用方式有外排泵、还原成低毒价态、结合金属整合肽、金属硫蛋白等沉积在内部特定位置等。另外,较之细胞外部和表面吸附机制,胞内机制尤为复杂,研究还不够深入,需要进一步探讨。
3.1 细菌对重金属的转运细菌需要通过减少运输、阻渗作用或外排机制来抵抗重金属的毒害,最有效的方法之一就是将重金属离子外排至细胞外。细菌中存在许多与金属离子运输有关的蛋白家族,它们大多位于细胞膜上,起着离子泵的作用[33]。如铜绿假单胞菌(Pseudo-monas aerugionsa)就是通过外排泵系统RND超家族(MexAB-OprM、MexCD-OprJ和MexEF-OprN等)将Ni、Mn等重金属离子转运至细胞表面[34, 35]。另外,某些细菌的锌抗性基因编码蛋白-ABC(ATP binding cassette)蛋白家族通过依赖能量的方式来实现对锌的外排[30]。同样,Antje等[36]研究发现有Zn(Ⅱ)存在时,菌体其中一个编码外排泵的基因CzcCBA的表达水平显著升高,并主动做出生理代谢反应,促使Zn的外排。而且,有的外排系统是ATP酶,如Mycobacterium的Cu抗性基因Ctp A编码的P型ATP酶起到Cu2+通道的作用,将过高浓度的Cu2+排出细胞外[37]。此外,还有Proteus mirabilis strain V7编码谷胱甘肽转移酶的基因gstPm-4在Cd2+、Cu2+、Hg2+和Pb2+存在的情况下表达水平上升[38],恶臭假单胞菌Zn(Ⅱ)抗性基因CD2 P型ATP酶基因CadA1在高浓度Zn2+下表达水平也上升,均参与重金属离子的转运[39]。
3.2 细菌对重金属的转化作用在细胞内部,细菌可以通过氧化还原、甲基化等作用使某些多价态重金属离子从高毒性转化为低毒产物,从而达到解毒效果[40]。有研究表明,Staphylococcus和Bacillus cereus Pj1有Hg抗性基因merA,该基因编码的汞抗性蛋白merA能将有毒性的Hg2+还原为Hg,再利用Hg本身的挥发性从细胞内部释放到体外[31, 41]。Enterobacter sp. DU17有Cr(Ⅵ)还原酶基因,在Cr(Ⅵ)的胁迫下能编码产生Cr抗性蛋白,一种Cr(Ⅵ)还原酶,将高毒性的Cr(Ⅵ)还原为低毒性的Cr(Ⅲ)[42]。此外,某些自养细菌,如硫铁杆菌类,则通过氧化作用使Fe2+、As5+和Mo4+等重金属离子活性降低[43]。有研究发现,Azospirillum sp.的砷抗性基因aioA能编码砷氧化酶,将高毒性的As(Ⅲ)氧化成低毒性的As(Ⅴ)[44];锑氧化菌Comamonas sp. S44可以将细胞内高毒Sb(Ⅲ)氧化成低毒Sb(Ⅴ)[45]。另外,也有研究发现假单胞菌属能使许多重金属离子发生甲基化反应,从而将金属离子毒性大大降低,如硒的甲基化产物毒性大大减弱[26]。以上研究表明,细菌能对一些重金属离子,如Hg、As、Sb和Mo等,进行内部转化作用,从而达到自身解毒作用。
3.3 细菌对重金属的区域化作用除了通过对重金属的转运及转化作用,细菌还能通过代谢某些蛋白,如金属硫蛋白和金属整合肽等,直接与重金属离子作用,并封存在细胞内部,即区域化作用,从而达到解毒作用[46]。有研究发现,细菌的金属硫蛋白(metallothionein)富含半肤氨酸,能够络合铜、锌等重金属,并通过区域化作用将这些重金属螯合物封存在细胞内的不同部位,从而使自身免受重金属的毒害[47]。还有研究表明肠道菌S. enferica通过金属整合肽(CopA、CueO和CueP)将胞质内过量的Cu2+封存起来[32]。E.coli受高浓度Cu2+胁迫时,细胞基质中过量的Cu2+主要是与大分子蛋白形成复合物CusCBA,被固定在细胞内[48]。可见,区域化作用是细菌内部重要的解毒机制之一。
4 展望细菌作为一种生命体,因其细胞结构的复杂性,使得在研究它的重金属生物吸附和解毒机制时需要从不同层次和角度来探讨。虽然本文将细菌的吸附机制分为三类来概述,即细胞外部、细胞表面、细胞内部(图 2)。但是必须指出的是,这三类机制并非独立的,而是相互联系且共同作用于细胞生命体的。因此,开展相关研究时,需全面考虑,才能系统地揭示其机制。

|
| 图 2 细菌对重金属的吸附和解毒机制 |
人们对细胞外部沉淀和表面吸附机制研究较为广泛,而对重金属胁迫下细菌胞内生理生化反应及新陈代谢调控机制的研究尚不多见,了解还不够深入。另一方面,细菌种类繁多,不同菌种的内部解毒机制也不尽相同,还未形成一套完整的抗性机制体系。因此,需要进一步从分子的角度探讨重金属胁迫下细菌的生存策略,弄清楚细菌解毒过程中关键性的基因和蛋白质,以及它们的功能作用。
此外,微生物吸附和解毒机制的研究基本上都是基于单一重金属离子存在下的情况,现实中往往是多种重金属共存的环境,意味着需要进一步探讨在多种重金属离子共存的情况下,细菌对重金属的吸附和解毒机制,以便更有效地指导实际环境中重金属污染的修复应用。
| [1] | 李兆辉, 王光明, 徐云明, 等. 镉、汞、铅污染及其微生物修复研究进展. 中国畜牧兽医, 2010, 37(9): 39–43. |
| [2] | Suranjana AR, Manas KR. Bioremediation of heavy metal toxicity with special reference to chromium. Al Ameen Journal of Medical Sciences, 2009, 2 (2): 57–63. |
| [3] | 赵庆龄, 张乃弟, 路文如. 土壤重金属污染研究回顾与展望Ⅱ--基于三大学科的研究热点与前沿分析. 环境科学与技术, 2010, 33(7): 102–106. |
| [4] | Huang F, Dang Z, Guo CL, et al. Biosorption of Cd (Ⅱ) by live and dead cells of Bacillus cereus RC-1 isolated from cadmium-contaminated soil. Colloids Surf B Biointerface, 2013, 107 : 11–18. DOI:10.1016/j.colsurfb.2013.01.062 |
| [5] | 王建龙, 陈灿. 生物吸附法去除重金属离子的研究进展. 环境科学学报, 2010, 30(4): 673–701. |
| [6] | Sud D, Mahajan G, Kaur MP. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions-a review. Bioresour Technol, 2008, 99 : 6017–6027. DOI:10.1016/j.biortech.2007.11.064 |
| [7] | Pavel K, Martina M, Tomas M. Microbial biosorption of metals[M]. Berlin: Springer Science, 2011: 320. |
| [8] | Chakraborty J, Das S. Characterization and cadmium-resistant gene expression of biofilm-forming marine bacterium Pseudomonas aerug-inosa JP-11. Environ Sci Pollut Res Int, 2014, 21 (24): 14188–14201. DOI:10.1007/s11356-014-3308-7 |
| [9] | Singh VK, Kumar A. Production and purification of an extracellular cellulase from Bacillus brevis VS-1. Biochem Mol Biol Int, 1998, 45 (3): 443–452. |
| [10] | Donati ER, Viera MR, Tavani EL, et al. Sulfidogenesis at low pH by acidophilic bacteria and its potential for the selective recovery of transition metals from mine waters. Advanced Materials Research, 2009, 71-73 : 693–696. DOI:10.4028/www.scientific.net/AMR.71-73 |
| [11] | Fayaz AM, Girilal M, Rahman M, et al. Biosynthesis of silver and gold nanoparticles using thermophilic bacterium Geobacillus stearothermophilus. Process Biocheistry, 2011, 46 (10): 1958–1962. DOI:10.1016/j.procbio.2011.07.003 |
| [12] | Kambiz AN, Hossein SZ, Sung CY, et al. The production of a cold-induced extracellular biopolymer by Pseudomonas fluorescens BM07 under various growth conditions and its role in heavy metals absorption. Process Biochemistry, 2007, 42 : 847–855. DOI:10.1016/j.procbio.2007.02.004 |
| [13] | Remacle J, Mugaruza I, Fransolet M. Cadmium removal by a strain of Alcaligenes denitrifieam isolated from a metal-polluted pond. Water Resourses, 1992, 26 (7): 923–926. DOI:10.1016/0043-1354(92)90198-D |
| [14] | Tripathi MK, Roy U, Jinwal UK, et al. Cloning, sequencing and structural features of a novel Streptococcus lipase. Enzyme and Microbial Technology, 2004, 34 : 437–445. DOI:10.1016/j.enzmictec.2003.11.020 |
| [15] | Ye JS, Yin H, Peng H, et al. Copper biosorption and ions release by Stenotrophomonas maltophilia in the presence of benzo[a]pyrene[J]. Chemical Engineering Journal, 2013, 219:1-9. |
| [16] | 李辉, 石璐, 张国芳, 等. 蜡状芽孢杆菌SY对镉的吸附机制. 科技导报, 2010, 28(7): 59–62. |
| [17] | 刘瑞霞, 潘建华, 汤鸿霄, 等. Cu (Ⅱ)离子在Micrococcus luteus细菌上的吸附机理. 环境化学, 2002, 1: 50–55. |
| [18] | 白洁琼, 尹华, 叶锦绍, 等. 嗜麦芽窄食单胞菌对铜镉的吸附特性与离子交换. 环境科学, 2013(1): 217–225. |
| [19] | Pan XH, Chen Z, Chen YJ, et al. The analysis of the immobilization mechanism of Ni (Ⅱ) on Bacillus cereus. Journal of Nanoscience and Nanotechnology, 2011, 11 (4): 3597–3603. DOI:10.1166/jnn.2011.3720 |
| [20] | 刘红娟, 张慧, 党志, 等. 一株耐镉细菌的分离及其富集Cd的机理. 环境工程学报, 2009, 3(2): 367–371. |
| [21] | Bahari ZM, Altowayti W, Ibrahim Z, et al. Biosorption of As (III) by Non-living biomass of an arsenic-hypertolerant Bacillus cereus strain SZ2 isolated from a gold mining environment:equilibrium and kinetic study. Appl Biochemi Biotechnol, 2013, 8 : 2247. |
| [22] | 杨洲平, 陈平, 王振宇, 等. 粗毛栓菌和蜡状芽孢杆菌及其共固定菌对Pb (Ⅱ)的吸附. 应用生态学报, 2012, 23(8): 2212–2218. |
| [23] | Joo J, Hassan SHA, Oh S. Comparative study of biosorption of Zn2+ by Pseudomonas aeruginosa and Bacillus cereus. International Biodeterioration and Biodegradation, 2010, 64 (8): 734–741. DOI:10.1016/j.ibiod.2010.08.007 |
| [24] | Bai J, Yang XH, Du RY, et al. Biosorption mechanisms involved in immobilization of soil Pb by Bacillus subtilis DBM in a multi-metal-contaminated soil. J Eeviron Sci, 2014, 10 : 2056–2064. |
| [25] | Valenzuela C, Campos V, Yanez J, et al. Isolation of arsenite-oxidizing bacteria from arsenic-enriched sediments from Camarones River, Northern Chile. Bulletin of Environmental Contamination and Toxicology, 2009, 82 (5): 593–596. DOI:10.1007/s00128-009-9659-y |
| [26] | 陈亚刚, 陈雪梅, 张玉刚, 等. 微生物抗重金属的生理机制. 生物技术通报, 2009(10): 60–65. |
| [27] | Fan H, Su C, Wang Y, et al. Sedimentary arsenite-oxidizing and arsenate-reducing bacteria associated with high arsenic groundwater from Shanyin, Northwestern China. Journal of Applied Microbiology, 2005, 105 (2): 529–539. |
| [28] | Li L, Hu Q, Zeng JH, et al. Resistance and biosorption mechanism of silver ions by Bacillus cereus biomass. Journal of Environmental Sciences, 2011, 23 (1): 108–111. DOI:10.1016/S1001-0742(10)60380-4 |
| [29] | Shan Q, Fang M, Huang X, et al. Study on the adsorption of bacteria in ceramsite and their synergetic effect on adsorption of heavy metals. Water Sci Technol, 2014, 69 (2): 407–413. DOI:10.2166/wst.2013.710 |
| [30] | 刘义, 何钢, 陈介南, 等. 细菌的锌抗性基因及其在生物修复中的应用. 生物技术通报, 2008, 2: 35–38. |
| [31] | Baldi F, Gallo M, et al. Seasonal mercury transformation and surficial sediment detoxification by bacteria of Marano and Grado lagoons. Estuari Coast Shelf Sci, 2012, 113 : 105–115. DOI:10.1016/j.ecss.2012.02.008 |
| [32] | Osman D, Waldron KJ, Denton H, et al. Copper homeostasis in Salmonella is atypical and copper-CueP is a major periplasmic metal complex. J Biol Chem, 2010, 33 : 25259–25268. |
| [33] | Wang XY, Chen MLi, et al. Genome sequence analysis of the naph-thenic acid degrading and metal resistant bacterium Cupriavidus gilardii CR3. PLoS One, 2015, 8 : e0132881. |
| [34] | 李樊, 刘义, 孙伟峰, 等. 铜绿假单胞菌czcCBA基因与生物修复. 生物技术通报, 2010(11): 44–47. |
| [35] | Boutoille D, Jacqueline C, Le Mabecque V, et al. In vivo impact of the MexAB-OprM efflux system on beta-lactam efficacy in an experimental model of Pseudomonas aeruginosa infection. Int J Antimicrob Agents, 2009, 33 (5): 417–420. DOI:10.1016/j.ijantimicag.2008.10.029 |
| [36] | Stahl A, Pletze D, Mehmood A, et al. Marinobacter adhaerens HP15 harbors two CzcCBA efflux pumps involved in zinc detoxification. Antonie Van Leeuwenhoek, 2015, 108 : 649–658. DOI:10.1007/s10482-015-0520-5 |
| [37] | Andres LT, Lorena NA, et al. CtpA, a putative Mycobacterium tube-rculosis P-type ATPase, is stimulated by copper (Ⅰ) in the mycob-acterial plasma membrane. Biometals, 2015, 28 : 713–724. DOI:10.1007/s10534-015-9860-x |
| [38] | Zhang WW, Yin K, Li BW, et al. A glutathione S-transferase from Proteus mirabilis involved in heavy metal resistance and its potential application in removal of Hg2+. Journal of Hazardous Materials, 2013, 261 : 646–652. DOI:10.1016/j.jhazmat.2013.08.023 |
| [39] | 王伟.恶臭假单胞菌CD2 P型ATP酶基因cadA1抗Zn2+功能的确定[D].武汉:华中农业大学, 2008. |
| [40] | Giovanella P, Costa AP, Schffer N, et al. Detoxification of mercury by bacteria using crude glycerol from biodiesel as a carbon source. Water Air Soil Pollut, 2015, 226 : 224. DOI:10.1007/s11270-015-2480-9 |
| [41] | Santos-Gandelman JF, Cruz K, Crane S, et al. Potential application in mercury bioremediation of a marine sponge-Isolated Bacillus cereus strain Pj1. Curr Microbiol, 2014, 69 (3): 374–380. DOI:10.1007/s00284-014-0597-5 |
| [42] | Rahman Z, Singh VP. Cr (Ⅵ) reduction by Enterobacter sp. DU17 isolated from the tannery waste dump site and characterization of the bacterium and the Cr (Ⅵ) reductase. International Biodeterioration and Biodegradation, 2014, 91 : 97–103. DOI:10.1016/j.ibiod.2014.03.015 |
| [43] | Yamamura S, Amachi S. Microbiology of inorganic arsenic:From metabolism to bioremediation. Journal of Bioscience and Bioengineering, 2014, 118 (1): 1–9. DOI:10.1016/j.jbiosc.2013.12.011 |
| [44] | Bahar MM, Megharaj M, Naidu R. Oxidation of arsenite to arsenate in growth medium and groundwater using a novel arsenite-oxidizing diazotrophic bacterium isolated from soil. International Biodeterioration and Biodegradation, 2016, 106 : 178–182. DOI:10.1016/j.ibiod.2015.10.019 |
| [45] | Li J, Wang Q, Zhang SZ, et al. Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil. Int Biodeterior Biodegradation, 2013, 76 : 76–80. DOI:10.1016/j.ibiod.2012.06.009 |
| [46] | Sinha A, Kumar S, Khare SK. Biochemical basis of mercury remediation and bioaccumulation by Enterobacter sp. EMB21. Appl Biochem Biotechnol, 2013, 169 (1): 256–267. DOI:10.1007/s12010-012-9970-7 |
| [47] | Vasak M. Advances in metallothionein structure and functions. J Trace Elem Med Biol, 2005, 19 (1): 13–17. DOI:10.1016/j.jtemb.2005.03.003 |
| [48] | Ward SK, Abomoelak B, Hoye EA, et al. CtpV:a putative copper exporter required for full virulence of Mycobacterium tuberculosis. Mol Microbiol, 2010, 77 (5): 1096–1110. DOI:10.1111/mmi.2010.77.issue-5 |




