现在普遍认为无脊椎动物的免疫防御体系更多的依赖于天然免疫反应,该反应包括依靠吞噬作用的细胞免疫和以非特异性免疫因子的综合作用而完成的体液免疫。由于缺乏获得性免疫系统,它们主要依靠天然免疫系统抵御各种病原的入侵,维持机体的正常生命活动[1]。当无脊椎动物遭受病原感染后,天然免疫系统首先通过模式识别受体(pattern recognition molecule,PRM)识别辨别非己物质,而后引发免疫信号的调整和放大,激活不同的信号转导途径,并导致各种免疫相关基因的转录和表达,继而针对不同病原产生各种有效的免疫效应,最终将病原体杀死和清除[2],因此包括凝集素在内的模式识别分子在软体动物的免疫识别中起着极其重要的作用。凝集素能选择性识别多糖结构并与之特异性非共价结合的蛋白质。甘露聚糖结合凝集素(mannan-binding lectin,MBL)广泛存在动物体内并由肝细胞合成和分泌,是Ca2+依赖型C型凝集素超家族中胶原凝素之一。因为该凝集素可识别并结合具有甘露聚糖末端的糖蛋白,故又称甘露聚糖结合蛋白(mannan-binding protein,MBP)[3]。MBL是先天性免疫系统中的重要成员,由多条肽链组成的寡聚物。每条肽链包含4个区域:富含半胱氨酸的N末端(cysteine-rich regions)、胶原样区(collagen-like region)、颈区(neck region)和糖识别域(carbohyd-rate recognition domain,CRD)[3-5]。MBL的识别功能区是CRD,具有模式识别功能。在钙离子存在的情况下,可以结合带有甘露糖末端的病原分子,激活补体系统,并且在MBL相关性丝氨酸蛋白酶(MASP)的作用下启动补体的凝集素途径,产生补体活性片段,发挥溶解细菌或病毒、促进吞噬和调节炎症等免疫防御功能[6]。
目前高等动物中关于MBL的研究报道很多。哺乳动物的研究比较成熟,其MBL的两个基因分别为MBL1和MBL2。近年来鱼类的凝集素研究也逐渐增多。鲑鱼凝集素是最早报道的鱼类凝集素,具有抗菌和增强巨噬细胞的活性[7, 8]。随后从斑马鱼和鲶鱼中也克隆出MBL基因[9-11]。虽然凝集素在无脊椎动物的免疫中也扮演重要角色,但其MBL研究较少,目前主要集中在文昌鱼(Branchiostoma lanceolatum)和海鞘等有限的几个种类中。其MBL的同源分子虽然也参与了补体系统的激活,但是其具体作用机制不同于脊椎动物[12]。
杂色鲍作为我国沿海重点养殖对象,随着养殖规模扩大,各种病害频发[13-15]。本研究采用EST技术和RACE技术从体外扩增、克隆杂色鲍甘露糖结合凝集素基因并对该基因在杂色鲍各组织中和在副溶血弧菌刺激后的表达进行检测,旨在研究杂色鲍甘露糖结合凝集素在杂色鲍免疫中的作用,加深了解鲍免疫分子机制,为鲍病害防治提供基础数据。
1 材料与方法 1.1 材料 1.1.1 实验动物及其处理实验所需杂色鲍全购自厦门大嶝岛养殖场,平均体长(4.35±0.50)cm,平均体重(7.15±1.80)g,购回后的杂色鲍暂养于集美大学海水试验场在有过滤层并充氧的50 L水槽中。海水每2 d一换,水温控制在23-25℃。每2 d喂一次新鲜的江蓠。杂色鲍暂养驯化两周后,用于组织取样和细菌感染实验。
挑选性腺发育成熟的亲鲍进行人工催产。收集各阶段幼虫,液氮速冻过夜后,存于-80℃待用。组织表达实验取6只健康杂色鲍,分别采集实验所需各组织后立即液氮速冻,存于-80℃待用。弧菌感染实验中,用微型注射器对杂色鲍腹足肌肉注射50 μL的副溶血弧菌菌液(实验组,弧菌菌液浓度为1.1×108 CFU/mL),对照组注射50 μL灭菌生理盐水(0.8% NaCl)。注射后不同时间段实验组和对照组每组取6只杂色鲍,分别收集各组织,所有样品液氮速冻后,存于-80℃待用。
以上实验方法参照葛辉等[16]的研究。
1.1.2 主要试剂和仪器本实验室自制的RNA抽提试剂RDP,具体配方及RNA提取过程见Chomczynski等[17]的方法。
1.2 方法 1.2.1 总RNA的提取取出50-100 mg在-80℃保存的杂色鲍样品组织,置于装有1 mL RDP[17]提取液的离心管中,加入灭菌的钢珠后用自动匀浆仪超声研磨至无颗粒状悬液,静置于冰盒10 min,使细胞充分裂解。将悬液转移至加有预冷的200 μL CHCl3的离心管中,轻微震荡15 s,12 000×g低温离心10 min,取上清液移至新离心管中,加入500 μL异丙醇,低温下放置后12 000×g低温离心10 min。弃上清,留下离心管中白色沉淀物,加入700 μL的70%-75%乙醇洗去沉淀中的异丙醇,12 000×g低温离心5 min,重复洗涤2次。然后清除管中残留乙醇后,加10-30 μL无RNA酶灭菌的双蒸水溶解RNA沉淀。
1.2.2 cDNA第一条链的合成用于实时定量PCR的cDNA第一条合成如下。在0.2 mL的PCR管中加入如下的反应体系:加入3 μg经过Dnase I(购自Thermo Fisher Scientific公司)处理过的总RNA,1 μL的随机引物(10 mmol/L),再加无RNA酶的双蒸水至14 μL,轻轻混匀后,72℃,10 min,然后冰上放置5 min,破坏其RNA二级结构。随后加入以下体系:4 μL 5×First-strand Buffer,1 μL dNTP Mix(10 mmol/L),1 μL MMLV逆转录酶(200 U/μL)(购自Promega公司逆转录试剂盒,A3500),混合均匀。37℃下反应90 min后将产物置于-20℃保存备用。用于RACE扩增的cDNA第一条链合成同上,只是将随机引物更换为1 μL 5’ CDS primer+1 μL SMART Ⅱ Oligo(10 μmol/L)或1 μL的3’ CDS primer(10 μmol/L)。制备好的cDNA第一条链于-20℃下保存备用。
1.2.3 RACE扩增第一轮PCR扩增。采用25 μL反应体系如下:1 μL cDNA第一条链溶液,0.5 μL outer primer(10 mmol/L),2.5 μL UPM(10 μmol/L),2.5 μL 10×PCR-Buffer,0.5 μL dNTP Mix(10 mmol/L),0.5 μL Taq DNA聚合酶,17.5 μL双蒸水。PCR反应条件为:95℃ 3 min;95℃ 30 s,68℃ 30 s,72℃ 2 min,5个循环;95℃ 30 s,65℃ 30 s,72℃ 2 min,5个循环;95℃ 30 s,55-60℃ 30 s,72℃ 2 min,25个循环;72℃ 10 min;4℃ 5 min(所用引物见表 1)。第二轮特异性扩增以第一轮PCR产物为模板,inner和NUP为引物进行扩增(表 1)。PCR反应体系及条件同第一轮PCR。
在所获得的perlucin基因cDNA全长的5’和3’非编码区分别设计一个正向和反向引物(即Head to tall-F和Head to tall-R,见表 1),进行PCR扩增。反应条件:94℃ 3 min;94℃ 30 s,68℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min,4℃ 5 min。PCR产物电泳后将预期大小DNA回收测序(GenCl-ean柱式琼脂糖凝胶DNA回收试剂盒,上海捷瑞生物工程有限公司)。
1.2.5 实时荧光定量PCR以逆转录合成cDNA为第一条链,采用Real time PCR技术对副溶血弧菌感染后perlucin基因进行表达分析。杂色鲍β-actin作为内参基因。经过PCR实验对引物和模板浓度比例进行优化后,将总反应体积定位为20 μL,每个体系反应包括:10 μL SYBR Green Realtime PCR Master Mix(购自Promega公司GoTaq qPCR Master Mix,A6001),10 μmol/L正、反引物各0.5 μL,9 μL cDNA模板。每个时相做5个样品平行检测。PCR反应条件:95℃ 15 s,60℃ 1 min,40个循环。并对目的基因和内参基因的熔解曲线进行分析(所用引物见表 1)。
1.2.6 数据处理根据LightCycler480 Real Time PCR System仪器自动给出每个样品的Cp值,计算胚胎和幼虫发育阶段及组织表达的待测基因的相对表达量(RQ)[(待测组目的基因平均Cp值-待测组内参基因平均Cp值)-(对照组目的基因平均Cp值-对照组内参基因平均Cp值)],基因表达水平用RQ平均值±标准误差来表示,并用SPSS18.0统计软件对数据进行单因素方差分析(ANOVA),以P < 0.05(双尾检测法)为差异显著。
1.2.7 生物信息学分析运用BLAST软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性比对;使用Compute pI/Mw tool(http://www.expasy.org/tools/pi_tool.html)预测等电点和分子质量;利用NetNG-lyc1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)查找糖基化位点(N-X-S/T);NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)查找磷酸化位点;采用SignalP3.0 Server(http://www.cbs.dtu.dk/services/SignalP/)寻找信号肽;ScanProsite(http://www.expasy.ch/tools/scanprosite/)预测二硫键位置;TMHMM 2.0 Server(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测蛋白跨膜结构域;InterProScan soft-ware(http://www.ebi.ac.uk/InterProScan/)预测蛋白质能结构域;使用ClustalW软件进行多重比较。
2 结果 2.1 perlucin1和perlucin4的序列分析perlucin1 cDNA全长为668 bp,包括69 bp的5’非编码区域(untranslated region,UTR),101 bp 3’ UTR和498 bp开放阅读框(open reading frame,ORF),编码165个氨基酸。预测编码蛋白分子量约为18.8 kD,等电点约为4.57,含有2个二硫键、2个糖基化位点、13个磷酸化位点和1个C-type lectin(CTL)糖识别结构域(CRD)(图 1)。

|
| 图 1 perlucin1 cDNA全长和推导的氨基酸序列 *为终止子;圆圈为糖基化位点;粗下划线为信号肽;双下划线为CTL糖识别结构域(CRD);起始密码子和终止密码子用粗体表示;矩形框为参与二硫键形成的半胱氨酸 |
perlucin4 cDNA全长为645 bp,包括45 bp的5’ UTR,105 bp的3’ UTR和495 bp的ORF,编码164个氨基酸。预测编码蛋白分子量约为18.5 kD,等电点约为6.09,含有2个二硫键、3个糖基化位点、10个磷酸化位点和1个CTL糖识别CRD(图 2)。

|
| 图 2 perlucin4 cDNA全长和推导的氨基酸序列 *为终止子;圆圈为糖基化位点;粗下划线为信号肽;双下划线为CTL糖识别结构域(CRD);起始密码子和终止密码子用粗体表示;矩形框为参与二硫键形成的半胱氨酸 |
运用ClustalW软件分别将perlucin1和perlucin4的蛋白序列进行blast比对,同源性分析显示,杂色鲍perlucin1和perlucin4与其他物种的perlucin凝集素(表 2和表 3)的CRD中均有6个保守的半胱氨酸,其中后面4个形成二硫键。结构域中perlucin1含有“QPD”位点而perlucin4含有“EPN”位点(图 3)。

|
| 图 3 杂色鲍perlucin1(A)、perlucin4(B)和其他物种perlucin凝集素氨基酸的多重比对 星号(*)代表同源性;(:)代表相似性;矩形框是糖结合位点 |
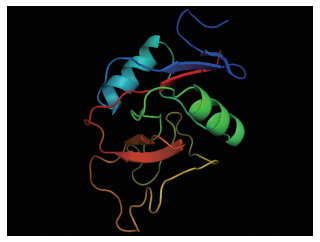
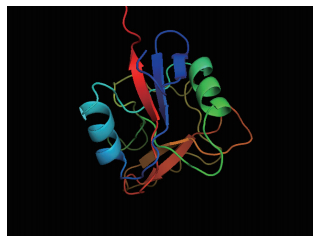
利用SWISS-MODEL软件的同源建模方法将杂色鲍Perlucin1的蛋白序列与SWISS-MODEL搜索的小鼠的mannose-binding protein C为模板(PDB:1BV4_A)进行联配,利用perlucin1蛋白序列C型结构域133个氨基酸残基构建其三维结构(图 4),其α-螺旋和β-折叠清晰可见,二者一致性为8.9%,相似度为16.1%。将perlucin4的蛋白序列与小鼠的mannose-binding protein A为模板(PDB:1YTT_A)进行联配(图 5),二者的C型结构域一致性为10.4%,相似度为18.3%。
|
| 图 4 杂色鲍perlucin1凝集素的蛋白三维结构预测图 |
|
| 图 5 杂色鲍perlucin4凝集素的蛋白三维结构预测图 |
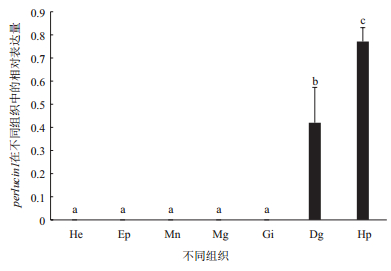
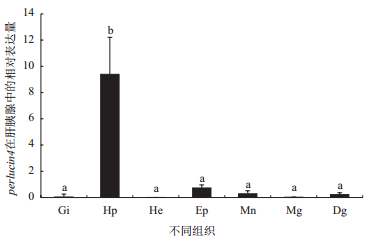
实时定量PCR组织表达分析中,perlucin1只有在杂色鲍的消化道和肝胰腺中表达且在肝胰腺中表达量最高(图 6)。而perlucin4在杂色鲍7个组织中均有表达,且在肝胰腺中的表达量最高,其他组织中表达量较低(图 7)。
|
| 图 6 perlucin1基因的组织表达 He:血细胞;Ep:上足;Mn:外套膜;Mg:黏液腺;Gi:鳃;Dg:消化道;Hp:肝胰腺;不同组织中的a、b、c表示差异显著(P < 0.05) |
|
| 图 7 perlucin4基因的组织表达 Gi:鳃;Hp:肝胰腺;He:血细胞;Ep:上足;Mn:外套膜;Mg:黏液腺;Dg:消化道;不同组织中的a、b表示差异显著性(P < 0.05) |
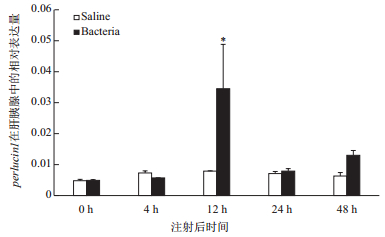
副溶血弧菌感染杂色鲍0、4、12、24和48 h后,肝胰腺Real time PCR结果(图 8)显示,perlucin1在弧菌感染后0-4 h无显著性变化,而在感染12 h表达量显著上调,达显著性水平(P < 0.05)。
|
| 图 8 perlucin1基因在肝胰腺中的表达 *:表示差异显著(P < 0.05) |
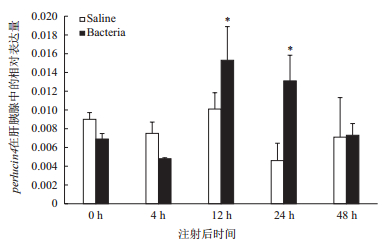
perlucin4在弧菌感染后0-4 h之间的表达量没有显著性变化,而在感染12-24 h,基因表达量显著上调,达到显著性水平(P < 0.05)。在感染48 h后,表达量出现下调(图 9)。
|
| 图 9 perlucin4基因在肝胰腺中的表达 *:表示差异显著(P < 0.05) |
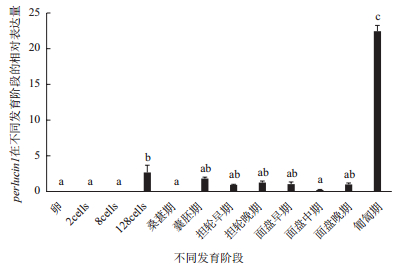
在胚胎和幼虫发育过程中,perlucin1在8细胞期之前都没有表达,在128细胞时期表达量上调,但直到面盘幼虫晚期之前表达量都非常低,到匍匐期表达量显著性上调达到最高,与其它各时期形成显著性差异(P < 0.05)(图 10)。
|
| 图 10 perlucin1胚胎和幼虫各时期表达 不同组织中的a、b、c表示差异显著(P < 0.05) |
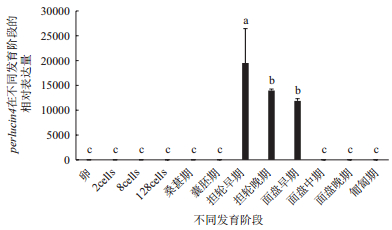
perlucin4在囊胚期之前表达量极低或者没有表达(P < 0.05)。从担轮幼虫早期开始表达量显著性上升,达到最高,与卵形成显著性差异(P < 0.05)。从面盘幼虫中期开始表达下调,其表达量急剧下降,基因表达水平一直保持在极低水平(图 11)。
|
| 图 11 perlucin4胚胎和幼虫各时期表达 不同组织中的a、b、c表示差异显著(P < 0.05) |
杂色鲍属于软体动物门腹足纲的无脊椎动物,主要依靠天然免疫系统(innate immune system)防御病原微生物。天然免疫的免疫因子如凝集素、溶菌酶、抗菌肽、补体等起着非常重要的作用,这些免疫因子负责免疫识别是一类由宿主本身的胚系基因编码的蛋白,即模式识别受体[18]。凝集素是无脊椎动物中免疫防御的重要体液因子之一,拥有专一性受体识别因子[19]。凝集素的这种专一性识别类似于脊椎动物的免疫球蛋白,由此可以推测在缺乏免疫球蛋白的无脊椎动物体内,是依赖凝集素完成抗原与防御系统的识别的。杂色鲍perlucin只含有单个CRD,与哺乳动物含有多个CRD的MBL分子相比,杂色鲍的MBL分子与糖配体单价结合的亲和力很弱[20, 21]。
杂色鲍perlucin的基因序列通过结构分析显示,perlucin4含有EPN位点而perlucin1则为QPD位。众所周知,“ENP”为甘露聚糖结合位点,“QPD”为半乳糖结合位点[22],这预示perlucin1可能与半乳糖结合。最近研究发现“EPN”和“QPD”位点都可以与甘露聚糖特异性结合。该现象最先在鲤鱼的MBLs和突变的老鼠重组MBLs的实验中发现[23-25],ELISA实验过程中含有“QPD”位点的MBLs能与板上固定的甘露糖结合,其结合效率不仅受到板上半乳糖数量影响也受到甘露糖数量的影响。而在无脊椎动物中最早在海鞘中克隆出MBL样凝集素GBL,它能与葡聚糖结合,具有与MBL一样的糖结合结构域(C-typelectin domains,CTLDs),但在N端缺乏胶原区。实验结果表明也能与海鞘的MASP结合激活凝集素途径,被认为是无脊椎动物MBLs的祖先[26]。随后在海湾扇贝、澳洲绿唇鲍、中华绒螯蟹、凡纳滨对虾[27-30]等中均发现它们的MBL含有“QPD”位点以及受半乳糖和甘露糖抑制的现象,这说明无脊椎动物的MBL免疫模式比脊椎动物复杂。
肝脏是哺乳动物MBL合成的主要场所,也是重要的免疫器官。Real-time PCR检测组织表达研究发现,在未经刺激的健康杂色鲍中,perlucin1和perlucin4在组织中都有表达,并且在肝胰腺中表达量最高。而在海湾扇贝、虹鳟、斑点叉尾鮰和鲤鱼中发现MBL在肝脏和脾脏中表达量最高[11, 24, 31]。病原微生物入侵宿主造成机体感染、创伤和炎症发生,免疫系统会大量合成具有防御功能的血浆蛋白、凝集素等免疫因子,这些免疫因子能使机体对修复组织损伤、抵御微生物感染等发生作用,而这些免疫因子是在肝细胞中转录合成的,所以肝脏是一个重要的免疫器官。通过检索太平洋牡蛎的基因组数据库(http://www.oysterdb.com/),我们发现杂色鲍perlucin基因与牡蛎perlucin基因相似,在整理牡蛎perlucin基因数据中,牡蛎perlucin在组织表达中消化腺中表达量最高。肝胰腺是无脊椎动物的重要免疫器官之一,对杂色鲍而言,在它参与消化、储存和代谢等生理功能,对环境变化和水媒性物质的刺激非常敏感,在启动鲍免疫应答起重要作用。
副溶血弧菌感染后,Real-time PCR结果显示perlucin1和perlucin4基因的表达在肝胰腺中都有显著提高,这表明perlucin1和perlucin4参与了杂色鲍免疫应答。作为天然免疫的效应分子,perlucin处在免疫反应的末端,受免疫信号识别、传递等分子的调控。其大量表达的时相一般晚于免疫信号识别和传递分子[32]。杂色鲍感染副溶血弧菌后,免疫信号识别和传递分子显著上调表达的时相一般是感染后3-6 h[33, 34],而免疫效应分子上调表达的时相通常在12 h以后[32, 35, 36]。但是perlucin1和perlucin4的表达模式不同。前者在12 h和48 h都显著上调,后者只在12 h上调。虽然两者都是免疫效应基因,但是在清除病原微生物过程发挥的作用存在差异。我们注射的是副溶血弧菌活菌,进入杂色鲍机体的活菌能够大量繁殖,24 h后注射部位会形成水泡囊肿[32]。因此,进入杂色鲍机体的弧菌在经历免疫反应清除后能残存一些。这些残存的弧菌可能是引起某些免疫效应基因如Mpeg(巨噬细胞表达基因)等在48 h上调表达的原因[32]。Perlucin1可能与Mpeg类似,能够响应残存弧菌而上调表达,而perlucin4则与DAD1和AP1类似,只在12 h或24 h时相上调表达[32, 35, 36]。
贝类的担轮幼虫和面盘幼虫细胞分化频繁增殖旺盛,是各种组织器官发生形成的重要阶段。免疫系统也在这个时期逐渐形成并完善。因母体效应而来的各种免疫基因的mRNA基本消耗殆尽,幼虫开始自主合成免疫基因的mRNA[37-40]。Perluncin4在担轮幼虫和面盘早期幼虫的高表达可能与免疫系统的完善有关。
杂色鲍perlucin1在胚胎和浮游幼虫阶段表达量极低,在匍匐期表达量显著上调。匍匐阶段鲍幼虫变态为稚鲍,由浮游生活转为底栖生活。这个阶段鲍幼虫会接触附着基上的生物膜。生物膜由底栖硅藻、细菌等众多微生物组成,它们的细胞壁上存在较多的糖类和糖蛋白诱导幼虫的免疫信号转导[41-43]。研究表明凝集素参与水生动物幼虫的附着和变态行为,多毛类石灰幼虫体内的凝集素能识别海水假单胞菌细胞壁上多糖,并与之结合后诱导幼虫附着变态[44]。Perlucin1的高表达可能是因接触这些微生物的糖类所引起。此外,在匍匐阶段鲍幼虫开始摄食生物膜上的底栖硅藻,这可能也是perlucin1在该阶段高表达的原因。这暗示perlucin1在幼虫的发育中发挥着多种作用,与perlucin4的作用完全相同。
4 结论本研究采用cDNA末端快速扩增(RACE)技术,获得两条杂色鲍perlucin基因的cDNA编码全序列。Real time PCR结果显示perlucin1和perlucin4参与了杂色鲍免疫应答。
| [1] | Loker ES. Gastropod immunobiology. Advances in Experimental Medicine and Biology, 2010, 708 : 17–43. DOI:10.1007/978-1-4419-8059-5 |
| [2] | Hoffmann JA, Kafatos FC, Janeway CA, et al. Phylogenetic perspectives in innate immunity. Science, 1999, 284 (5418): 1313–1318. DOI:10.1126/science.284.5418.1313 |
| [3] | 吴蔚, 陶然, 尚世强. 甘露糖结合凝集素研究进展. 中华微生物学和免疫学杂志, 2009(12): 1148–1152. |
| [4] | Taylor ME, Brickell P, Craig R, et al. Structure and evolutionary origin of the gene encoding a human serum mannose-binding protein. Biochem J, 1989, 262 : 763–771. DOI:10.1042/bj2620763 |
| [5] | Presanis J, Kojima M, Sim R. Biochemistry and genetics of mannan-binding lectin (MBL). Biochemical Society Transactions, 2003, 31 (4): 748–752. DOI:10.1042/bst0310748 |
| [6] | Endo Y, Nonaka M, Saiga H, et al. Origin of mannose-binding lectin-associated serine protease (MASP)-1 and MASP-3 involved in the lectin complement pathway traced back to the invertebrate, amphioxus. The Journal of Immunology, 2003, 170 (9): 4701–4707. DOI:10.4049/jimmunol.170.9.4701 |
| [7] | Ottinger CA, Johnson SC, Ewart KV, et al. Enhancement of anti-Aeromonas salmonicida activity in Atlantic salmon (Salmo salar) macrophages by a mannose-binding lectin. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1999, 123 (1): 53–59. DOI:10.1016/S0742-8413(99)00009-2 |
| [8] | Ewart KV, Johnson SC, Ross NW. Identification of a pathogen-binding lectin in salmon serum. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1999, 123 (1): 9–15. DOI:10.1016/S0742-8413(99)00002-X |
| [9] | Jackson AN, McLure CA, Dawkins RL, et al. Mannose binding lectin (MBL) copy number polymorphism in Zebrafish (D. rerio) and identification of haplotypes resistant to L. anguillarum. Immunogenetics, 2007, 59 (11): 861–872. DOI:10.1007/s00251-007-0251-5 |
| [10] | Ourth DD, Narra MB, Simco BA. Comparative study of mannose-binding C-type lectin isolated from channel catfish (Ictalurus punctatus) and blue catfish (Ictalurus furcatus). Fish & Shellfish Immunology, 2007, 23 (6): 1152–1160. |
| [11] | Zhang H, Peatman E, Liu H, et al. Characterization of a mannose-binding lectin from channel catfish (Ictalurus punctatus). Research in Veterinary Science, 2012, 92 (3): 408–413. DOI:10.1016/j.rvsc.2011.03.024 |
| [12] | Huang H, Huang S, Yu Y, et al. Functional characterization of a ficolin-mediated complement pathway in amphioxus. Journal of Biological Chemistry, 2011, 286 (42): 36739–36748. DOI:10.1074/jbc.M111.245944 |
| [13] | 王江勇, 郭志勋, 冯娟, 等. 养殖杂色鲍暴发病超微病理学研究. 海洋科学, 2007, 31(3): 28–32. |
| [14] | 杨蕊, 姜敬哲, 王江勇, 等. 杂色鲍低温病毒病研究进展. 广东农业科学, 2013(2): 114–117. |
| [15] | 陈佰义, 何礼贤, 胡必杰. 中国鲍曼不动杆菌感染诊治与防控专家共识. 中华医学杂志, 2012, 92(2): 76–85. |
| [16] | 葛辉.杂色鲍Toll样受体信号通路分子的克隆及表达分析[D].厦门:集美大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10390-1014165137.htm |
| [17] | Chomczynski P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biotechniques, 1993, 15 (3): 532–537. |
| [18] | 彭怀明, 周书林. 软体动物免疫功能研究进展. 动物医学进展, 2010, 31(8): 79–83. |
| [19] | 谢广成, 李丹彤, 周立敬. 刺参甘露糖结合凝集素的生物信息学分析. 生物技术通报, 2011(2): 136–140. |
| [20] | Worthley D, Bardy P, Mullighan C. Mannose-binding lectin: biology and clinical implications. Internal Medicine Journal, 2005, 35 (9): 548–555. DOI:10.1111/imj.2005.35.issue-9 |
| [21] | 卜令真, 张士璀. 甘露糖结合凝集素在先天性免疫中的作用. 鲁东大学学报:自然科学版, 2013, 29(3): 229–233. |
| [22] | Weis WI, Taylor ME, Drickamer K. The C-type lectin superfamily in the immune system. Immunological Reviews, 1998, 163 (1): 19–34. DOI:10.1111/imr.1998.163.issue-1 |
| [23] | Drickamer K. Engineering galactose-binding activity into a C-type mannose-binding protein. Nature, 1992, 360 (6400): 183–186. DOI:10.1038/360183a0 |
| [24] | Nakao M, Kajiya T, Sato Y, et al. Lectin pathway of bony fish complement: identification of two homologs of the mannose-binding lectin associated with MASP2 in the common carp (Cyprinus carpio). The Journal of Immunology, 2006, 177 (8): 5471–5479. DOI:10.4049/jimmunol.177.8.5471 |
| [25] | Taylor ME, Bezouska K, Drickamer K. Contribution to ligand binding by multiple carbohydrate-recognition domains in the macrophage mannose receptor. Journal of Biological Chemistry, 1992, 267 (3): 1719–1726. |
| [26] | Skjoedt MO, Palarasah Y, Rasmussen K, et al. Two mannose-binding lectin homologues and an MBL-associated serine protease are expressed in the gut epithelia of the urochordate species Ciona intestinalis. Developmental & Comparative Immunology, 2010, 34 (1): 59–68. |
| [27] | Huang M, Song X, Zhao J, et al. A C-type lectin (AiCTL-3) from bay scallop Argopecten irradians with mannose/galactose binding ability to bind various bacteria. Gene, 2013, 531 (1): 31–38. DOI:10.1016/j.gene.2013.08.042 |
| [28] | Jin XK, Li WW, Cheng L, et al. Two novel short C-type lectin from Chinese mitten crab, Eriocheir sinensis, are induced in response to LPS challenged. Fish & Shellfish Immunology, 2012, 33 (5): 1149–1158. |
| [29] | Costa F, Valen?a N, Silva A, et al. Cloning and molecular modeling of Litopenaeus vannamei (Penaeidae) C-type lectin homologs with mutated mannose binding domain-2. Genet Mol Res, 2011, 10 : 650–664. DOI:10.4238/vol10-2gmr999 |
| [30] | Mann K, Weiss IM, Andre S, et al. The amino-acid sequence of the abalone (Haliotis laevigata) nacre protein perlucin. European Journal of Biochemistry, 2000, 267 (16): 5257–5264. DOI:10.1046/j.1432-1327.2000.01602.x |
| [31] | Kania PW, Sorensen RR, Koch C, et al. Evolutionary conservation of mannan-binding lectin (MBL) in bony fish: Identification, characterization and expression analysis of three bona fide collectin homologues of MBL in the rainbow trout (Onchorhynchus mykiss). Fish & Shellfish Immunology, 2010, 29 (6): 910–920. |
| [32] | Wang GD, Zhang KF, Zhang ZP, et al. Molecular cloning and responsive expression of macrophage expressed gene from small abalone Haliotis diversicolor supertexta. Fish & Shellfish Immunology, 2008, 24 (3): 346–359. |
| [33] | Ge H, Wang GD, Zhang LL, et al. Characterization of interleukin-1 receptor-associated kinase 1 binding protein 1 gene in small abalone Haliotis diversicolor. Gene, 2012, 506 (2): 417–422. DOI:10.1016/j.gene.2012.06.038 |
| [34] | Ge H, Wang GD, Zhang LL, et al. Molecular cloning and expression of interleukin-1 receptor-associated kinase 4, an important mediator of Toll-like receptor signal pathway, from small abalone Haliotis diversicolor. Fish & Shellfish Immunology, 2011, 30 (4): 1138–1146. |
| [35] | Wang GD, Zhang ZP, Lin S, et al. A homologue of dermatopontin from Haliotis diversicolor and its response to pathogenic infection. Aquaculture Research, 2015, 46 (7): 1537–1549. DOI:10.1111/are.2015.46.issue-7 |
| [36] | 王国栋, 和四梅, 张丽莉, 等. 杂色鲍AP-1的克隆及在发育和弧菌感染后的表达分析. 水产科学, 2016, 35(3): 227–233. |
| [37] | Wang L, Yue F, Song X, et al. Maternal immune transfer in mollusc. Developmental & Comparative Immunology, 2015, 48 (2): 354–359. |
| [38] | Yue F, Zhou Z, Wang L, et al. Maternal transfer of immunity in scallop Chlamys farreri and its trans-generational immune protection to offspring against bacterial challenge. Developmental & Comparative Immunology, 2013, 41 (4): 569–577. |
| [39] | Yue F, Shi X, Zhou Z, et al. The expression of immune-related genes during the ontogenesis of scallop Chlamys farreri and their response to bacterial challenge. Fish & Shellfish Immunology, 2013, 34 (3): 855–864. |
| [40] | Tirapé A, Bacque C, Brizard R, et al. Expression of immune-related genes in the oyster Crassostrea gigas during ontogenesis. Developmental & Comparative Immunology, 2007, 31 (9): 859–873. |
| [41] | 王长法, 张士璀, 王昌留. 水生无脊椎动物凝集素研究概述. 海洋科学, 2005, 29(4): 63–67. |
| [42] | 张涛. 海洋无脊椎动物幼虫附着变态研究进展. 海洋科学, 2000, 24(1): 25–29. |
| [43] | 杨金龙, 王冲, 顾忠旗, 等. 微生物膜对海洋无脊椎动物幼体附着变态的影响研究. 海洋科学, 2012, 36(8): 116–121. |
| [44] | Kirchman D, Graham S, Reish D, et al. Lectins may mediate in the settlement and metamorphosis of Janua (Dexiospira) brasiliensis Grube (Polychaeta: Spirorbidae). Marine Biology Letters, 1982, 3 (3): 131–142. |







