免疫佐剂是通过富集免疫原(如铝胶)、缓释免疫原(如油乳剂)、激活抗原提呈细胞单核吞噬细胞系统递呈抗原(如卡介苗、细菌脂多糖)以及多种综合作用(如不完全弗氏佐剂和完全弗氏佐剂)来实现对免疫原的免疫增强作用[1, 2]。免疫佐剂种类很多,目前国内外尚无统一的分类方法,一般将常用的佐剂分为4类:无机佐剂,如氢氧化铝、明矾等;有机佐剂,微生物及其产物,如分枝杆菌(结核杆菌、卡介苗)、短小杆菌、百日咳杆菌、外毒素、细菌提取物(胞壁酰二肽)等;合成佐剂,如人工合成的双链多聚核苷酸(双链多聚腺苷酸、尿苷酸)、左旋咪唑、异丙肌苷等;油佐剂,如弗氏佐剂、花生油乳化佐剂、矿物油、植物油等[3, 4]。
蛹虫草(Cordyceps militaris)又名北冬虫夏草或北虫草,隶属于子囊菌门、麦角菌科、虫草属的真菌。经研究发现,蛹虫草富含多种功能活性物质,如虫草素、虫草多糖,与冬虫夏草有相似的活性成分和药理作用[5]。蛹虫草可采用蚕蛹、大米、小麦等培养基人工栽培,但栽培后的废基质大都没有得到有效利用,而废基质中的多糖含量约为子实体的2-4倍[6]。大量研究证实蛹虫草子实体多糖具有抗肿瘤、抗氧化、降血糖、能提高免疫力等作用[7]。
本实验以临床实际需要为出发点,将蛹虫草基质多糖配合IBV疫苗的使用,并从外周血淋巴细胞增殖刺激指数、血清抗体水平和攻毒保护试验等指标来评价蛹虫草基质多糖的疫苗佐剂效果,旨在为扩大蛹虫草基质多糖的应用范围提供参考数据。
1 材料与方法 1.1 材料 1.1.1 蛹虫草基质多糖佐剂制备参考文献[8]方法略有改进,蛹虫草废基质粉碎后用石油醚脱脂,60℃干燥至恒重,称取5 g,加入200 mL水,摇匀,再加入2 000 U的纤维素酶2.5 mL,调节pH值到4.8,在50℃水浴1.5 h,再转移到80℃水浴中灭活2 h。然后进行超声波处理,30℃处理40 min,在4 200 r/min离心10 min,收集上清液。将收集到的上清液旋转蒸发到一定体积,采用Sevag法进行除蛋白,采用4倍体积的95%的乙醇进行醇沉,在4℃冰箱中醇沉24 h,抽滤,冷冻干燥得蛹虫草基质多糖。
1.1.2 试验动物和病毒毒株150只1日龄IBV非免疫雏鸡,由江苏省海安县双效种禽有限责任公司孵禽场提供;试验所用的疫苗抗原传染性支气管炎病毒(Infectious bronchitis virus,IBV)H120株和攻毒毒株IBV M41,由江苏省生物教学示范中心保存提供,经9-10日龄SPF鸡胚增殖一代而获得。SPF鸡胚由南京天邦生物科技有限公司提供。
1.1.2 主要试剂淋巴细胞分离液为美国贝克曼库尔特有限公司产品;RPMI1640固体粉状培养基(Gibco公司),根据说明书要求用去离子水配制,然后加入双抗(青、链霉素各100 U/mL),临用前加入10%的小牛血清(赛齐(上海)生物工程有限公司)作为细胞培养生长液;四甲基偶氮唑蓝(MTT,噻唑蓝,Amresco公司)溶液和ConA(Sigma公司),分别配制成5 mg/mL和1 mg/mL的溶液,0.22 μm混合纤维素酯微孔滤膜过滤,分装备用;RNA提取试剂盒TRIzol Regeant购自Invitrogen公司;反转录酶M-MLV为Promega公司产品;DEPC水为北京鼎国昌盛生物技术有限责任公司产品;二甲亚砜(DM-SO)、乙醇、异丙醇和氯仿等其他试剂均为分析纯。
1.2 方法 1.2.1 IB抗原制备及残留毒检测试验所用的疫苗抗原IBV H120和M41株经9-10日龄SPF鸡胚增殖一代而获得。将新收获的IBV H120鸡胚尿囊液(每0.1 mL≥106 EID50)按常规方法用0.1%甲醛灭活24 h,作为疫苗抗原,置4℃冰箱保存备用。取上述灭活病毒液按0.1 mL/枚剂量接种9-10日龄鸡胚,37℃培养,盲传3代,观察接种鸡胚死亡情况,取存活鸡胚尿囊液测定HA效价。
1.2.2 灭活疫苗制备疫苗的制备参考“兽用生物制品规程”[9],将高中低剂量(480、160和80 mg/mL)蛹虫草基质多糖佐剂按1:4的比例与上述灭活病毒液混匀后即成含蛹虫草基质多糖纳米乳佐剂灭活疫苗成品,置4℃冰箱保存备用。阳性对照组为铝胶佐剂疫苗,将50%氢氧化铝胶生理盐水与同样的灭活病毒液按1:4的比例混合,常规方法乳化,保存备用。
1.2.3 疫苗质量与安全检测将配好的灭活疫苗根据现行《中国兽药典》附录[9]进行检验,接种普通琼脂板和血平板,置37℃培养5 d,观察疫苗在2种培养基中是否有细菌生长。同时将灭活疫苗按1 mL/只剂量颈部皮下注射14日龄仔鸡,对照组接种相同剂量灭菌生理盐水。接种后连续观察14 d,观察供试鸡的精神状态以及是否有因接种疫苗引起的局部或全身不良反应。
1.2.4 动物试验设计150只1日龄IBV非免疫雏鸡随机分为5组,每组30只,笼养,自由采食饮水。试验1、2、3组在14和21日龄时分别用105.0 EID50/0.1 mL剂量的灭活疫苗经肌肉注射进行免疫,每只注射0.1 mL;第4组为阳性对照组(铝胶佐剂);第5组为空白对照组(PBS)。
1.2.5 鸡淋巴细胞(PBMC)增殖试验 1.2.5.1 鸡外周血淋巴细胞的制备分别从首免、首免后14、21和28 d从鸡翅静脉无菌取1 mL血液,小心沿侧壁加入到含有4 mL淋巴细胞分离液玻璃离心管中液面上,以2 000 r/min离心15 min;收集上层与淋巴细胞分离液(下层)两相界面上的细胞(白色云雾层),放入新的10 mL玻璃离心管中,并以无菌PBS缓冲液补至总体积8 mL,混匀后,再以2 000 r/min离心10 min;吸去上清液,细胞沉淀经PBS反复洗涤2次,即得所需的外周血淋巴细胞;经活细胞染色计数后,用RPMI-1640完全营养液调节细胞密度至5×106个/mL;按100 μL/孔将细胞悬液加到96孔细胞板中培养备用。
1.2.5.2 淋巴细胞增殖试验淋巴细胞增殖试验按Jiang等[10]的方法稍作调整。将蛹虫草基质多糖疫苗佐剂作为刺激原,每孔加入100 μL,对照孔加入100 μL RPMI-1640完全营养液,阴性对照孔为PBS,阳性对照孔为ConA(终浓度为10 mg/L),各做3个重复孔。37℃下培养44 h后每孔加入40 μL MTT(5 mg/mL),37℃下继续培养4 h。吸弃培养液,每孔加入100 μL DMSO,振荡融解结晶沉淀,在酶标仪上测定OD570 nm值,计算刺激指数(刺激指数SI=刺激孔的OD值/未刺激孔的OD值)。
1.2.6 血清抗体检测分别于14、21和28日龄每组各取10只进行翅静脉采血,分离血清,参考OIE用HI微量法检测接种鸡血清样品中的抗体效价[11]。
1.2.7 攻毒保护试验首免后21 d(35日龄)用1:10稀释的IBV M41株病毒尿囊液对所有试验鸡进行点眼、滴鼻攻毒,0.5 mL/只。攻毒后5 d每组扑杀10只鸡,无菌采集肺脏和肾组织,-70℃保存,待检。继续观察剩余鸡群的临床症状、发病及死亡状况,对死亡鸡进行剖检,观察IBV靶器官组织病理变化。将实验鸡扑杀后采集的病料按1:4加PBS缓冲液研磨成组织悬液,反复冻融3次后,10 000 r/min离心15 min,取上清用0.22 μm微孔滤膜过滤除菌。取0.5 mL滤过液经尿囊腔接种3枚10日龄SPF鸡胚,37℃孵育,弃去24 h内死亡胚,72 h后无菌收集尿囊液,根据TRIzol的说明书要求,从鸡胚尿囊液中提取病毒RNA,应用RT-PCR方法扩增IBV N基因,从而判断IBV病原是否为阳性。
1.2.8 肺脏组织病理检查攻毒后5 d,将所有存活鸡处死,取肺脏和肾组织固定于4%甲醛中,石蜡包埋,常规病理组织切片处理,HE染色检测组织病理变化。
1.3 数据处理与统计分析应用SPSS软件,对数据统计分析,进行ANOVA及Duncan’s多重分析,比较各组差异,P < 0.05表示差异显著。
2 结果 2.1 抗原残留毒和疫苗质量检测0.1%甲醛灭活处理疫苗24 h后,将疫苗抗原接种至9日龄鸡胚,对鸡胚盲传3代后均存活,收集活胚尿囊液进行HA检测发现HA值均为20,表明疫苗抗原经终浓度为0.1%甲醛在37℃恒温作用24 h可完全被灭活。将制备好的灭活疫苗取少量分别在普通琼脂板、血平板上37℃恒温培养连续观察7 d,未见杂菌生长的异况发生;灭活疫苗分别以3 000 r/min离心20 min,疫苗均未出现分层现象,说明疫苗的稳定性达到了实验要求;仔鸡颈部皮下注射疫苗后连续14 d观察,鸡群无因接种疫苗引起的局部或全身不良反应,食欲、精神状态都正常。
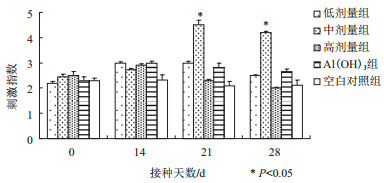
2.2 佐剂蛹虫草基质多糖对鸡PBMC增殖效应MTT法测定佐剂蛹虫草基质多糖对鸡PBMC增殖效果,结果(图 1)显示,蛹虫草基质多糖中剂量组SI值显著比阳性和空白对照组高(P < 0.05)。
|
| 图 1 MTT法测定蛹虫草基质多糖对鸡PBMC增殖效应 |
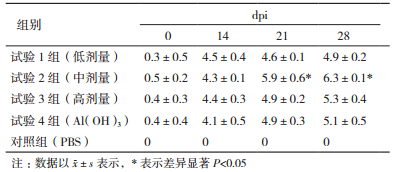
用HI微量法对所采集的免疫鸡群的血清样品进行IBV抗体检测,表 1显示,IBV血清抗体在21和28 dpi时,蛹虫草基质多糖组分别比阳性对照组显著提高了1.0和1.2个滴度(P < 0.05),证明蛹虫草基质多糖对鸡群抗体免疫力具有显著影响。
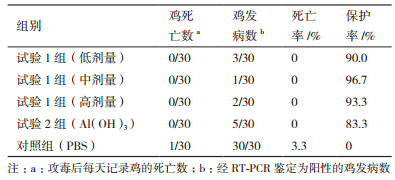
用IBV强毒株对各组仔鸡进行攻毒后,蛹虫草基质多糖低中高剂量组分别有3、1和2只鸡发病,而对照组均出现IBV临诊症状,发病率为16.7%-100%,空白对照组出现1只鸡死亡;多数鸡攻毒48 h后临诊症状开始明显,14 d左右症状消失。病鸡临诊表现为精神沉郁、甩鼻、甩头、气管啰音、尖叫、缩脖、羽毛蓬松、两翅下垂、张口呼吸等症状,有些鸡出现拉稀、采食量和体重明显下降、饮水增多。对照组所有鸡表现为精神沉郁、甩头、气管啰音、尖叫等呼吸道症状,采食量下降。
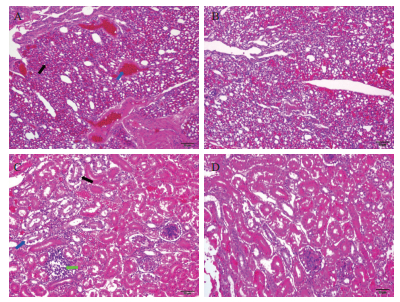
2.5 组织病理学变化攻毒5 d后对照组(PBS)肉鸡肺脏的主要病变是肺间质性炎、小支气管腔内渗出物、小支气管壁周围炎细胞浸润和肺组织充血、出血等病理变化,肾脏的主要病变是肾小管上皮细胞变性坏死和间质性炎。而蛹虫草基质多糖组和Al(OH)3组肺脏和肾则没有明显的病理变化(图 2)。
|
| 图 2 攻毒肉鸡肺脏组织病理学变化 A:攻毒5 d后对照组肺脏组织;B:攻毒5 d后试验组肺脏组织;C:攻毒5 d后对照组肾组织;D:攻毒5 d后试验组肾组织 |
在养殖业健康发展过程中,加强疾病预防一直是重中之重,疫苗接种往往就成为规模化养殖场的必备环节。但是一些养殖场对疫苗的接种时间、接种部位、接种剂量和疫苗质量剂型的把握不完全造成免疫接种效果不理想甚至失败[12]。与此同时,早期的疫苗接种为追求免疫效果,而忽略了疫苗对动物机体的伤害,部分疫苗接种部位肿胀甚至坏死。机体应激反应较多、发热、食欲不振现象时有出现[13]。为了解决传统疫苗存在的一些弊端,多肽疫苗、基因重组疫苗等不断问世,为了避免弱毒疫苗潜在的安全性问题而更倾向于使用灭活疫苗。但这些疫苗由于抗原纯度高、分子量小、免疫原性相对减弱,需要与佐剂共同使用以增强免疫效果[14]。因此佐剂应具有能够增强疫苗抗原的免疫原性,促进细胞免疫和体液免疫,优化免疫应答等基本的特征。
淋巴细胞的增殖反应是衡量动物机体的免疫能力重要指标,也是在探索鸡的免疫功能以及防御机制一个重要出发点。在动物机体对外界产生免疫应答的发生发展过程中,T细胞参与细胞免疫应答,且T细胞的功能和淋巴细胞增殖量的多少直接决定着机体的细胞免疫效果[15]。本实验显示,蛹虫草基质多糖佐剂能够提高淋巴细胞的增殖。先前的研究表明蛹虫草基质多糖,能够保护免疫器官、增加免疫器官重量、增强单核吞噬细胞功能、增强T细胞功能、增强B细胞功能、增强NK细胞功能、增加补体含量和增强补体活性、诱生细胞因子,有效地激发和调节免疫功能[16]。所以,蛹虫草基质多糖体现出增强免疫的免疫佐剂特征。
鸡血液中抗体水平的高低直接关系到鸡的抗病力[17]。一般来讲,抗体的水平越高其抗病能力也就得到加强,这对鸡的成长也十分有利。本实验采用蛹虫草基质多糖佐剂配合疫苗来探索其在疫苗抗体水平中发挥的作用中,蛹虫草基质多糖组显著比阳性对照组高。攻毒试验结果进一步表明了蛹虫草基质多糖佐剂配合疫苗能够使得机体的免疫效力得到提高,保护力强,达到本实验的预期目标。
4 结论160 mg/mL剂量的蛹虫草基质多糖可显著提高鸡淋巴细胞(PBMC)增殖指数和血清抗体效价水平,同时在IBV M41株攻毒试验中,160 mg/mL剂量的蛹虫草基质多糖可显著减轻病毒感染肉仔鸡临床症状,肺和肾无组织病理学变化,免疫保护率达到96.7%。表明了以蛹虫草基质多糖佐剂能够提高肉仔鸡对传染性支气管炎的免疫力。
| [1] | Abd El Rahman S, Winter C, El-Kenawy A, et al. Differential sensitivity of well-differentiated avian respiratory epithelial cells to infection by different strains of infectious bronchitis virus. Journal of Virology, 2010, 84 : 8949–8952. DOI:10.1128/JVI.00463-10 |
| [2] | Autran B, Carcelain G, Combadiere B, et al. Therapeutic vaccines for chronic infections. Science, 2004, 305 : 205–208. DOI:10.1126/science.1100600 |
| [3] | Aghasadeghi MR, Salmani AS, Sadat SM, et al. Application of outer membrane vesicle of Neisseria meningitidis serogroup B as a new adjuvant to induce strongly Th1-oriented responses against HIV-1. Current HIV Research, 2011, 9 : 630–635. DOI:10.2174/157016211798998772 |
| [4] | Degen WG, van Zuilekom HI, Scholtes NC, et al. Potentiation of humoral immune responses to vaccine antigens by recombinant chicken IL-18(rChIL-18). Vaccine, 2005, 23 : 4212–4218. DOI:10.1016/j.vaccine.2005.04.003 |
| [5] | Lee S, Lee HH, Kim J, et al. Anti-tumor effect of Cordyceps militaris in HCV-infected human hepatocarcinoma 7.5 cells. The Journal of Microbiology, 2015, 53 (7): 468–474. DOI:10.1007/s12275-015-5198-x |
| [6] | Lee HH, Lee S, Lee K, et al. Anti-cancer effect of Cordyceps militaris in human colorectal carcinoma RKO cells via cell cycle arrest and mitochondrial apoptosis. DARU Journal of Pharmaceutical Sciences, 2015, 23 : 35. DOI:10.1186/s40199-015-0117-6 |
| [7] | Huang SJ, Lin CP, Mau JL, et al. Effect of UV-B Irradiation on Phys-iologically active substance content and antioxidant properties of the medicinal caterpillar fungus Cordyceps militaris (Ascomycetes). Int J Med Mushrooms, 2015, 17 (3): 241–253. DOI:10.1615/IntJMedMushrooms.v17.i3 |
| [8] | 江海涛, 吴雨龙, 等. 蛹虫草基质多糖对酒精所致小鼠急性肝损伤的保护作用. 食品科学, 2014, 35(13): 223–227. |
| [9] | 中国兽药典委员会. 中华人民共和国兽药典[M]. 北京: 中国农业出版社, 2010. |
| [10] | Jiang W, Jiang P, Li Y, et al. Recombinant adenovirus expressing GP5 and M fusion proteins of porcine reproductive and respiratory syndrome virus induce both humoral and cell-mediated immune responses in mice. Veterinaryimmunology and Immunopathology, 2006, 113 (1-2): 169–180. |
| [11] | Office International des Epizooties (O.I.E.), Manual of standards for diagnostic tests and vaccines[S]. Avian Infectious Bronchitis, 6th edn, 2008: 443-455. |
| [12] | Jawale CV, Lee JH. Characterization of a Salmonella Typhimurium ghost carrying an adjuvant protein as a vaccine candidate for the protection of chickens against virulent challenge. Avian Pathology, 2014, 43 (6): 506–513. DOI:10.1080/03079457.2014.966303 |
| [13] | Ding W, Guo X, Ataku K. Characterization of peptides in ensiled alfalfa treated with different chemical additives. Animal Science Journal, 2013, 84 (12): 774–781. DOI:10.1111/asj.2013.84.issue-12 |
| [14] | Mosmann TR, et al. The expanding universe of T-cell subsets: Th1, Th2 and more. Immunol Today, 1996, 17 (3): 138–146. DOI:10.1016/0167-5699(96)80606-2 |
| [15] | Meir R, Krispel S, Simanov L, et al. Immune responses to mucosal vaccination by the recombinant A1 and N proteins of infectious bronchitis virus. Viral Immunology, 2012, 25 : 55–62. |
| [16] | Lyu K, Wang GC, He YL, et al. Crystal structures of enterovirus 71(EV71) recombinant virus particles provide insights into vaccine design. J Biol Chem, 2015, 290 (6): 3198–3208. DOI:10.1074/jbc.M114.624536 |
| [17] | Ju XH, Xu HJ, Yong YH, et al. Heat stress upregulation of Toll-like receptors 2/4 and acute inflammatory cytokines in peripheral blood mononuclear cell (PBMC) of Bama miniature pigs: an in vivo and in vitro study. Animal, 2014, 8 (9): 1462–1468. DOI:10.1017/S1751731114001268 |