2. 蚌埠94565部队卫生队,蚌埠 233000;
3. 广州大学生命科学学院,广州 510006
2. Bengbu 94565 Troops Medical Corp,Bengbu 233000;
3. College of Life Science,Guangzhou University,Guangzhou 510006
糖尿病是一种常见的内分泌代谢疾病,根据世界卫生组织预测,至2030年时,全球糖尿病患者人数会高达3亿6千多万,其中主要为二型糖尿病(T2DM)患者[1]。我国的糖尿病发病率虽低于某些发达国家,但由于人口基数大,糖尿病患者的人数却居世界之首。因此开发糖尿病相关药物与医疗技术具有重要市场价值与临床意义。
硒是一种重要的矿物质,在改善人类健康状况扮演重要角色[2]。过去,硒多以有机硒的形式作为营养补充剂,辅助治疗癌症。硒本身具有良好的抗氧化作用,是一种良好的癌症治疗剂[3, 4],然而硒酸盐的有效治疗浓度与毒性的界限接近,剂量难以把握[5]。应用纳米技术制造的纳米硒(SeNPs),不仅低毒,有较好的生物相容性,还保持了硒抗氧化、抗菌、抗癌、增强免疫力等作用[6-8]。
多项研究表明糖尿病人血液硒含量较正常人低[9, 10],补硒成为治疗糖尿病的可能选项,但由于毒性问题,在药物开发上进展缓慢。随着对糖尿病发病机理的深入研究,发现氧化应激造成的胰岛β细胞凋亡是二型糖尿病逐年加重的主要病因。适当的补充硒,可加强含硒蛋白的活性[11],如硫氧还蛋白还原酶,其活性的加强可显著降低细胞内的氧化应激(ROS)水平,从而减轻细胞凋亡。另外,无机硒酸盐也可直接激活细胞内的硫氧还蛋白还原酶(TrxR),减低细胞内ROS水平[12]。制备的SeNPs虽然降低了毒性,但SeNPs表面电荷接近零价态,零价态的纳米颗粒很不稳定,容易聚集沉淀[13]。壳聚糖(CS)是一种有效、具有良好缓释性能、生物相容性、生物降解性和抗酶活性的有机多糖[14],已被用来稳定SeNPs。CS修饰SeNPs(CS-SeNPs),表面带有大量正电荷,稳定性大大提高,可在4℃稳定存放数月。这对研究SeNPs的治疗效果及机制十分必要,可方便有效确定药物浓度和保存。本研究在前期利用CS制备均匀、稳定的SeNPs颗粒的基础上,对其稳定性、表面电荷等指标进行鉴定。并针对CS-SeNPs的毒性、抗氧化活性及作用机制做初步研究,以求获得有潜在价值的治疗二型糖尿病新型药物。
1 材料与方法 1.1 材料亚硒酸钠、CS和维生素C(Vc)购于Sigma-Aldrich(美国);RPMI 1640培养基和胎牛血清购买于Gibco公司(美国);MTT购于 R&D公司(美国);DCFH-DA购于碧云天公司(中国);透析袋购于Viskase公司(美国);MGD购于Enzo公司(美国)。
透射电镜(TEM),荷兰Philips公司;扫描电镜(SEM),日本Horiba公司;纳米粒度仪,英国Malvern公司;冷冻离心机,德国Beckmann公司;分光光度计,美国Eppendorf公司;Multiskan FC酶标仪,美国赛默飞公司。
1.2 方法 1.2.1 CS修饰的SeNPs制备配制0.87 mg/mL的亚硒酸钠母液,3.5 mg/mL的Vc母液,0.8 mg/mL的CS母液,在5 mL容量瓶中加入亚硒酸钠母液1 mL,CS母液0.1 mL,涡旋混匀,再逐滴加入1 mL的Vc母液混匀,4℃反应8 h后避光透析,隔8 h换水,再透析48 h[15]。
1.2.2 SeNPs表征鉴定通过电子显微镜和纳米粒度仪对制备好的SeNPs样品进行表征鉴定。TEM观察样品形貌,将样品分散均匀,用铜网蘸取样品,在电镜下观察样品的大小、形貌和均匀性,并拍摄具有代表性的电镜照片,利用SEM观察样品表面形貌。用纳米粒度仪鉴定分析样品的电位及其粒径随时间的变化。不同时间取保存样品,检测粒径,验证其稳定性。
1.2.3 细胞培养胰岛瘤细胞系INS-1购自武汉中科院。RPMI-1640中培养,添加10%FBS胎牛血清,80 mg/mL 青霉素,100 mg/mL链霉素,10 mmol/L HEPES和50 μmol/L的12-巯基乙醇,恒温培养(5% CO2,37℃),细胞在6孔板(4×105个/孔)中铺板,2 d后长满底部用于胰岛素检测和Western blot。在96孔板(1×104 个/孔)中铺板,用于增殖、凋亡检测,培养3 d用于后续实验。
1.2.4 细胞凋亡模型细胞内活性氧的增加,引起的氧化应激是胰岛素抵抗、胰岛β细胞凋亡以及二型糖尿病发展的中心环节。因此使用双氧水处理胰岛β细胞,选择适当的浓度,通过增加细胞内ROS水平调控细胞凋亡,检测药物对胰岛β细胞凋亡的影响。在96孔板中加入双氧水,终浓度分别为0、10、25、50、100、200、1 000 μmol/L,1 h后吸取培养基,MTT法检测细胞活性,最终取大约50%凋亡的H2O2浓度建立细胞凋亡模型。
1.2.5 检测CS-SeNPs抗凋亡活性用双氧水制备细胞的凋亡模型,吸取培养基,加20 μL(10 mg/mL)MTT,孵育4 h,吸出MTT,加100 μL的DMSO,37℃孵育10 min,中间摇动几次,570 nm测吸光度值。
1.2.6 检测ROS水平用DMSO溶解DCFH-DA,配置浓度为4 mmol/L的母液,使用时加入400 μL的KRBB配成溶液。将培养在96孔板的细胞先吸取培养基,加入50 μL的DCFH-DA溶液,37℃孵育30 min。PBS洗涤一次,37℃孵育30 min,以便细胞内DA充分与DCFH断裂。加入药物和双氧水在37℃条件下于10、20、30、40、50和60 min用荧光酶标仪检测,激发波长502 nm,发射波长530 nm。
1.2.7 检测TrxR活性TrxR是细胞内一类主要发挥抗氧化活性的含硒蛋白,多项研究证实硒酸盐可激活TrxR活性,因此我们首先检测了TrxR活性。TrxR催化NADPH将DTNB还原为TNB,通过测定412 nm 波长处TNB的增加量,即可计算TrxR活性。
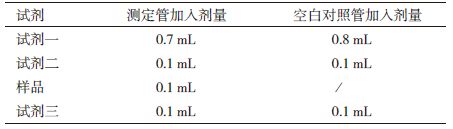
在六孔板中培养细胞到铺满平面,加不同浓度CS-SeNPs处理1 h。随后,每孔细胞加A液1 mL清洗,换1 mL的A液混匀细胞。4℃,1 000 r/min 5 min,去上清。加入150 μL B液裂解细胞,涡旋30 s,冰浴30 min。4℃,13 400 r/min 5 min,取上清到预冷EP管中,冰浴。BCA定量检测蛋白含量,采用TrxR活性检测试剂盒按表 1顺序检测TrxR活性。
混匀后,412 nm处测在0 min和5 min的吸光值,0 min测得为A1,5 min测得为A2。
按下列方程计算TrxR活性:TrxR(U/mg)=(△A测定管-△A空白对照管)/6.75×10÷Cpr×1000。其中,△A=(A2-A1)/5,Cpr:蛋白浓度(mg/mL)。
1.2.8 检测凋亡蛋白Caspase的活性按照1.2.4方法,诱导细胞建模,并分正常细胞组、建模细胞组和建模细胞处理组,建模细胞处理组分CS-SeNPs高浓度(381 nmol/L)组和低浓度(38.1 nmol/L)组。处理好的细胞用PBS 洗涤两次,加入细胞裂解液裂解,4℃ 12 000 r/min 离心15 min,取上清液进行SDS-PAGE,然后用电转法转移至PVDF膜,室温下以5%脱脂奶粉封闭2 h,分别加入Caspase-3、Caspase-9和Caspase-12一抗,4℃孵育过夜,TBST洗涤3次,加入辣根过氧化物酶标记的二抗,室温孵育1 h。TBST洗涤3次。以ECL 化学发光法曝光、显影、定影。
1.2.9 模型鼠实验小鼠种属:BKS.Cg-m +/+ Leprdb 糖尿病模型鼠。饲养条件:小鼠每3 d加满饲料及饮水;环境,SPF级;温度,18-22℃;相对湿度,50%-60%;药物处理分为两组:模型鼠分为模型组、模型治疗治疗组,每组3只,每日下午注射药物1 mg/kg,4周后处死,取胰腺组织进行苏木精-伊红染色法(HE),进行观察。
1.2.10 统计学检测应用SPSS17软件进行统计分析,单组数据间使用t检验,多组数据间使用单因素方差分析,P<0.05为有统计学意义,数据间标记相同字母表示无显著差异,不同字母表示有显著差异。
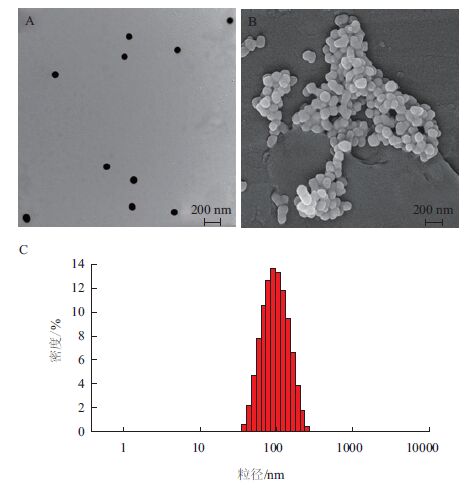
2 结果 2.1 CS-SeNPs表面形貌与粒径分布通过透射电镜、扫描电镜以及纳米粒度仪检测粒径分布的结果。透射电镜(图 1-A)显示,CS-SeNPs分布均匀,形态一致,呈球形,粒径主要分布在90 nm左右。这是由于CS的羟基的作用,CS的羟基键可以和SeO32-反应形成一个稳定的中间化合物,因此CS修饰后的SeNPs形态更加均一稳定。另外,扫描电镜结果(图 1-B)显示,SeNPs被CS均匀的覆盖在外面,CS-SeNPs表面光滑,分布均匀。纳米粒径分布结果(图 1-C)表明,溶液中CS-SeNPs粒径分布均匀,其粒径主要分布在90 nm左右。
|
| 图 1 CS-SeNPs的表征 A:CS-SeNPs透射电镜形貌;B:CS-SeNPs扫描电镜形貌;C:CS-SeNPs粒径分布 |
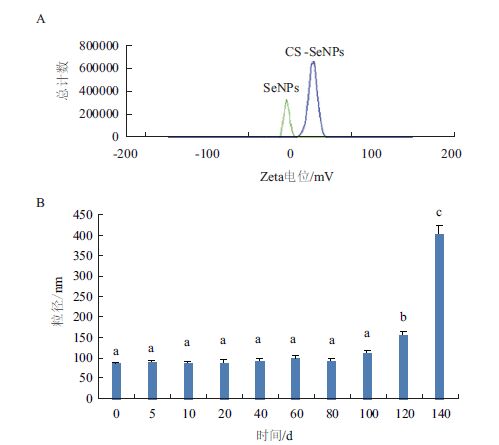
图 2-A显示,SeNPs表面电荷为-3.6 mV,接近零价态,零价态物质一般稳定性差,CS-SeNPs表面电荷增加到24.8 mV,显著增加了纳米颗粒的稳定性。图 2-B显示,CS-SeNPs的粒径在保存时间的初期维持稳定,然后CS-SeNPs的粒径在随后一段时间出现轻微变化,但极少见到沉淀。在第120天的时候BAY-CS-SeNPs的粒径迅速上升,且在第140天出现大量沉淀。CS-SeNPs在保存初期,由于表面负载大量高电荷CS,粒径保持稳定。在第100天以后,由于CS的降解,SeNPs表面负载的CS逐渐减少,SeNPs开始发生聚合,从而导致粒径迅速增大,出现沉淀浑浊。高稳定性的CS-SeNPs为其以后在生物医药中的应用奠定良好的基础。
|
| 图 2 CS-SeNPs的表面电位(A)和稳定性(B) A:SeNPs和CS-SeNPs的表面电荷;B:4℃保存条件下CS-SeNPs粒径的变化 |
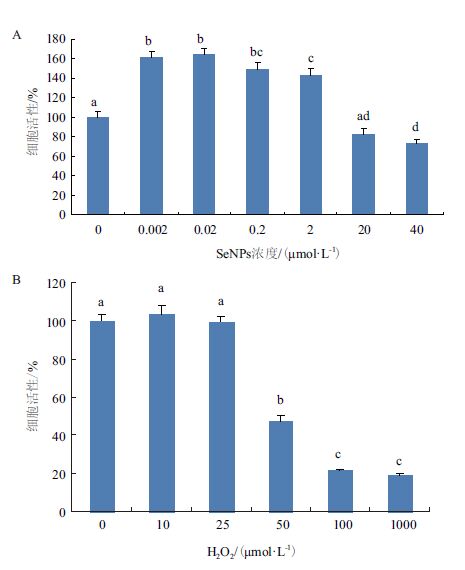
由于SeNPs在高浓度时具有毒性,所以用梯度浓度CS-SeNPs孵育细胞,检测细胞活性,确定CS-SeNPs的毒性范围。按照逐渐递增的浓度梯度(0.002、0.02、0.2、2、20、40 μmol/L)检测CS-SeNPs对INS-1细胞的毒性,结果(图 3-A)显示在浓度达到20 μmol/L时,CS-SeNPs的毒性发挥主要作用,开始促进细胞凋亡;在浓度达到40 μmol/L时细胞活性减少到正常对照组的72.41%,显著小于对照,而CS-SeNPs在浓度小于2 μmol/L时,INS-1细胞增殖约50%。实验结果表明,低浓度的CS-SeNPs具有显著的促进细胞增殖活性,高浓度的CS-SeNPs抑制细胞增殖,对细胞有毒性,故选择CS-SeNPs浓度低于2 μmol/L进行后续实验。
|
| 图 3 CS-SeNPs的毒性与凋亡模型的建立 A:CS-SeNPs对INS-1细胞的毒性;B:双氧水建立的细胞凋亡模型 |
用双氧水建立INS-1细胞的凋亡模型,用不同浓度的H2O2(10、25、50、100和1 000 μmol/L)处理细胞后,检测这5个浓度状态下的细胞活性。如图 3-B所示,50 μmol/L H2O2使细胞活性降低了47.61%,故在后续的实验中采用50 μmol/L的双氧水建立INS-1细胞凋亡模型。
2.4 CS-SeNPs抗凋亡活性及胞内氧化应激水平ROS如图 4-A所示,38.1 nmol/L的CS-SeNPs处理的细胞与模型对照组相比细胞活性提高31.75%,表明CS-SeNPs具有抗凋亡的活性。T2DM发展过程中,ROS水平的提高是引起胰岛β细胞凋亡的主要原因。图 4-B显示在CS-SeNPs处理50 min后,显著抑制双氧水引起的细胞ROS水平上升,表明CS-SeNPs能有效降低细胞内的ROS。
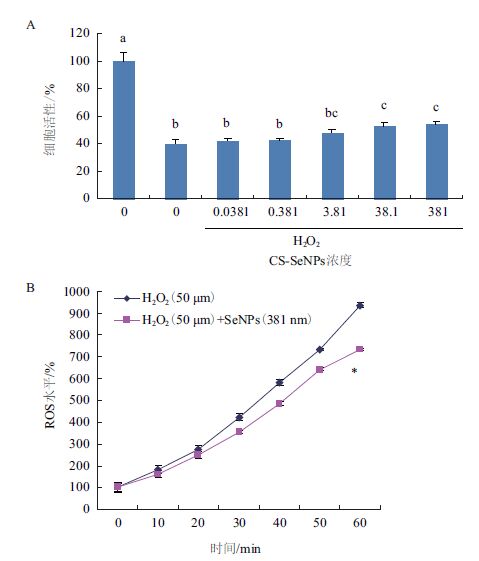
|
| 图 4 CS-SeNPs的抗凋亡作用 A:不同浓度CS-SeNPs抗胰岛β细胞凋亡;B:CS-SeNPs对双氧水引起的细胞内ROS水平的影响 |
已有文献显示抗氧化蛋白TrxR通过还原Trx发挥降低细胞内ROS水平的作用,无机硒具有激活细胞内抗氧化蛋白TrxR的作用,因此有必要检测TrxR的活性。图 5-A显示,CS-SeNPs在38.1 nmol/L的时候显著激活细胞内的TrxR活性。为了验证TrxR所发挥的作用,本研究使用了TrxR的抑制剂MGD。图 5-B显示,CS-SeNPs可以显著抑制ROS引起的细胞凋亡,加入MGD能抑制CS-SeNPs的抗凋亡作用,MGD是TrxR的抑制剂,这说明CS-SeNPs通过激活细胞内TrxR活性发挥抗凋亡作用。
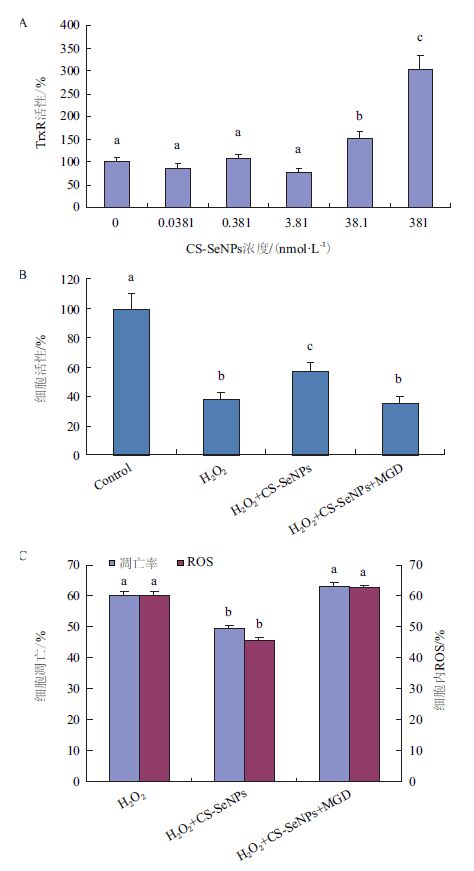
|
| 图 5 CS-SeNPs抗细胞凋亡的机制 A:不同浓度CS-SeNPs对TrxR活性的影响;B:TrxR抑制剂MGD对CS-SeNPs抗凋亡活性的影响;C:MGD对胞内氧化应激水平和凋亡率的影响 |
图 5-C显示,H2O2能使细胞内ROS水平升高,同时使细胞凋亡率升高;而CS-SeNPs可降低细胞内ROS水平,同时降低细胞凋亡率;MGD在抑制了CS-SeNPs的抗凋亡作用同时,也抑制了CS-SeNPs对胞内ROS的降低作用,而MGD是TrxR的抑制剂,说明CS-SeNPs是通过激活细胞内TrxR活性,降低细胞内ROS水平发挥抗INS-1细胞凋亡作用。
2.6 CS-SeNPs对细胞凋亡蛋白活性的影响已有文献[16-18]显示,在发生氧化应激过程中,会激活细胞内的凋亡蛋白caspase 3、caspase 9、caspase 12,从而启动凋亡过程。通过对caspase 3、caspase 9、caspase 12三种凋亡蛋白激活片段caspase 3(17 kD)、caspase 9(37 kD)、caspase 12(36 kD)的检测,验证CS-SeNPs对caspase激活的抑制作用。图 6显示,抵抗模型细胞caspase活性显著增高,而经药物处理CS-SeNPs 1(38.1 nmol/L)和CS-SeNPs 2(381 nmol/L),显著抑制caspase的激活,进一步验证CS-SeNPs的抗凋亡活性。
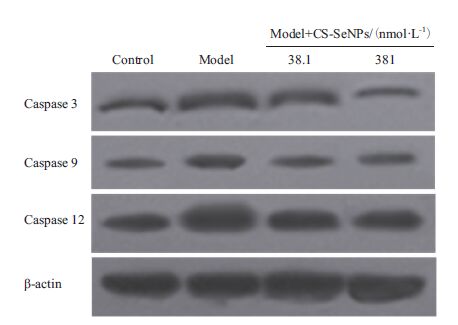
|
| 图 6 CS-SeNPs对细胞凋亡蛋白活性的影响 |
图 7为糖尿病模型小鼠治疗4周后胰腺HE染色结果。如图 7-A所示二型糖尿病模型组,胰腺细胞胞质较少,胰岛增大,细胞核出现固缩坏死样,颜色加深,散乱的分布于胰岛中,且有不同程度的空泡样变。具有外分泌功能的腺泡细胞可见变性和坏死。图 7-B为CS-SeNPs治疗组,胰岛边缘较清晰,胰岛细胞核有少量变形,细胞分布较均匀,细胞结构较完整,胞浆较丰富,病症较模型组明显减轻。
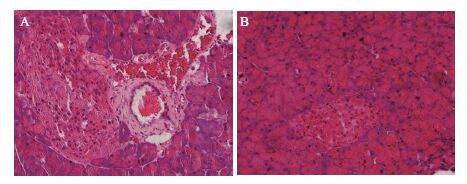
|
| 图 7 胰岛组织HE染色结果 A:糖尿病模型组;B:CS-SeNPs用药组 |
目前已有多种方法可用于制备SeNPs,包括气相蒸发凝聚法、无外源调控液剂相法、有外源调控剂液相法。其中有外源调控剂液相法,通过还原剂的选择、陈化条件及时间的调整,可有效调控纳米粒子形貌。在此基础上,通过在制备的纳米粒子表面连接不同材料,可增加纳米粒子的溶解性、吸附性,还可以通过静电吸附、共价偶联等方式连接蛋白、化学药物,改善药物的药代动力学特性。本课题组主要目的在于在SeNPs表面覆盖CS,由于CS自带大量正电荷,大大提高SeNPs表面电荷水平,进而提高纳米粒子稳定性。通过对还原剂浓度、陈化条件的调整,制备了粒径均匀,高表面电荷CS-SeNPs颗粒,经检测,稳定保存时间可达3个月,为后续实验提供了稳定的药品来源。
已有文献报道,我们人体内存在许多还原性的含硒酶类,这些酶可有效降低细胞内的ROS水平,而它们的活性与体内硒浓度息息相关,补充硒酸盐可以增加这些酶的活性。而无机硒酸盐可直接激活TrxR[12],所以本课题组的研究方向就放在了对TrxR的激活上。前文提到SeNPs的生物学活性主要在于降低了毒性,有利于成为药物,通过检测我们选择了一个远低于毒性剂量的CS-SeNPs浓度。通过对含硒蛋白活性的检测,发现CS-SeNPs可有效激活细胞内TrxR的活性,进而降低细胞内的ROS水平,发挥抗凋亡活性。在糖尿病领域,从长期来看,由于细胞ROS水平升高造成的胰岛β细胞凋亡是二型糖尿病发展的主要病因,在周围组织以及肝脏等器官,由于脂肪的胞内积累、高糖高脂外环境,以及高糖高脂诱发的炎症都会升高胞内的ROS水平。因此降低细胞ROS水平,对于延缓糖尿病进程,以及辅助常规药物治疗二型糖尿病保护胰岛β细胞功能以及保护周围组织方面将具有良好的应用前景。
在糖尿病药物研究中,往往关注药物在及时改善疾病指标中的作用。然而像糖尿病这样一类慢性病,尤其是发生了胰岛素抵抗,比较严重的患者,短期的治疗可以迅速改善某些疾病指标,但难以迅速从根本上扭转相关组织的器质性病变。如果想彻底治愈糖尿病,扭转相关组织的器质性病变,恢复其响应人体信号功能,减轻胰岛素抵抗十分重要。简单刺激胰岛细胞分泌胰岛素或促进周围组织吸收葡萄糖,增强病态细胞功能有可能对细胞造成新的损伤,在治疗时应考虑保护细胞,减少细胞凋亡,增加细胞活性作为药物治疗的辅助措施。SeNPs具有保护细胞避免凋亡的活性作用,具有潜在的长期的治疗价值。保护组织细胞避免凋亡,恢复其正常体内信号响应,扭转相关组织的器质性病变相关药物有可能成为以后药物研发的热点。
4 结论相对于硒酸盐,CS-SeNPs具有显著的高效低毒特点,初步解决了毒性问题,并且能通过激活TrxR降低胞内ROS抑制凋亡蛋白的激活,有效降低胰岛β细胞凋亡,具有成为二型糖尿病治疗药物的潜力。
| [1] | MacFarlane WM, Chapman JC, Shepherd RM, et al. Engineering a glucose-responsive human insulin-secreting cell line from islets of Langerhans isolated from a patient with persistent hyperinsulinemic hypoglycemia of infancy. Journal of Biological Chemistry , 1999, 274 (48) : 34059–66. DOI:10.1074/jbc.274.48.34059 |
| [2] | Rayman MP. The importance of selenium to human health. The Lancet , 2000, 356 (9225) : 233–241. DOI:10.1016/S0140-6736(00)02490-9 |
| [3] | Gao X, Z hang J, Zhang L. Hollow sphere selenium nanoparticles:their in-vitro antihydroxyl radical effect. Advanced Materials , 2002, 14 (4) : 290. DOI:10.1002/(ISSN)1521-4095 |
| [4] | Gates B, Mayers B, Cattle B, et al. Synthesis and characterization of uniform nanowires of trigonal selenium. Advanced Functional Materials , 2002, 12 (3) : 219. DOI:10.1002/1616-3028(200203)12:3<219::AID-ADFM219>3.0.CO;2-U |
| [5] | Wang H, Zhang J, Yu H. Elemental selenium at nano size possesses lower toxicity without compromising the fundamental effect on seleno enzymes:comparison with selenomethionine in mice. Free Radical Biology and Medicine , 2007, 42 (10) : 1524–1533. DOI:10.1016/j.freeradbiomed.2007.02.013 |
| [6] | Tran PA, Webster TJ. Selenium nanoparticles inhibit Staphylococcus aureus growth. Int J Nanomedicine , 2011, 6 : 1553. |
| [7] | Li YH, Li XL, Wong YS, et al. The reversal of cisplatin-induced nephrotoxicity by selenium nanoparticles functionalized with 11-mercapto-1-undecanol by inhibition of ROS-mediated apoptosis. Biomaterials , 2011, 32 (34) : 9068–9076. DOI:10.1016/j.biomaterials.2011.08.001 |
| [8] | Torres S, Campos V, León C, et al. Biosynthesis of selenium nanoparticles by Pantoea agglomerans and their antioxidant activity. Journal of Nanoparticle Research , 2012, 14 (11) : 1–9. |
| [9] | Navarro-Alarcon M, López-G dela Serrana H, Perez-Valero V. Serum and urine selenium concentrations as indicators of body status in patients with diabetes mellitus. Science of the Total Environment , 1999, 228 (1) : 79–85. DOI:10.1016/S0048-9697(99)00034-0 |
| [10] | Kljai K, Runje R. Selenium and glycogen levels in diabetic patients. Biol Trace Elem Res , 2001, 83 (3) : 223–229. DOI:10.1385/BTER:83:3 |
| [11] | Brown K, Pickard K, Nicol F, et al. Effects of organic and inorganic selenium supplementation on selenoenzyme activity in blood lymphoctyes, granulocytes, platelets and erythrocytes. Clinical Science , 2000, 98 (5) : 593–599. DOI:10.1042/cs0980593 |
| [12] | Steinbrenner H, Sies H. Protection against reactive oxygen species by selenoproteins. Biochimica et Biophysica Acta(BBA)-General Subjects , 2009, 1790 (11) : 1478–1485. DOI:10.1016/j.bbagen.2009.02.014 |
| [13] | RajalakshmiM, AroraA. Optical properties of selenium nanopart-icles dispersed in polymer. Solid State Communications , 1999, 110 (2) : 75–80. |
| [14] | Prabaharan M. Review paper:chitosan derivatives as promising materials for controlled drug delivery. Journal of Biomaterials Applications , 2008, 23 (1) : 5–36. DOI:10.1177/0885328208091562 |
| [15] | Yu B, Z hang Y, Z heng W, et al. Positive surface charge enhances selective cellular uptake and anticancer efficacy of selenium nanoparticles. Inorg Chem , 2012, 51 (16) : 8956–63. DOI:10.1021/ic301050v |
| [16] | Karaskov E, Scott C, Zhang L, et al. Chronic palmitate but not oleate exposure induces endoplasmic reticulum stress, which may contribute to INS-1 pancreatic cell apoptosis. Endocrinology , 2006, 147 : 3398–3407. DOI:10.1210/en.2005-1494 |
| [17] | Cunha DA, Hekerman P, Ladriere L, et al. Initiation and execution of lipotoxic ER stress in pancreatic--cells. Journal of Cell Science , 2008, 121 : 2308–2318. DOI:10.1242/jcs.026062 |
| [18] | Eizirik DL, Cardozo AK, Cnop M, et al. The role for endo-plasmicreticulum stress in diabetes mellitus. Endocrine Reviews , 2008, 29 (1) : 42–61. DOI:10.1210/er.2007-0015 |