谷胱甘肽(GSH)是一种含γ2谷氨酰基和巯基的生物活性三肽类化合物,在蛋白质和DNA的合成、氨基酸的转运、细胞的保护等重要的生物学现象中起着直接或间接作用。酶法合成谷胱甘肽是以L-谷氨酸、L-半胱氨酸、甘氨酸为底物,在谷氨酰半胱氨酸合成酶(酶A)、谷胱甘肽合成酶(酶B)、乙酰磷酸激酶的催化作用下合成。但在生产上未纯化过的游离酶的使用导致生产后期杂质较多,分离纯化工艺复杂,同时由于游离酶的一次性使用,导致生产成本居高不下。相比游离酶,固定化酶具有存储稳定性高、分离回收容易、可多次重复使用的优点,能够使得生产过程简化,生产效率得到提高。目前对于谷胱甘肽的固定化酶生产,国内外的文献报道相对较少,日本的Murata等[1]最早将酿酒酵母固定在聚丙烯酰胺凝胶中,利用酿酒酵母自身的糖酵解途径作为ATP再生系统进行GSH的生物合成,国内很多学者也利用酵母细胞的糖酵解系统产生ATP进行GSH的合成[2];李华钟、陈坚等[3]将酵母菌的糖酵解酶系与重组大肠杆菌的谷胱甘肽合成酶系共固定化于改进的聚乙烯醇(PVA)-卡拉胶混合载体;赵旭东等[4]将酵母细胞固定化,再与GSH合成酶合成GSH,最终GSH产量为0.91 g/L,转化率为14.9%。华东理工大学沈立新等[5]分别以卡拉胶、明胶、海藻酸钠包埋E. coli BL21(pTrc-gsh)细胞催化合成谷胱甘肽GSH。南昌大学谢雷波等[6]提出了κ-卡拉胶与魔芋粉混合载体固定化微生物细胞进行生物合成谷胱甘肽的研究。总体来说,关于固定化酶生产GSH的报道较少,已报道的固定化细胞或酶都存在机械强度低,传质阻力大,酶活不高等问题,不适于工业化生产。同时上述的很多文献都提到利用酵母菌的糖酵解系统产生ATP来解决酶法生产的成本问题。但这种耦合体系中ADP的积累往往会抑制GSH合成酶的活性,造成GSH产率低下。
交联酶聚集体(Cross-linked enzyme aggregates,CLEAs)是一种无需活性载体的加入而直接将不同形式的酶用交联剂进行交联进而制得固定化酶的技术。该固定化技术对酶纯度要求不高,酶的负载量高,操作简便,成本低,很有可能发展成为从宏观角度提高酶选择性及催化活性的修饰手段,是一种极具开发前景的固定化方法。交联酶聚集体已经应用于手性化合物拆分[7]、有机合成[8, 9]、药物中间体合成[10]、生物柴油[11]及生物传感器领域,还可用于医疗蛋白的释放、化妆品和洗涤剂,工业废物、污染水的环境治理等。现阶段,已经有数十种酶如酰基转移酶、葡萄糖异构酶、脂肪酶[12-14]、蛋白酶等的CLEAs已实现商品化。共固定CLEAs(Co-immobilized in CLEAs,combi-CLEAs)是将多个酶聚集在一起,形成多种酶复合的CLEAs,从而实现多步反应一步催化,减少了单元操作数和反应器体积。Mateo[15]将光学选择性为S型的醇腈酶和无选择性的腈水解酶共沉淀制备出复合 CLEAs,该复合CLEAs能够利用苯甲醛和氰化物合成S-扁桃酸。López-Serrano等[16]将7种不同的商业脂肪酶共固定合成一种CLEAs,其酶活相对原始酶提高了超过10倍。Timo等[17]将PepX、PepN两种X-脯氨酰二肽酰氨肽酶1∶1加入进行CLEAs制备时,两个酶的酶活均达到最高。Taboada-Puig等[18]将Bjerkandera adusta过氧化物酶(VP)与Bjerkandera adusta(GOD)葡萄糖氧化酶进行共固定制备VP-GOD-CLEAs的酶活回收率为89%,而单独VP-CLEAs的酶活回收率只有67%,此联合CLEAs对H2O2表现出更高的耐受性,同时在葡萄糖添加的情况下,VP的酶活更高。Jung[19]将淀粉蔗糖酶AS、麦芽寡糖基海藻糖水解酶(MTS)、糖基海藻糖水解酶(MTH)被共同交联在一起,制备成联合CLEAs,进而达到一步生物转化蔗糖为海藻糖的目的,3种酶的比例分别为8∶0.5∶0.5(AS 4 mg∶MTS 0.25 mg∶MTH 0.25 mg),此联合CLEAs在使用5批后酶活无任何损失,但由于其存在不易分离回收的缺点,导致影响其工业化应用及重复使用。
基于以上研究背景,本实验室通过基因改造手段强化gshA的表达,弱化gshB及ackA的表达,有效解决了产物积累对gshA的酶活抑制,构建了谷胱甘肽合成酶产生菌E.coli-gshA-gshB-ackA。在此基础上,本研究着重考察此多酶体系的CLEAs的制备及条件优化,旨在解决谷胱甘肽项目杂质及成本问题。
1 材料与方法 1.1 材料谷胱甘肽合成酶产生菌E.coli-gshA-gshB-ackA(gshA为谷氨酰半胱氨酸合成酶、gshB为谷胱甘肽合成酶、ackA为乙酰磷酸激酶)保藏于浙江海正药业股份有限公司中央研究院酶工程研究所,菌种编号pEL915,通过基因改造3个酶的表达比例约为10∶3∶1。
PEI-600、PEI-10000、PEI-70000(阿拉丁试剂),BSA(上海生工)、BSA水溶液(thermo公司),50%戊二醛(北京百灵威科技有限公司),(NH4)2SO4、甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、吐温-20、SDS、TritonX-100、蔗糖、葡糖糖、Lys、D-山梨醇、可溶性淀粉、吐温-80、琼脂糖、Na2HPO4·12H2O、NaH2PO4·2H2O及其他试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 方法 1.2.1 酶液制备 1.2.1.1 培养基种子培养基:酵母抽提物5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH7.0。发酵培养基:酵母膏4 g/L,蛋白胨8 g/L,甘油10 g/L,KH2PO4 5 g/L,(NH4)2SO4 4 g/L,MgSO4·7H2O 1 g/L,pH7.2。
1.2.1.2 酶液制备将培养后的工程菌915进行10 000 r/min离心收集菌体,-20℃冷冻储存,根据实验所需取出适量进行重悬,均质机破碎得到酶液。
1.2.2 沉淀条件研究 1.2.2.1 沉淀剂的选择分别选取(NH4)2SO4、甲醇、乙醇、异丙醇、丙酮、乙酸乙酯共6种沉淀剂进行沉淀,其中,(NH4)2SO4选取30%、40%、50%、60%、70%和80%饱和度对酶液进行沉淀,其余试剂均选用体积比20%、30%、40%、50%、60%、70%和80%对酶液进行沉淀。
1.2.2.2 沉淀速度对酶活回收率的影响考察一次性加入和缓慢加入对酶活回收率的影响。
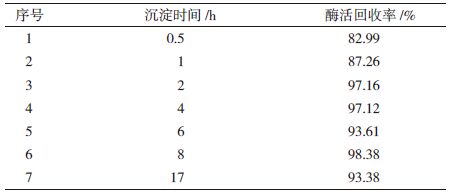
1.2.2.3 沉淀时间对酶活回收率的影响分别考察不同的沉淀时间(0.5、1、2、4、6、8和17 h)对酶活回收率的影响。
1.2.3 交联条件的摸索 1.2.3.1 戊二醛浓度对酶活的影响考察不同戊二醛终浓度(0.1%、0.25%、0.5%、1%、1.5%、2%、2.5%、3%、4%、5%和7.5%)对酶活回收率的影响。
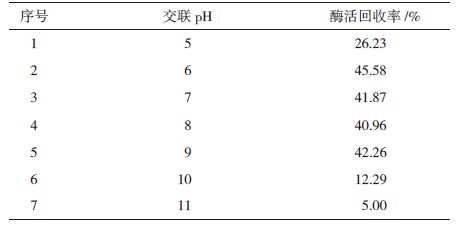
1.2.3.2 交联pH对酶活回收率影响考察不同交联pH(5、6、7、8、9、10和11)对酶活回收率的影响。
1.2.3.3 交联时间长短对酶活的影响考察不同交联时间(0.5、1、2、3、4、5、6、7、8和9 h)对酶活回收率的影响。
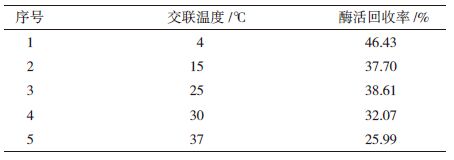
1.2.3.4 交联温度对酶活的影响考察不同温度(4℃、15℃、25℃、30℃和37℃)条件下交联对酶活回收率的影响。
1.2.4 蛋白浓度对酶活回收率的影响考察不同酶液蛋白浓度(51.07、40.8、30.6、20.4、10.2、5.1和2.5 g/L)及不同戊二醛浓度(0.25%、0.5%、0.75%、1%和1.25%)对CLEAs制备及酶活的影响。
1.2.5 添加剂对CLEAs制备及酶活的影响考察在戊二醛浓度为0.25%及0.5%时,终浓度为1 g/L的各种添加剂对CLEAs酶活的影响。酶液浓度为30 g/L,先将添加剂加入到破胞酶液中,充分混匀后进行冷室4℃过夜沉淀,隔天进行20℃,220 r/min条件下交联反应,交联1 h后取2 mL进行离心收集CLEAs,用0.1 mol/L pH7.0磷酸盐缓冲液洗涤2遍,最终收集到的CLEAs进行酶活检测。
1.2.6 酶活力测定经优化确定转化体系酶活检测方法为:在10 mL转化体系中,各底物浓度分别为半胱甘酸60 mmol/L、甘氨酸180 mmol/L、谷氨酸钠180 mmol/L、七水氯化镁40 mmol/L、乙酰磷酸二锂盐(ACP)180 mmol/L、ATP 1 mmol/L、磷酸缓冲液(磷酸氢二钾100 mmol/L)。按上述浓度将半胱氨酸、甘氨酸、谷氨酸钠、七水氯化镁、ACP、K2HPO4配置成母液,pH调至7.2,ATP配置200 mmol/L的母液,在100 mL转化瓶中称取0.5 g CLEAs或者50 μL蛋白酶液,加入上述母液9.90 mL,混合均匀,30℃恒温摇床预热10 min,最后加入50 μL ATP母液,30℃,150 r/min震荡,开始计时,0.5 h后取样进行GSH含量检测。酶活定义:在检测条件下,每分钟催化生成 1 mol GSH所需的酶量为 1 U。
1.2.7 CLEAs的收集方法采用离心法进行CLEAs的收集,收集条件为6 000 r/min离心12 min,0.1 mol/L pH7.0磷酸盐缓冲液洗涤2遍,最终收集到的CLEAs,4℃冰箱放置备用。
1.2.8 蛋白质含量测定采用考马斯亮蓝法测定。
1.2.9 蛋白质沉淀率测定蛋白质沉淀率/%=(1 -a1/a2)×100%,式中:a1为固定化后酶液剩余蛋白质含量;a2为固定化前酶液的蛋白质含量。
1.2.10 CLEAs酶活回收率测定酶活回收率/%=固定化酶酶活力/固定化前游离酶酶活力×100%
1.2.11 CLEAs催化合成GSH 1.2.11.1 使用批次使用0.5%戊二醛浓度条件下分别添加了BSA及PEI 600为添加剂制备得到的CLEAs连续反应12批次,测定各次转化反应的酶活力,以第1次反应酶活力为100%,分别计算相对酶活力,同时继续进行GSH转化合成实验,考察最终生成GSH的产量。
1.2.11.2 储藏稳定性将制备好的CLEAs储藏在4℃冰箱中,隔段时间取出进行酶活检测。
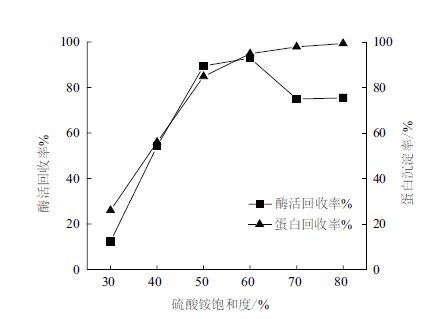
2 结果 2.1 沉淀条件研究 2.1.1 沉淀剂的选择硫酸铵对915产酶的沉淀效果影响(图 1)显示,当硫酸铵为60%饱和度时,蛋白沉淀率为94.9%,酶活回收率为93%,具有较好的酶活回收率及蛋白沉淀率。
|
| 图 1 硫酸铵饱和度对915产酶的沉淀效果影响 |
如图 2所示,各种有机溶剂对915产酶进行沉淀,在有机溶剂体积比为40%以上时,蛋白沉淀率均能达到90%以上,但所有实验的有机溶剂的酶活回收率均较低,几乎均在10%以下。因此,对比硫酸铵及各种有机溶剂对蛋白的沉淀效果,最终确定以硫酸铵作为CLEAs制备的蛋白沉淀剂。
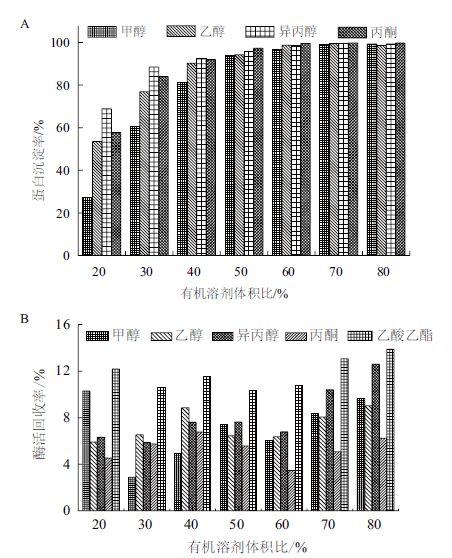
|
| 图 2 有机溶剂对915产酶蛋白沉淀率(A)及酶活回收率(B)的影响 |
一次性投入时酶活回收率为77.7%,缓慢投入时酶活回收率为78.4%,二者相差无几,由此说明以硫酸铵为沉淀剂的蛋白沉淀过程相比用其它有机溶剂为沉淀剂时,沉淀过程相对比较温和,对酶活的损失较小,硫酸铵投入的速度对酶活影响较小。
2.1.3 沉淀时间长短对酶活回收率的影响如表 1所示,在沉淀时间2 h以内,随着沉淀时间的延长,酶活回收率逐渐提高,但是2 h以后,沉淀时间长短对酶活回收率的影响较小。
如图 3所示,最适的戊二醛浓度为0.25%,此时的酶活回收率为29.68%,随着戊二醛浓度的进一步增大,CLEAs的酶活呈线性快速下降,至1%浓度时,CLEAs的酶活近乎为0。
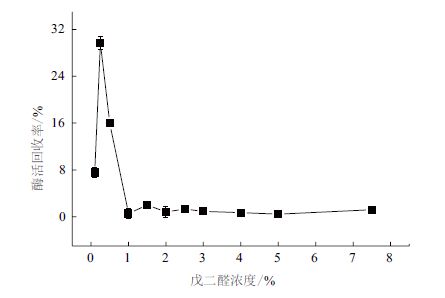
|
| 图 3 戊二醛浓度对酶活回收率的影响 |
如表 2所示,最适的交联pH为6.0,酶活回收率为45.6%,同时发现在pH6.0-9.0范围内酶活回收率差别较小。
结果(图 4)显示,0.25%和0.5%戊二醛浓度下,交联时间对酶活影响较小,酶活回收率主要与戊二醛浓度有关。

|
| 图 4 0.25%及0.5%戊二醛条件下交联时间对酶活的影响 |
结果(表 3)显示,较低温度更利于CLEAs酶活的保留,4℃最适交联温度,酶活回收率为46.43%。与此同时发现不同温度条件下交联得到的CLEAs颜色有较大差别。
实验结果(图 5)显示,在相同交联剂存在的条件下,较高浓度的酶溶液制备得到的CLEAs的酶活回收率较高,而低浓度酶液即使在很低浓度戊二醛条件下制备的CLEAs的酶活回收率也很低。蛋白浓度在>20.4 g/L以上时,在0.25%戊二醛浓度条件下交联得到的CLEAs的酶活回收率在53%以上。由此得出,酶液的蛋白浓度是影响CLEAs酶活的一个非常重要的因素。由于均质破胞时菌悬液浓度不宜过高,故后期选定蛋白浓度为30 g/L的酶液进行CLEAs的后续研究。
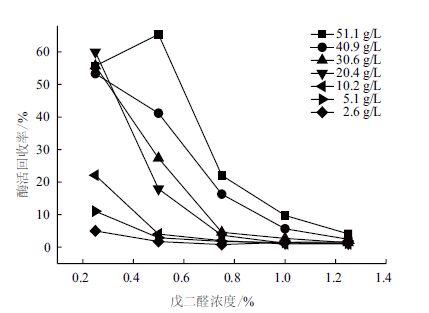
|
| 图 5 蛋白浓度及戊二醛浓度对CLEAs酶活回收率的影响 |
如图 6所示,在0.5%戊二醛条件下,对一系列添加剂进行初筛,1 g/L添加剂对CLEAs的酶活有明显促进作用的是SDS、BSA、Lys及PEI-600。
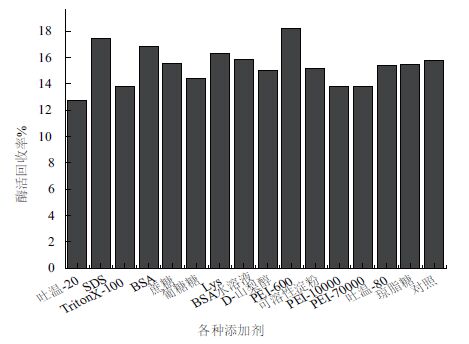
|
| 图 6 各种添加剂对CLEAs酶活的影响(初筛) |
分别在0.25%及0.5%戊二醛浓度条件下,对SDS、BSA、Lys及PEI-600的相对最适浓度进行进一步摸索。结果(图 7)显示,在0.25%戊二醛浓度条件下,除了PEI(添加剂w∶酶液蛋白w=1∶20)对酶活有相对较明显的促进作用外,其余添加剂的作用均不明显;而在0.5%戊二醛条件下,BSA及PEI-600对CLEAs酶活均有很明显的促进作用,BSA在添加剂w∶酶液蛋白w=1∶1时对酶活的促进作用最明显,酶活回收率达到54.2%;PEI 600在添加剂w∶酶液蛋白w=1∶5时对酶活的促进作用最明显,酶活回收率达到50.7%。
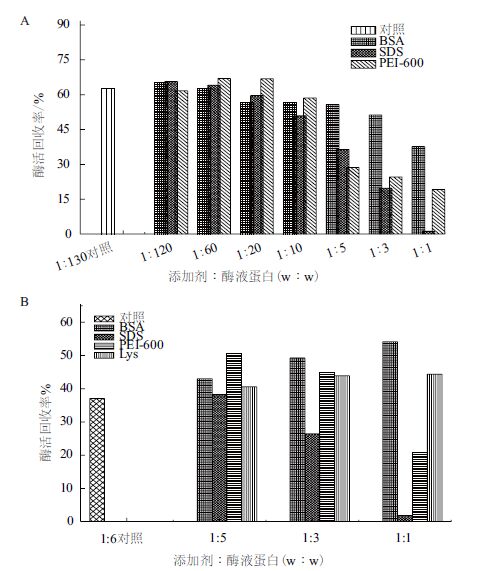
|
| 图 7 0.25%(A)及0.5%(B)戊二醛条件下添加剂对CLEAs酶活复筛 |
在0.25%及0.5%戊二醛条件下,分别继续对上述复筛结果中各最适添加剂浓度进行进一步验证。结果(图 8)显示,在0.25%及0.5%戊二醛条件下,BSA及PEI 600对CLEAs酶活均有很明显的促进作用。在0.25%戊二醛浓度条件下,BSA在添加剂w∶酶液蛋白w=1∶120时酶活回收率达到57.7%,单位CLEAs的酶活为5.9 U/g;PEI 600在添加剂w∶酶液蛋白w=1∶20时酶活回收率达到64.2%,单位CLEAs的酶活为6.1 U/g,分别相比对照组的54%及4.9 U/g提高了3.7%、1 U/g及10.2%、1.2 U/g;在0.5%戊二醛浓度条件下,BSA在添加剂w∶酶液蛋白w=1∶1时酶活回收率达到50.2%,单位CLEAs的酶活为4.0 U/g;PEI 600在添加剂w∶酶液蛋白w=1∶5时酶活回收率达到48.2%,单位CLEAs的酶活为4.9 U/g,分别相比对照组的28.7%及2.57 U/g提高了21.5%、1.43 U/g及19.5%、2.33 U/g。

|
| 图 8 0.25%(A)及0.5%(B)戊二醛条件下添加剂对CLEAs酶活复筛 各种添加剂适宜浓度下进一步复筛 |
分别以添加BSA与PEI 600制备得到的CLEAs聚集体进行批次转化实验。如图 9-A所示,以BSA为添加剂时,GSH最高产量达10.78 g/L,转化率为58.6%,在转化第12批次时GSH产量为7.5 g/L,相对酶活力为69.7%,转化率为40.8%;如图 9-B所示,在以PEI 600为添加剂时,GSH最高产量达11.26 g/L,转化率为61.2%,在转化第12批次时GSH产量为9.03 g/L,相对酶活力为78.4%,转化率为50.2%。
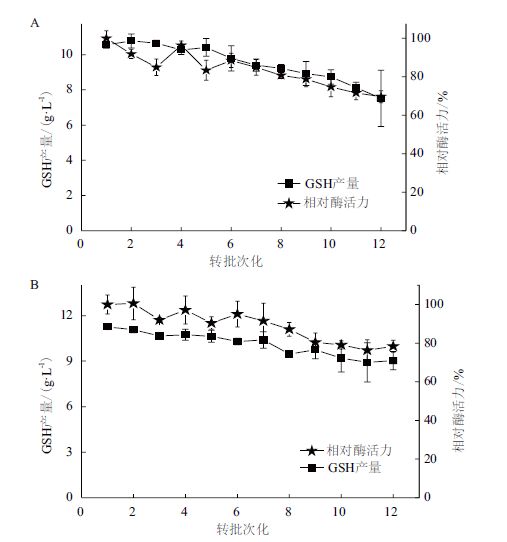
|
| 图 9 转化批次考察 A:BSA(添加剂w∶酶液蛋白w=1∶1);B:PEI 600(添加剂w∶酶液蛋白w=1∶5) |
考察了在0.5%戊二醛条件下,添加了PEI 600(添加剂w∶酶液蛋白w=1∶5)制备得到的CLEAs在4℃条件下的储藏稳定性。结果(图 10)显示,在储藏33 d时间内,CLEAs催化GSH合成时,GSH的产量最大达到了12.1 g/L,转化率为65.9%,储藏33 d以后,GSH的产量为10.56 g/L,转化率为57.4%,具有良好的储藏稳定性。
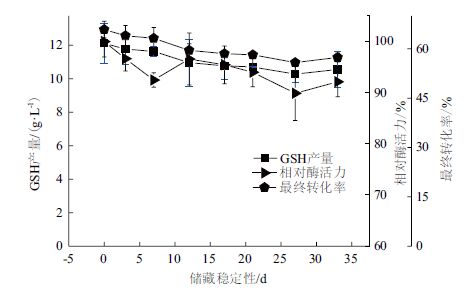
|
| 图 10 储藏稳定性考察 |
在交联酶聚集体的制备中,酶聚集体的形成是保持酶活性最关键的步骤。聚集体中酶分子之间以次级键相互作用,在水溶液中会出现解聚。酶聚集体的活性大小、紧密程度、均匀性等特性都可通过选择不同的沉淀剂、控制沉淀剂的浓度、添加速度、搅拌速度及溶液系统的体积大小、溶液的pH、温度等来调节。Schoevaart等[20]采用14种沉淀剂对12种脂肪酶酶蛋白进行沉淀,发现不同的沉淀剂对同一种酶的沉淀效果差异显著,其提出酶的沉淀过程存在着酶分子聚集与变性的竞争。Dong等[21]也提出高沉淀剂浓度导致聚集成为主导,而低沉淀剂浓度则导致变性成为主导。本研究选取了硫酸铵、甲醇、乙醇、异丙醇、丙酮、乙酸乙酯6种文献普遍报道的沉淀剂对谷胱甘肽合成酶系进行沉淀,结果发现,当硫酸铵浓度达到60%饱和度时,蛋白沉淀率为94.9%,酶活回收率为93%,具有较好的酶活回收率及蛋白沉淀率,而其他几种沉淀剂虽然随着浓度的增加,酶活沉淀率几乎趋近于100%,但是酶活损失巨大,几乎都只有10%左右的酶活残留率。与此同时,我们也考察了硫酸铵的加入方式及沉淀时间的长短,结果发现整个沉淀过程对酶活的损失较小,甚至硫酸铵对酶活还起到了一定的保护作用,因为之前有实验发现均质处理过的酶液在4℃条件下极易失活,而以硫酸铵沉淀处理后的酶液在较长时间仍存在较高的酶活,酶活回收率较高。
交联步骤是制备出高活性及高稳定性的交联酶聚集体的关键步骤。Cabiro等[22]在制备Linum usitatissimum的交联酶聚集体时,发现在使用硫酸铵作为沉淀剂时,沉淀后活性保留80%以上,然而当交联之后,只保留其游离酶活性的20%,由此可见交联步骤对酶活的损失之大。常用作交联剂的有甲醛、乙醛、戊二醛、葡聚糖多醛、环氧基交联剂、戊二醛结构类似物(二甘醇、高碘酸氧化的糖类[23]),本研究选取通用的戊二醛作为交联剂,结果发现当戊二醛浓度为0.25%时,此时50 mL酶液收集到的CLEAs的湿重只有11.69 g,酶活回收率为29.68%达到最高,随着戊二醛浓度的逐步提高,收集到的CLEAs的湿重逐步增加,但是总的酶活回收率反而迅速下降。这可能是由于戊二醛浓度过低导致交联不充分,未交联的聚集酶在后续洗涤过程中因为复溶而流失,同时酶固定的不够牢固,导致最终收集到的CLEAs湿重较低,而戊二醛浓度过高又导致与酶活性相关的胺基也发生交联,损害了CLEAs的活性,同时使得形成的CLEAs结构更加紧密,增加了传质阻力,从而降低了CLEAs的表观酶活力。在此次实验中,虽然戊二醛浓度在0.25%时,酶活回收率达到最大,但是可能由于交联不充分,导致交联酶颗粒很小,过滤收集的方式导致CLEAs的回收十分困难。因此在后续考察添加剂使用时,均在0.25%及0.5%戊二醛浓度条件下同时进行。另外,本研究也考察了交联温度对CLEAs酶活回收率的影响,结果发现较低的温度更有利于CLEAs酶活的保留,4℃是最适的交联温度,其酶活回收率为46.43%,与江南大学杨绪娥[24]、北京大学张晶晶等[25]发现在交联过程中,温度是影响CLEAs制备的重要因素,随温度升高,相对酶活力逐渐降低的报道一致。
许多文献报道,酶与非离子聚合物、蛋白添加剂、底物类似物等共沉淀能增加酶稳定性,或者提高酶活力。这可能是由于它们能诱导酶分子处于活性状态,然后这种状态被随后的操作“固定”下来;也有可能是它们一直保护着酶蛋白的三级结构;或者是提供更多的氨基与戊二醛进行交联反应,特别是对于目的蛋白中所含赖氨酸残基比例较少的酶的CLEAs的制备具有非常明显的效果。在之前交联实验过程中,我们发现使用0.25%终浓度的戊二醛得到的CLEAs的酶活回收率只有29.68%,而我们的酶系中包含3种酶,是以3种酶共同参与反应生成的终产物GSH进行的酶活计算,由此,只要其中一种酶或几种酶对戊二醛非常敏感,极易与戊二醛反应导致酶失活,从而使得最终的酶活回收率很低,对此我们考察在CLEAs制备过程中加入添加剂等方式来对目的蛋白进行一定程度的保护作用。Hormigo等[26]添加BSA制备了聚-3-羟基丁酸酯(PHB)解聚酶的CLEAs,PhaZSex-CLEAs的尺寸平均为50-300 μm,在重复使用20批后,酶活均没有损失,表现出更好的温度及pH稳定性,具有更高的有机溶剂耐受性。Tükel等[27]添加了BSA的过氧化氢酶CLEAs的热稳定性及储藏稳定性均优于游离酶,同时在连续使用400批后,其仍保留50%的酶活。Vaidya等[28]将L-氨基酰化酶与PEI共固定制备的CLEAs(AP-CLEA),其酶活及稳定性较未加均有所提高。Saxena等[29]在制备交联嗜热绒毛菌聚集体的过程中添加SDS及TritonX-100,活性均得到了不同程度的提高。天津大学王梦凡等[30]制备Thermomyces lanuginosa脂肪酶CLEAs时沉淀过程添加了SDS,酶活提高2倍,青霉素-G-酰基转移酶制备CLEAs时加入葡萄糖、蔗糖及海藻糖,其酶活要高于没有使用糖作为稳定剂的,同时具有更高的热稳定性[31]。江南大学的杨雪等[32]在制备Lipozyme CLEAs的过程中添加D-山梨醇与PEG600共沉淀,得到的CLEAs具有较高的催化活性。本研究选取了大量的添加剂进行考察,结果发现在0.5%戊二醛条件下,PEI 600及BSA对CLEAs保持较高酶活及酶活回收率具有明显的促进作用,BSA 在添加剂w∶酶液蛋白w=1∶1时酶活回收率达到50.2%,单位CLEAs的酶活为4.0 U/g;PEI 600在添加剂w∶酶液蛋白w=1∶5时酶活回收率达到48.2%,单位CLEAs的酶活为4.9 U/g,分别相比对照组的28.7%及2.57 U/g提高了21.5%,1.43 U/g及19.5%、2.33 U/g。由于添加PEI 600后单位CLEAs的酶活明显高于未添加及添加了BSA的,最终选取PEI 600(添加剂w∶酶液蛋白w=1∶5)为最适的添加剂。
最后也对制备得到的CLEAs的酶活稳定性及使用批次进行了考察,在4℃条件下放置33 d后,GSH的产量为10.56 g/L,相对酶活力为92.12%,同时在反应12批次后,其酶活仍保留78.4%。但是目前应用仍受到很大局限,CLEAs的颗粒尺寸是影响其工业化应用的一个非常关键的因素。文献报道CLEAs的颗粒尺寸通常是小于10 μm[33, 34],粒径这个关键因素可能在一定程度上限制了其在非均相化合物反应中的分离。除了离心和过滤外,很难从反应体系中将CLEAs分离及回收,而离心或过滤常常可能导致CLEAs凝结成块,不易再次均匀分散在反应体系中,造成利用效率低下。目前有许多关于避免CLEAs颗粒尺寸小的弊端的新方法报道,如与载体连用[35],使用氨基功能磁性纳米粒子[36-38]等,后期我们也将重点根据工业化生产需求改造CLEAs的颗粒尺寸。
4 结论通过优化沉淀条件,交联条件,蛋白浓度及添加剂的使用,最终得到最优的制备方法为:在4℃,30 g/L蛋白浓度条件下,加入PEI-600(添加剂w∶酶液蛋白w=1∶5)与酶液进行充分混合,然后加入60%饱和度硫酸铵沉淀4 h,最后以0.5%戊二醛进行交联。最终蛋白沉淀率为94.9%,酶活回收率为48.2%,单位CLEAs的酶活为4.9 U/g,分别相比对照组的28.7%及2.57 U/g提高了19.5%、2.33 U/g,GSH最高产量达到11.26 g/L,转化率为61.2%,在转化第12批次时GSH产量为9.03 g/L,相对酶活力为78.4%,4℃条件下储藏33 d后相对酶活力为92.12%。
| [1] | Murata K, Tani K, Kato J, et al. Glycolytic pathway as an ATP generation system and its application to the production of glutathione and NADP. Enzyme Microb Technol , 1981, 3 (2) : 233–242. |
| [2] | 李寅, 陈坚, 毛英鹰, 等. 重组大肠杆菌生产谷胱甘肽发酵条件的研究. 微生物学报 , 1999, 9 (4) : 355–361. |
| [3] | 童群义, 陈坚, 堵国成, 等. PVA-卡拉胶混合载体固定化大肠杆菌-酵母菌混合体系生产谷胱甘肽. 工业微生物 , 2000, 30 (4) : 1–5. |
| [4] | 赵旭东, 魏东芝, 俞俊棠. 固定化酵母细胞生物合成谷肽甘肽的研究. 华东理工大学学报 , 2000, 16 (1) : 29–32. |
| [5] | 沈立新, 魏东芝, 张嗣良, 等. 固定化E. coli BL21(ptrc-gsh)细胞催化合成谷胱甘肽[J]. 华东理工大学学报, 2002, 28(1):24-27. |
| [6] | 谢雷波, 段学辉, 王锦, 等. 卡拉胶与魔芋粉混合载体固定酵母细胞生物合成谷胱甘肽. 南昌大学学报 , 2006, 28 (1) : 19–22. |
| [7] | Kumar S, Mohan U, Kamble AL, et al. Cross-linked enzyme aggregates of recombinant Pseudomonas putid anitrilase for enanfioselective mtnle hydrolysis. Bioresource Technology , 2010, 101 (17) : 86–98. |
| [8] | Rajendhran J, Gunasekaran P. Recent biotechnological interventions for developing improved penicillin G acylases. Journal of Bioscience and Bioengineering , 2004, 97 : 1–13. DOI:10.1016/S1389-1723(04)70157-7 |
| [9] | Wilson L, Zamorano F, Aguirre C, et al. A Carrier-bound and earner-free penicillin acylases as catalysts for cephalexin synthesis in aqueous medium. J Biotechnol , 2007, 131 (2) : 74. |
| [10] | Cabana H, Jones JP, Agathos SN. Preparation and characterization of cross-linked laccase aggregates and their application to the elimination of endocrine disrupting chemicals. Journal of Biotechnology , 2007, 132 : 23–31. DOI:10.1016/j.jbiotec.2007.07.948 |
| [11] | Shah S, Sharma A, Gupta MN. Preparation of cross-linked enzyme aggregates by using bovine serum albumin as a protetc feeder. Analytical Biochemistry , 2006, 351 (2) : 207–213. DOI:10.1016/j.ab.2006.01.028 |
| [12] | Xu DY, Yang Z. Cross-linked tyrosinase aggregates for elimination of phenolic compounds from wastewater. Chemosphere , 2013, 92 (4) : 391–398. DOI:10.1016/j.chemosphere.2012.12.076 |
| [13] | Zhao L, Zheng L, Gao G, et al. Resolution of N(2-ethyl-6-methylphenyl)alanine via cross-linked aggregates of Pseudomonas sp. Lipase[J]. J Mol Catal B:Enzym, 2008, 54:7-12. |
| [14] | Kartal F, Janssen MH, Hollmann F, et al. Improved esterification activity of Candida rugosa lipase in organic solvent by immobilization as Cross-linked enzyme aggregates(CLEAs). Journal of Molecular Catalysis B:Enzymatic , 2011, 71 : 85–94. DOI:10.1016/j.molcatb.2011.04.002 |
| [15] | Mateo C, Chmura A, Rustler S, et al. Synthesis of enantiomerically pure S-mandelic acid using an oxynitrilase-nitrilase bienzymatic cascade:a nitrilase surprisingly shows nitrile hydratase activity. Tetrahedron:Asymmetry , 2006, 17 : 320–323. DOI:10.1016/j.tetasy.2006.01.020 |
| [16] | Lopez-Serrano P, Cao L, Van Rantwijk F, et al. Cross-linked enzyme aggregates with enhanced activity:application to lipases. Biotechnology Letters , 2002, 24 : 79–83. |
| [17] | Stressler T, Ewert J, Eisele T, et al. Cross-linked enzyme aggregates(CLEAs)of PepX and PepN-production, partial characterization and application of combi-CLEAs for milk protein hydrolysis. Biocatalysis and Agricultural Biotechnology , 2015, 4 : 752–760. DOI:10.1016/j.bcab.2015.11.002 |
| [18] | Taboada-Puig R, Junghanns C, Demarche P, et al. Combined cross-linked enzyme aggregates from versatile peroxidase and glucose oxidase:production, partial characterization and application for the elimination of endocrine disruptors. Bioresource Technology , 2011, 102 : 93–102. |
| [19] | Jung DH, Jung JH, Seo DH, et al. One-pot bioconversion of sucrose to trehalose using enzymatic sequential reactions in combined cross-linked enzyme aggregates. Bioresource Technology , 2013, 130 : 801–804. DOI:10.1016/j.biortech.2012.12.162 |
| [20] | Schoevaart R, Wolbers M, Golubovic M, et al. Preparation, optimization, and structures of cross-linked enzyme aggregates(CLEAs). Biotechnol Bioeng , 2004, 87 : 54–62. DOI:10.1002/(ISSN)1097-0290 |
| [21] | Dong T, Zhao L, Huang Y, Tan X. Preparation of cross-linked aggregates of aminoacylase from Aspergillus melleus by using bovine serum albumin as an inert additive. Bioresource Technology , 2010, 101 : 69–71. |
| [22] | Cabirol FL, Tan PL, Tay B, et al. Linum usitatissimum hydroxynitrile lyase cross-linked enzyme aggregates:A recyclable enantioselective catalyst. Advanced Synthesis & Catalysis , 2008, 350 : 29–38. |
| [23] | Shamraja S, Abhijeet B, Mayur R, et al. LadoleMacromolecular cross-linked enzyme aggregates(M-CLEAs)of a-amylase. Int J Biol Macromol , 2016, 84 : 69–78. DOI:10.1016/j.ijbiomac.2015.11.082 |
| [24] | 杨绪娥. 固定化脂肪酶合成蔗糖-6-乙酸酯的研究[D]. 无锡:江南大学, 2012. |
| [25] | 张晶晶. 交联脂肪酶聚集体(CLEAs)的制备及其粒径影响因素研究[D]. 北京:北京化工大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10010-1012415079.htm |
| [26] | Hormigo D, García-Hidalgo J, Acebal C, et al. Preparation and cha-racterization of cross-linked enzyme aggregates(CLEAs)of reco-mbinant poly-3-hydroxybutyrate depolymerase from Streptomyces exfoliatus. Bioresour Technol , 2012, 115 : 177–182. |
| [27] | Tükel SS, Hürrem F, Yildirim D, et al. Preparation of crosslinked enzyme aggregates(CLEA)of catalase and its characterization. Journal of Molecular Catalysis B:Enzymatic , 2013, 97 : 252–257. |
| [28] | Vaidya BK, Kuwar SS, Golegaonkar SB, et al. Preparation of cross-linked enzyme aggregates of l-aminoacylase via co-aggregation with polyethyleneimine. Journal of Molecular Catalysis B:Enzymatic , 2012, 74 : 184–191. DOI:10.1016/j.molcatb.2011.10.003 |
| [29] | Gupta P, Dutt K, Misra S, et al. Characterization of cross-linked immobilized lipase from thermophilic mould Thermomyces lanuginosa using glutaraldehyde. Bioresource Technology , 2009, 100 : 74–80. DOI:10.1016/j.biortech.2008.05.024 |
| [30] | Wang M, Qi W, Yu Q, et al. Cross-linking enzyme aggregates in the macropores of silica gel:A practical and efficient method for enzyme stabilization. Biochemical Engineering Journal , 2010, 52 : 168–174. DOI:10.1016/j.bej.2010.08.003 |
| [31] | Wang M, Qi W, Jia C, et al. Enhancement of activity of cross-linked enzyme aggregates by a sugar-assisted precipitation strategy:Technical development and molecular mechanism. Journal of Biotechnology , 2011, 56 : 30–38. |
| [32] | Yang X, Zheng P, Ni Y, et al. Highly efficient biosynthesis of sucrose-6-acetate with cross-linked aggregates of Lipozyme TL 100 L. Journal of Biotechnology , 2012, 161 (1) : 27–33. DOI:10.1016/j.jbiotec.2012.05.014 |
| [33] | Sheldon RA, Schoevaart R, Lange LMV. Cross-linked enzyme aggregates(CLEAs):A novel and versatile method for enzyme immobilization(a review). Biocatalysis and Biotransformation , 2009, 23 (3-4) : 141–147. |
| [34] | CaoL. Immobilised enzymes:science or art?. Current Opinion in Chemical Biology , 2005, 9 (2) : 217–226. |
| [35] | Kim MI, Kim J, Lee J, et al. One-dimensional crosslinked enzyme aggregates in SBA-15:Superior catalytic behavior to conventional enzyme immobilization. Microporous and Mesoporous Materials , 2008, 111 (1) : 18–23. |
| [36] | Talekar S, Ghodake V, Ghotage T, et al. Novel magnetic cross-linked enzyme aggregates(magnetic CLEAs)of alpha amylase. Bioresource Technology , 2012, 123 (3) : 542–547. |
| [37] | Liu LL, Cen Y, Liu F, et al. Analysis of -amylase inhibitor from corni fructus by coupling magnetic cross-linked enzyme aggregates of -amylase with HPLC-MS. Journal of Chromatography B , 2015, 995-996 : 64–69. DOI:10.1016/j.jchromb.2015.05.016 |
| [38] | Zhang WW, Yang XL, Jia JQ. Surfactant-activated magnetic cross-linked enzyme aggregates(magnetic CLEAs)of Thermomyces lanuginosus lipase for biodiesel production. Journal of Molecular Catalysis B:Enzymatic , 2015, 115 : 83–89. DOI:10.1016/j.molcatb.2015.02.003 |