谷胱甘肽(glutathione,GSH)是胞内含量最丰富的硫醇类化合物,普遍存在于哺乳动物、植物、酵母及原核生物中,是由L-谷氨酸(L-Glu)、L-半胱氨酸(L-Cys)、甘氨酸(Gly)组成的三肽[1]。GSH的生物学意义主要归功于其半胱氨酸残基上的巯基,因而具有独特的氧化还原能力和亲和属性[2]。生物体蛋白质及DNA的合成以及细胞周期调控均离不开GSH的参与。同时,GSH还与细胞耐热性、外分泌、生长维持、调节氧化还原平衡、解毒及半胱氨酸的储存和运输有关[3-6]。这种三肽还能调节基因表达、细胞凋亡、信号转导及内外源分子的膜运输,对维持胞内稳态具有重要作用[7]。
GSH已经广泛应用于制药、食品及化妆品行业,市场上对GSH的需求与日俱增。微生物发酵法生产GSH因其低成本、小污染、高密度、条件温和等特点而备受青睐,但胞内高浓度的GSH积累造成的对关键合成酶的竞争抑制以及胞内毒性是GSH高产及产业化的两大瓶颈[8, 9]。双功能酶基因gshF的发现解决了产物的抑制问题,GshF同时具有谷氨酰半胱氨酸合成酶(γ-GCS)及谷胱甘肽合成酶(GS)活性,对GSH不敏感,在生产上具有极大潜力,在生产宿主中过表达gshF后,GSH的生产得到促进,且检测不到发酵中间物γ-谷氨酰半胱氨酸的存在[10]。当GSH合成酶的活力问题得到解决,高浓度GSH的胞内毒性问题就显得非常突出。
利用微生物发酵法生产时,GSH的合成主要发生在胞内,而GSH在胞内主要以还原型多肽形式存在,产物积累过多会扰乱氧化还原平衡,对菌体生长及代谢带来严重影响,引起代谢控制阻遏产物积累,甚至导致细胞自溶[8]。因此将GSH由胞内转运到胞外不仅是降低其胞内积累的有效手段,而且也是提高产量的重要方法之一。同时,在GSH的下游提取过程中,因其为胞内产物,要获得纯品就需先将其从细胞中提取出来,主要采用提取工艺中破碎法,但因释放出GSH时会附带出杂质成分如蛋白质、核酸、氨基酸等细胞组分以及细胞碎片,使得分离过程耗时耗力、成本增加,如果GSH被细胞主动转运到胞外,能节省不必要的工序、简化工艺[11]。此外,GSH在胞内的平衡浓度及其生理功能也与其运输有关[12],因此对GSH运输蛋白的研究至关重要。
关于原核生物的GSH运输蛋白,国外研究多有报道。Pittman等[13]确定了原核生物第一个GSH运输系统即CydDC复合物,该复合物为膜运输蛋白,运输过程需要ATP参与。CydDC作为大肠杆菌异质二聚体ABC(ATP-binding cassette-type transporter)型运输系统,最初发现于E. coli细胞色素bd型末端氧化酶的装配过程中;1993年发现其为ABC运输蛋白[14];2002年,证明cysteine经CydDC进入翻转膜泡,最后被运出细胞质达到壁膜间隙[15];2005年证明该运输蛋白能运输GSH到周质中。CydDC对还原型GSH有高亲和力,但对氧化型及GSH结合物亲和力低,故运输GSH而不运输GSSG。专利中也实现了CydDC的表达[16]。
为降低胞内产物积累、减少生产阻遏及胞内毒性进而提高产量,本文重点研究目的蛋白CydDC的表达对产GSH重组大肠杆菌胞外GSH浓度的影响,以期促进GSH的生产。
1 材料与方法 1.1 材料 1.1.1 菌株及质粒本研究所使用的菌株及质粒如表 1所示。
GSH标准品购自Sigma公司;氯霉素、氨苄青霉素购自上海捷倍思基因技术有限公司;质粒小提试剂盒、DNA胶回收试剂盒购自上海生工生物工程有限公司;Taq DNA Polymerase、2×Taq PCR MasterMix、Hind Ⅲ、PrimeSTAR HS(Premix)购自天根生化科技有限公司。
1.1.2.2 培养基Luria-Bertani液体培养基:Tryptone 10 g/L,Yeast Extract 5 g/L,NaCl 10 g/L,121℃灭菌20 min。Luria-Bertani固体培养基:上述液体培养基中加入1.6 g/L琼脂粉,121℃灭菌20 min。摇瓶培养基:含5 g/L glucose的50 mL Luria-Bertani液体培养基,葡萄糖与Luria-Bertani分开灭菌,葡萄糖115℃灭菌20 min。培养基中添加合适的抗生素:氯霉素34 mg/L,氨苄青霉素50 mg/L。
1.2 方法 1.2.1 实验方法 1.2.1.1 重组质粒构建重组质粒pBAD33-cydDC构建过程,如图 1,根据载体pBAD33设计引物,使PCR扩增出的目的片段cydDC两端带有载体的同源臂,cydDC上游引物序列含20 bp载体同源臂,序列为:5'-ACCTGCAGGCATGCAAGCTTGAGGAGGACAG-CTATGAATAAATCTCGTCAAAA-3'(下划线部分为Hind Ⅲ酶切位点,斜体部分为核糖体结合位点);下游引物序列包含载体酶切位点Hind Ⅲ右侧20 bp同源臂,序列为:5'-CCGCCAAAACAGCCAAGCTTTTACAAACCCTGCTTGAACT-3'。PCR获得目的片段后,利用ClonEXpressTMⅡ试剂盒将cydDC片段与经Hind Ⅲ酶切后线性化的质粒pBAD33进行同源重组,37℃反应30 min进行连接,再将连接后得到的重组质粒转化MG1655感受态细胞,经氯霉素筛选出抗性重组菌。取质粒pBAD33多克隆位点两侧各20 bp序列作为验证引物,其中上游引物序列为:5'-GCTCTTCTCGCTAACCAAAC-3',下游引物序列为:5'-GTTCACCGACAAACAACAGAT-3',对重组菌进行PCR验证,并且抽提质粒送上海生工进行测序验证。
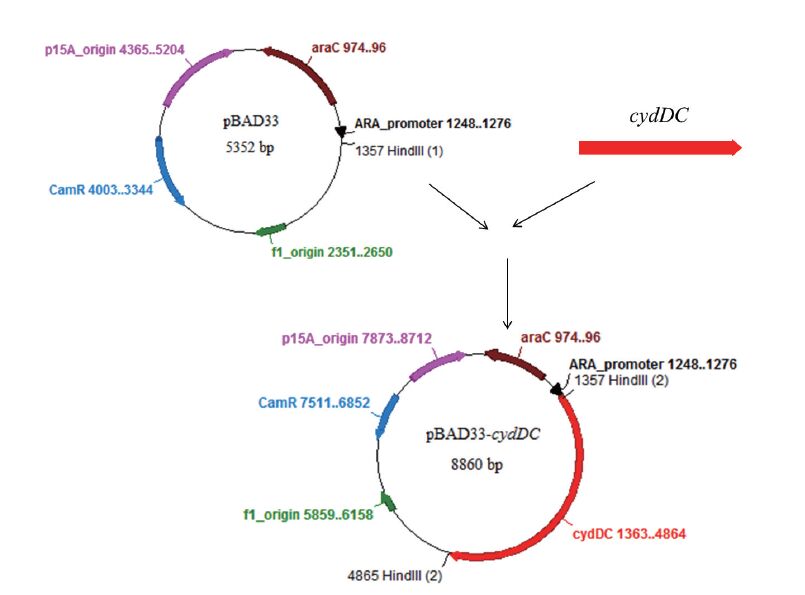
|
| 图 1 质粒pBAD33-cydDC构建图 |
利用氯化钙转化法将重组质粒pTrc99a-as转入大肠杆菌MG1655(pBAD33-cydDC),过夜培养,经含有氨苄青霉素及氯霉素的平板筛选,挑取单菌落,保种并进行PCR验证,待PCR验证后进行蛋白电泳。
1.2.1.3 培养重组菌于装有3 mL Luria-Bertani液体培养基试管中复苏,放于37℃、220 r/min摇床培养9 h,转接摇瓶培养基,菌浓OD600=0.5时加入0.5 mmol/L IPTG及50 mmol/L阿拉伯糖诱导,并按时取样,时间点为2.5、5和8.5 h,检测发酵液及上清液中GSH的产量并计算其胞外含量。
1.2.2 分析方法 1.2.2.1 菌体密度测定菌体培养过程中,用可见光分光光度计在600 nm检测菌液的吸光值。
1.2.2.2 GSH的测定样品经三氯乙酸TCA处理20 min后,4℃、12 000 r/min离心10 min,上清液稀释10倍后经0.22 μm膜过滤处理方可进样。液相条件:C18柱(4.6×150 mmol/L),流动相A为含0.01 mol/L庚烷磺酸钠和0.05 mol/L磷酸二氢钾的溶液(磷酸调pH3.0),流动相B为甲醇;液相检测时流动相为95%的A和5%的B的混合液,流速1.0 mL/min,紫外检测器波长为210 nm,柱温30℃。
1.2.2.3 电泳分析核酸电泳缓冲液及蛋白电泳缓冲液、染色、脱色液的配制参见《分子克隆》。
2 结果 2.1 重组菌MG1655(pBAD33-cydDC)的构建根据图 1构建的重组质粒pBAD33-cydDC的PCR验证结果,见图 2。以空质粒pBAD33为模板,验证引物进行PCR扩增,只能得到长度不足100 bp的产物,而以重组质粒为模板时,PCR产物长度为3 500 bp,测序结果正确,表明重组质粒构建成功并顺利获得重组菌MG1655(pBAD33-cydDC)。
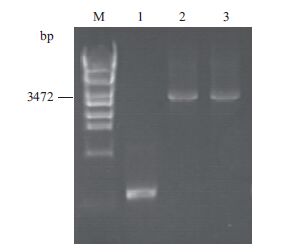
|
| 图 2 重组质粒pBAD33-cydDC的PCR验证 M:λ-Eco T14 digest DNA marker;1:MG1655(pBAD33);2,3:MG1655(pBAD33-cydDC) |
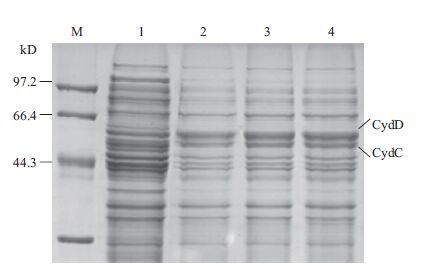
|
| 图 3 重组菌cydDC基因的表达 M:小分子量蛋白Marker;1:MG1655(pBAD33);2-4:MG1655(pBAD33-cydDC) |
重组菌株MG1655(pBAD33-cydDC)经阿拉伯糖诱导后,进行SDS-PAGE电泳,电泳结果如图 3所示。文献报道中的CydDC两亚基理论大小为61、59 kD[4],图中实验组可见两条清晰区带,与对照组相比,蛋白条带亮度增加,且大小与理论值相吻合,表明目的蛋白成功表达。
2.3 重组菌MG1655(pTrc99a-as/pBAD33-cydDC)的蛋白表达含双质粒的重组菌经IPTG和阿拉伯糖诱导后,进行SDS-PAGE电泳。结果(图 4)显示,与对照组相比,实验组有3条清晰区带,分别位于85、61和59 kD处,与理论位置相符,目的蛋白GshF及CydDC均表达成功。
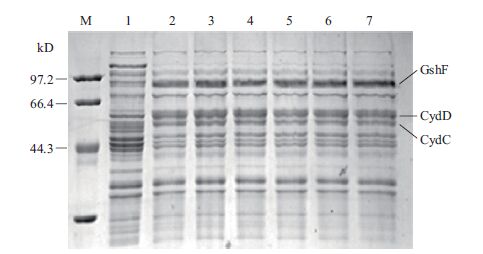
|
| 图 4 重组菌目的基因的表达 M:小分子量蛋白Marker;1:MG1655(pTrc99a);2-7:MG1655(pTrc99a-as/pBAD33-cydDC) |
分别对MG1655(pTrc99a-as/pBAD33)和MG-1655(pTrc99a-as/pBAD33-cydDC)进行培养,并检测培养细胞的谷胱甘肽合成。结果(图 5)显示,诱导后,随着培养时间延长,GSH产量逐渐增加,5 h达到最高,8.5 h因产物降解及氧化,产物积累有所降低。运输蛋白CydDC的过表达促进了产物谷胱甘肽的生产,5 h时重组菌MG1655(pTrc99a-as/ pBAD33-cydDC)的GSH产量是MG1655(pTrc99a-as/pBAD33)的1.11倍。
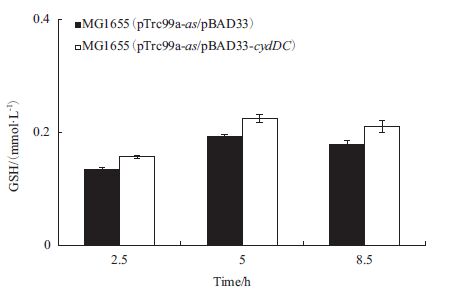
|
| 图 5 GSH生产对比 |
胞外GSH含量对比结果(图 6)显示,摇瓶培养时,对照菌MG1655(pTrc99a-as/pBAD33)胞外GSH含量达63.4%;过表达cydDC基因能促进GSH的胞外运输,MG1655(pTrc99a-as/pBAD33-cydDC)胞外GSH占总GSH的81.9%,是对照的1.29倍。
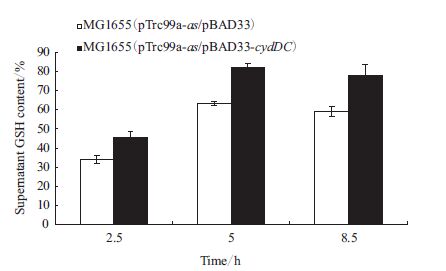
|
| 图 6 发酵样品上清液中GSH含量对比 |
底物的有效输出一直是高密度发酵法生产GSH所需解决的重要问题之一,国内外就如何提高胞外GSH含量做了许多研究。李华钟等[17]构建一株具有高谷胱甘肽合成活性的重组大肠肝菌,在发酵过程中对菌体进行通透性处理使得产物GSH分泌到细胞外,产量得到提高,但处理过程使用到甲苯等有毒的有机溶剂,不利于工业化。Perrone等[18]构建一株重组酵母菌,过表达gshⅠ和gshⅡ,并失活hac1及hgt1等相关基因,使酵母菌发酵过程中GSH分泌到胞外,但专利报道总GSH产量仅为0.06 mmol/L,胞外为0.03 mmol/L。Nie等[19]在利用产阮假丝酵母高密度发酵生产的基础上,考察了低pH胁迫对GSH合成的影响,结果表明,在发酵24 h后将pH由5.5降至1.2并维持6 h,细胞内的GSH几乎全部释放到胞外,GSH终产量是未处理前的1.25倍。
无论是添加表面活性剂对发酵菌体进行通透性处理,还是改变发酵条件进行胁迫,对GSH的分泌都起到一定作用,但同时也增加了发酵过程的操作难度及下游分离操作的难度,可见对菌体本身改造的重要性。
除了原核生物的GSH运输蛋白,真核生物的运输系统国外也有报道。Ballatori等[20]阐述了还原性谷胱甘肽的运输机制,介绍了膜蛋白家族MRP/CFTR/ABCC和OATP/SLC21A在谷胱甘肽运输中的作用。Kaluzna等[21]研究了大肠杆菌中谷胱甘肽S结合体的运输,证明了其与真核细胞运输的过程一致。Bourbouloux等[22]阐明了酵母高亲密性谷胱甘肽输入蛋白Hgt1p(OPT系统成员),该系统与其他酵母和一些植物中运输GSH的系统相似,但与大肠杆菌及大多高等真核生物中的不同。许善峰[23]专利中报道了一株重组毕赤酵母,能分泌生产GSH,其特征在于过表达基因MRP2突变体,并失活胞外向胞内运输谷胱甘肽的基因Hgt1,产物的运输得到明显改善,GSH产量也得到显著提高。CydDC作为原核生物的膜结合型运输蛋白,目前尚无在大肠杆菌中过表达以改善GSH运输的报道。本研究实现了GSH运输蛋白的表达,验证了其运输作用,对今后进一步提高GSH发酵生产具有重要意义。
4 结论本研究在大肠杆菌中过表达ABC型蛋白CydDC,并验证了其对谷胱甘肽的运输作用。过表达cydDC基因的重组菌,谷胱甘肽产量得到提高,达到0.22 mmol/L,且胞外GSH含量明显增加,达到81.9%,分别是对照的1.11倍和1.29倍。
| [1] | Anderson ME. Glutathione:an overview of biosynthesis and modulation. Chemico-Biological Interactions , 1998, 111-112 : 1–14. DOI:10.1016/S0009-2797(97)00146-4 |
| [2] | Penninckx MJ. A short review on the role of glutathione in the response of yeasts to nutritional, environmental, and oxidative stresses. Enzyme and Microbial Technology , 2000, 26 (9-10) : 737–742. DOI:10.1016/S0141-0229(00)00165-4 |
| [3] | DeLeve LD, Kaplowitz N. Importance and regulation of hepatic glutathione. Seminnars in Liver Disease , 1990, 10 (4) : 251–266. DOI:10.1055/s-2008-1040481 |
| [4] | Meister A. New developments in glutathione metabolism and their potential application in therapy. Hepatology , 1984, 4 (4) : 739–742. DOI:10.1002/hep.v4:4 |
| [5] | Meister A, Anderson ME. Glutathione. Annual Review of Biochemistry , 1983, 52 : 711–760. DOI:10.1146/annurev.bi.52.070183.003431 |
| [6] | Wang W, Ballatori N. Endogenous glutathione conjugates:occurrence and biological functions. Pharmacological Reviews , 1998, 50 (3) : 335–356. |
| [7] | Hammond CL, Lee TK, Ballatori N. Novel roles for glutathione in gene expression, cell death, andmembrane transport of organic solutes. Journal of Hepatology , 2001, 34 (6) : 946–954. DOI:10.1016/S0168-8278(01)00037-X |
| [8] | Paul GR, Alton M. Regulation of γ-glutamyl-cysteine synthetase by nonallosteric feedback inhibition by glutathione. The Journal of Biological Chemistry , 1975, 250 (4) : 1422–1426. |
| [9] | Srikanth CV, Bachhawat AK, Bourbouloux A. Multiple cis-regulatory elements and the yeast sulphur regulatory network are required for the regulation of the yeast glutathione transporter, Hgt1p. Current Genetics , 2005, 47 (6) : 345–358. DOI:10.1007/s00294-005-0571-7 |
| [10] | Ge S, Zhu T, Li Y. Expression of bacterial GshF in Pichia pastoris for glutathione production. Applied and Environmental Microbiology , 2012, 78 (15) : 5435–5439. DOI:10.1128/AEM.00509-12 |
| [11] | 野口真夫. 谷胱甘肽精制法:日本, 52100421[P]. 1997. |
| [12] | Ballatori N, Krance SM. Plasma membrane glutathione transporters and their roles in cell physiology and pathophysiology. Mol Aspects Med , 2009, 30 (1-2) : 13–28. DOI:10.1016/j.mam.2008.08.004 |
| [13] | Pittman MS, Robinson HC, Poole RK. A Bacterial glutathione tran-sporter(Escherichia coli CydDC)exports reductant to the peripl-asm. The Journal of Biological Chemistry , 2005, 280 (37) : 32254–32261. DOI:10.1074/jbc.M503075200 |
| [14] | RK Poole. Cytochrome bd biosynthesis in Escherichia coli:the sequences of the cydC and cydD genes suggest that they encode the components of an ABC membrane transporter. Molecular Microbiology , 1993, 10 (2) : 421–430. DOI:10.1111/mmi.1993.10.issue-2 |
| [15] | Pittman MS, Corker H. Cysteine is exported from the Escherichia coli cytoplasm by CydDC, an ATP-binding cassette-type transporter required for cytochrome assembly. J Biol Chem , 2002, 277 (51) : 49841–49849. DOI:10.1074/jbc.M205615200 |
| [16] | Poole R. Overexpression of the cyddc transporter. WO 2004/113373 A1[P]. 2004. |
| [17] | 李华钟, 李寅, 林金萍, 等. 具有高谷胱甘肽合成活性重组大肠杆菌的构建及合成反应过程. 微生物学报 , 2001, 41 (1) : 16–23. |
| [18] | Perrone GG, Dawes IW, Grant CM. Glutathione production. WO 2004/003217 A1[P]. 2004. |
| [19] | Nie W, Wei G, Du G, et al. Enhanced intracellular glutathione synthesis and excretion capability of Candida utilis by using a low pH-stress strategy. Lett Appl Microbiol , 2005, 40 (5) : 378–384. DOI:10.1111/lam.2005.40.issue-5 |
| [20] | Ballatori N, Hammond CL, Cunningham JB, et al. Molecular mechanisms of reduced glutathione transport:role of MRP/CFTR/ABCC and OATP/SLC21A families of membrane proteins. Toxicology and Applied Pharmacology , 2005, 204 (3) : 238–255. DOI:10.1016/j.taap.2004.09.008 |
| [21] | Kaluzna A, Bartosz G. Transport of glutathione s-conjugates in Escherichia coli. Biochemistry and Molecular Biology for Life Scientists , 1997, 43 (1) : 161–171. |
| [22] | Bourbouloux A, Shahi P, Chakladar A, et al. Hgt1p, a high affinity glutathione transporter from the yeast Sacchraomyces cerevisiae. J Biol Chem , 2000, 275 (18) : 13259–13265. DOI:10.1074/jbc.275.18.13259 |
| [23] | 许善峰. 分泌生产谷胱甘肽的重组菌株及其制备方法:中国, 103087932A[P]. 2013-05-08. |





